名校
1 . 室温下,向0.1 mol/L的柠檬酸的(Na3A)溶液中通入HCl气体(忽略溶液体积变化),溶液中H3A、H2A-、HA2-和A3-的分布系数 (X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
(X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
 (X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
(X) (某种含A微粒浓度与所有含A微粒浓度之和的比值)随pH变化曲线如图所示。下列说法错误的是
| A.曲线d表示A3- |
| B.A3-水解平衡常数Kh1=10-7.6 |
C.n点: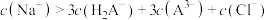 |
| D.pH为5左右时,通入HCl发生的反应为HA2-+H+=H2A- |
您最近半年使用:0次
2 . 下列实验探究方案中,对应 现象与结论的推断
现象与结论的推断
| 选项 | 实验 | 现象 | 结论 |
| A | 向5mL KI溶液中滴加1mL KI溶液中滴加1mL 的FeCl3溶液振荡,再滴加1~2滴KSCN溶液 的FeCl3溶液振荡,再滴加1~2滴KSCN溶液 | 溶液呈血红色 | FeCl3与KI的反应是可逆反应 |
| B | 将溴乙烷、乙醇和烧碱的混合物加热,将产生的气体通入溴水中 | 溴水褪色 | 溴乙烷发生了消去反应 |
| C | 向5mL ZnSO4溶液中加入1mL ZnSO4溶液中加入1mL Na2S溶液,再滴加几滴CuSO4溶液 Na2S溶液,再滴加几滴CuSO4溶液 | 先有白色沉淀生成,后转化为黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| D | 向硝酸钡溶液中通入SO2 | 产生白色沉淀 | 白色沉淀为BaSO3 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
解题方法
3 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
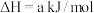
②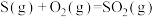
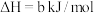
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
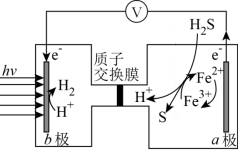
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

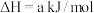
②
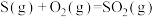
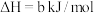
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近半年使用:0次
名校
解题方法
4 . 过氧化钙晶体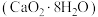 在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。以
在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。以 等为原料最终反应可制得
等为原料最终反应可制得 。工业生产过程如下:
。工业生产过程如下: ,实验中可采取的措施是
,实验中可采取的措施是_______ 。
(2)“搅拌”过程中发生的化学反应方程式为_______ 。生产过程中除水外,可循环使用的物质是_______ 。
(3)“搅拌”阶段,反应时间不宜过短也不宜过长,其中反应时间不宜过长的原因是_______ 。
(4) 加热脱水的过程中会发生副反应:
加热脱水的过程中会发生副反应: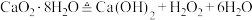 ,需不断通入不含二氧化碳的氧气,原因是
,需不断通入不含二氧化碳的氧气,原因是_______ 。(用化学方程式表示)
(5)以石灰石(含有少量碳酸亚铁和二氧化硅)为原料也可制备 ,完成制备
,完成制备 晶体的实验方案:在搅拌下,向
晶体的实验方案:在搅拌下,向 溶液中分批加入石灰石,充分反应后,
溶液中分批加入石灰石,充分反应后,_______ ,往滤液中加入 溶液制取纯
溶液制取纯 ,将制得的纯
,将制得的纯 再次溶解在
再次溶解在 溶液中,
溶液中,_______ ,反应至有大量固体出现,真空过滤,用少量冰水洗涤2—3次,干燥,得 。(已知:剩余离子浓度小于
。(已知:剩余离子浓度小于 时沉淀完全,
时沉淀完全, 时
时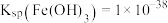 ,须使用的试剂或用品:氨水、
,须使用的试剂或用品:氨水、 溶液、冰水、
溶液、冰水、 试纸)
试纸)
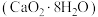 在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。以
在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。以 等为原料最终反应可制得
等为原料最终反应可制得 。工业生产过程如下:
。工业生产过程如下: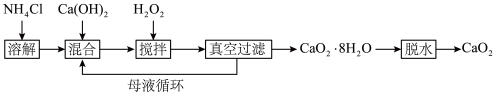
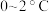 ,实验中可采取的措施是
,实验中可采取的措施是(2)“搅拌”过程中发生的化学反应方程式为
(3)“搅拌”阶段,反应时间不宜过短也不宜过长,其中反应时间不宜过长的原因是
(4)
 加热脱水的过程中会发生副反应:
加热脱水的过程中会发生副反应: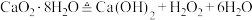 ,需不断通入不含二氧化碳的氧气,原因是
,需不断通入不含二氧化碳的氧气,原因是(5)以石灰石(含有少量碳酸亚铁和二氧化硅)为原料也可制备
 ,完成制备
,完成制备 晶体的实验方案:在搅拌下,向
晶体的实验方案:在搅拌下,向 溶液中分批加入石灰石,充分反应后,
溶液中分批加入石灰石,充分反应后, 溶液制取纯
溶液制取纯 ,将制得的纯
,将制得的纯 再次溶解在
再次溶解在 溶液中,
溶液中, 。(已知:剩余离子浓度小于
。(已知:剩余离子浓度小于 时沉淀完全,
时沉淀完全, 时
时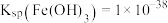 ,须使用的试剂或用品:氨水、
,须使用的试剂或用品:氨水、 溶液、冰水、
溶液、冰水、 试纸)
试纸)
您最近半年使用:0次
解题方法
5 . 从某冶炼厂鼓风炉中取出的烟灰主要含铜锌的氯化物、氧化物、硫酸盐以及少量铁元素,以此为原料回收制备铜和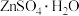 的流程如下:
的流程如下:
① 完全沉淀pH为3.2,此时
完全沉淀pH为3.2,此时 、
、 未开始沉淀
未开始沉淀
② 的溶解度曲线如图所示
的溶解度曲线如图所示
水洗是为了除氯。水洗温度对浸出率影响如表所示:
(1)水洗适宜温度是______ (填“25℃”或“85℃”);为防止 的干扰,检验滤液1中
的干扰,检验滤液1中 所需的试剂为
所需的试剂为 、
、 和
和______ 。
(2)碱洗时, 、
、 主要转化为碱式碳酸盐沉淀.
主要转化为碱式碳酸盐沉淀. 转化为
转化为 的离子方程式为
的离子方程式为_______ ;之所以不采用NaOH溶液碱洗的原因是锌元素会溶解损失,其中ZnO溶于NaOH溶液的化学方程式为_____ 。
(3)除铁时,依次加入 溶液、CuO固体。
溶液、CuO固体。 用量远大于理论计算量的原因是
用量远大于理论计算量的原因是______ ;加入CuO的作用是_______ 。
(4)电解时,电流过大会使获得的铜不纯,可能原因是_______ 。
(5)电解后,从溶液中获得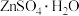 晶体的操作为
晶体的操作为_______ 、_____ 、洗涤、干燥。
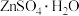 的流程如下:
的流程如下: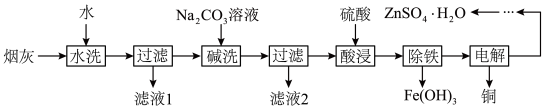
①
 完全沉淀pH为3.2,此时
完全沉淀pH为3.2,此时 、
、 未开始沉淀
未开始沉淀②
 的溶解度曲线如图所示
的溶解度曲线如图所示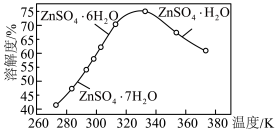
水洗是为了除氯。水洗温度对浸出率影响如表所示:
| 温度/℃ | 浸出率/% | |||
| Cl | Cu | Zn | Fe | |
| 25 | 42.34 | 24.67 | 1.09 | 0.08 |
| 85 | 49.26 | 25.13 | 3.99 | 0.05 |
(1)水洗适宜温度是
 的干扰,检验滤液1中
的干扰,检验滤液1中 所需的试剂为
所需的试剂为 、
、 和
和(2)碱洗时,
 、
、 主要转化为碱式碳酸盐沉淀.
主要转化为碱式碳酸盐沉淀. 转化为
转化为 的离子方程式为
的离子方程式为(3)除铁时,依次加入
 溶液、CuO固体。
溶液、CuO固体。 用量远大于理论计算量的原因是
用量远大于理论计算量的原因是(4)电解时,电流过大会使获得的铜不纯,可能原因是
(5)电解后,从溶液中获得
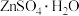 晶体的操作为
晶体的操作为
您最近半年使用:0次
6 . 室温下,二元酸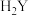 溶液中逐滴滴加NaOH溶液,混合溶液中粒子浓度与pH的关系如图所示。下列说法正确的是
溶液中逐滴滴加NaOH溶液,混合溶液中粒子浓度与pH的关系如图所示。下列说法正确的是
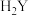 溶液中逐滴滴加NaOH溶液,混合溶液中粒子浓度与pH的关系如图所示。下列说法正确的是
溶液中逐滴滴加NaOH溶液,混合溶液中粒子浓度与pH的关系如图所示。下列说法正确的是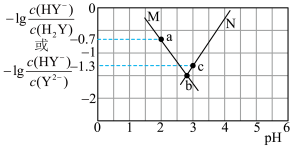
A.曲线M表示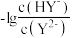 与pH的变化关系 与pH的变化关系 |
| B.a→c过程中,水的电离程度先增大后减小 |
C.b点溶液中: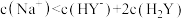 |
D.NaHY溶液中: |
您最近半年使用:0次
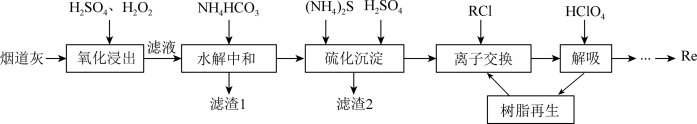
7 . 铼(Re)用于制造高效能火箭引擎。从辉钼矿氧化焙烧后的烟道灰(主要成分有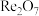 、
、 、
、 、CuO、
、CuO、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
已知:
回答下列问题:
(1)“氧化浸出”时, 被氧化为
被氧化为 ,
, 被氧化的离子方程式为
被氧化的离子方程式为___________ 。
(2)“水解中和”时,加 调节溶液pH=6。
调节溶液pH=6。
① 溶液中
溶液中
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②除钼的化合物外,滤渣1中还有___________ (填化学式)。
③计算此时溶液中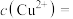
___________  。
。
(3)“硫化沉淀”时,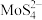 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为___________ 。
(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。
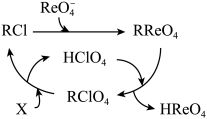
①树脂再生时需加入的试剂X为___________ (填化学式)。
②“解吸”所用 中的阴离子的空间构型为
中的阴离子的空间构型为___________ 。
(5)铼的某种氧化物的晶胞如图所示,该物质的化学式为___________ 。铼原子填在氧原子围成的___________ (填“四面体”、“立方体”或“八面体”)空隙中。

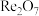 、
、 、
、 、CuO、
、CuO、 )中提取铼粉的一种工艺流程如图所示。
)中提取铼粉的一种工艺流程如图所示。
已知:
 |  |  | |
| 开始沉淀pH | 2.5 | 7.0 | 5.7 |
| 完全沉淀pH | 3.2 | 9.0 | 6.7 |
(1)“氧化浸出”时,
 被氧化为
被氧化为 ,
, 被氧化的离子方程式为
被氧化的离子方程式为(2)“水解中和”时,加
 调节溶液pH=6。
调节溶液pH=6。①
 溶液中
溶液中
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②除钼的化合物外,滤渣1中还有
③计算此时溶液中
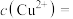
 。
。(3)“硫化沉淀”时,
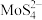 与
与 反应生成难溶的
反应生成难溶的 ,离子方程式为
,离子方程式为(4)“离子交换”“解吸”“树脂再生”一系列步骤中物质转化关系如图所示。

①树脂再生时需加入的试剂X为
②“解吸”所用
 中的阴离子的空间构型为
中的阴离子的空间构型为(5)铼的某种氧化物的晶胞如图所示,该物质的化学式为

您最近半年使用:0次
解题方法
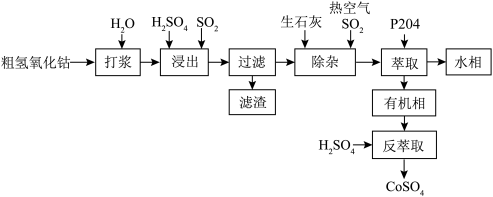
8 . 粗氢氧化钴Co(OH)3是以铜钴矿为原料湿法提取而得到的粗制钴盐中间品,含有MnOOH以及Al2O3、Fe3O4、Mg等杂质,粗氢氧化钴湿法制取精制硫酸钴流程如下:_______ (填元素名称)进行有效浸出。保持温度, 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为_______ mol/L。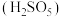 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ (已知: 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
_______ (保留一位小数)时,检验反应后的滤液中恰好不存在 (已知:
(已知: 的
的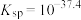 ,离子浓度
,离子浓度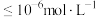 时沉淀完全)。
时沉淀完全)。
(3)在萃取剂一定量的情况下,提高萃取率的措施有_______ (答出一点即可),萃取后水相溶液中存在的金属离子有_______ 。
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是_______ 。
 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为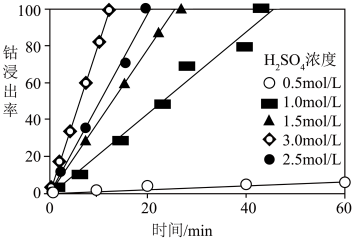
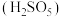 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
 (已知:
(已知: 的
的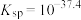 ,离子浓度
,离子浓度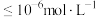 时沉淀完全)。
时沉淀完全)。(3)在萃取剂一定量的情况下,提高萃取率的措施有
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是

您最近半年使用:0次
名校
9 . 镍钴锰酸锂材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等优点。高纯硫酸锰作为合成镍钴锰酸锂材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含 等元素)制备的工艺流程如图所示。
等元素)制备的工艺流程如图所示。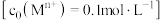 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:
回答下列问题:
(1) 的价层电子排布式为
的价层电子排布式为___________ 。
(2)写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:___________ 。
(3)下列有关该工艺流程的叙述正确的是___________(填标号)。
(4)“除杂2”步骤的目的是生成 沉淀从而除去
沉淀从而除去 。若使溶液中
。若使溶液中 沉淀完全,需维持
沉淀完全,需维持 不低于
不低于___________  [已知:
[已知: ]。
]。
(5)写出“沉锰”的离子方程式:___________ , 加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的
加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的 晶体,这里“一系列操作”主要是
晶体,这里“一系列操作”主要是___________ 。
(6)镍钴锰酸锂材料中根据镍钴锰的比例不同,可有不同的结构,其中一种底面为正六边形结构的晶胞如图所示。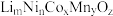 ,其中
,其中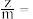
___________ 。
②已知晶胞底面边长是 ,高是
,高是 ,该图中晶胞的质量为
,该图中晶胞的质量为 ,计算该晶胞的密度
,计算该晶胞的密度
___________  (用计算式表示)。
(用计算式表示)。
 等元素)制备的工艺流程如图所示。
等元素)制备的工艺流程如图所示。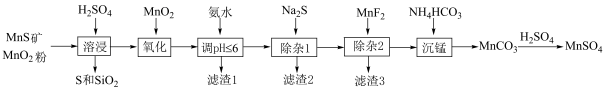
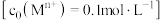 形成氢氧化物沉淀的
形成氢氧化物沉淀的 范围如下表所示:
范围如下表所示:| 金属离子 |  |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的 | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)
 的价层电子排布式为
的价层电子排布式为(2)写出“溶浸”中二氧化锰与硫化锰反应的化学方程式:
(3)下列有关该工艺流程的叙述正确的是___________(填标号)。
| A.“溶浸”将矿石粉碎能提高溶解效率 |
B.“氧化”步骤中添加的 的作用是催化剂 的作用是催化剂 |
C.“调 ”步骤中,是将 ”步骤中,是将 和 和 元素沉淀完全 元素沉淀完全 |
D.“除杂1”生成的沉淀为 和 和 |
(4)“除杂2”步骤的目的是生成
 沉淀从而除去
沉淀从而除去 。若使溶液中
。若使溶液中 沉淀完全,需维持
沉淀完全,需维持 不低于
不低于 [已知:
[已知: ]。
]。(5)写出“沉锰”的离子方程式:
 加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的
加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的 晶体,这里“一系列操作”主要是
晶体,这里“一系列操作”主要是(6)镍钴锰酸锂材料中根据镍钴锰的比例不同,可有不同的结构,其中一种底面为正六边形结构的晶胞如图所示。
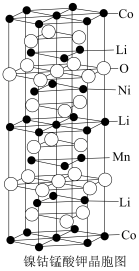
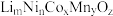 ,其中
,其中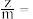
②已知晶胞底面边长是
 ,高是
,高是 ,该图中晶胞的质量为
,该图中晶胞的质量为 ,计算该晶胞的密度
,计算该晶胞的密度
 (用计算式表示)。
(用计算式表示)。
您最近半年使用:0次
名校
解题方法
10 .  是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
经查阅资料知:红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成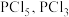 遇水会强烈水解生成
遇水会强烈水解生成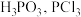 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。
回答下列问题:
(1)仪器F的名称是___________ ,装置G中反应的化学方程式为___________ 。
(2)实验时,检查装置气密性后,先打开 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是___________ 。
(3)装置C中的反应需要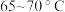 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是___________ ,最适合的加热方式为___________ (填“水浴”或“油浴”)加热。
(4)制得的 粗产品中常含有
粗产品中常含有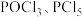 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过___________ (填实验操作名称),即可得到较纯净的 。
。
(5)通过实验测定粗产品中 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取 粗产品,加水完全水解;
粗产品,加水完全水解;
第二步:配成 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;
第三步:加入 碘溶液
碘溶液 ,反应完全;
,反应完全;
第四步:加入几滴淀粉溶液,用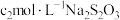 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。
判断滴定达到终点时的现象是___________ ,粗产品中 的质量分数表达式为
的质量分数表达式为___________ 。(已知:①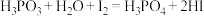 ;②
;② )
)
 是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
| 物质 | 熔点 | 沸点 |
 |  | 75.5 |
 | 2 | 105.3 |
 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成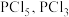 遇水会强烈水解生成
遇水会强烈水解生成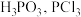 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。回答下列问题:
(1)仪器F的名称是
(2)实验时,检查装置气密性后,先打开
 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是(3)装置C中的反应需要
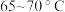 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是(4)制得的
 粗产品中常含有
粗产品中常含有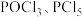 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过 。
。(5)通过实验测定粗产品中
 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):第一步:迅速移取
 粗产品,加水完全水解;
粗产品,加水完全水解;第二步:配成
 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;第三步:加入
 碘溶液
碘溶液 ,反应完全;
,反应完全;第四步:加入几滴淀粉溶液,用
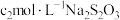 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。判断滴定达到终点时的现象是
 的质量分数表达式为
的质量分数表达式为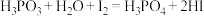 ;②
;② )
)
您最近半年使用:0次



