解题方法
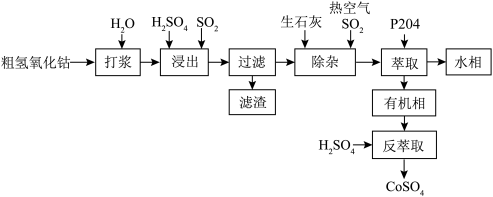
1 . 粗氢氧化钴Co(OH)3是以铜钴矿为原料湿法提取而得到的粗制钴盐中间品,含有MnOOH以及Al2O3、Fe3O4、Mg等杂质,粗氢氧化钴湿法制取精制硫酸钴流程如下:_______ (填元素名称)进行有效浸出。保持温度, 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为_______ mol/L。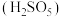 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ (已知: 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
_______ (保留一位小数)时,检验反应后的滤液中恰好不存在 (已知:
(已知: 的
的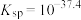 ,离子浓度
,离子浓度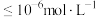 时沉淀完全)。
时沉淀完全)。
(3)在萃取剂一定量的情况下,提高萃取率的措施有_______ (答出一点即可),萃取后水相溶液中存在的金属离子有_______ 。
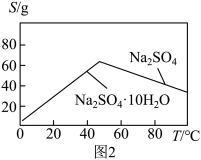
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是_______ 。
 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为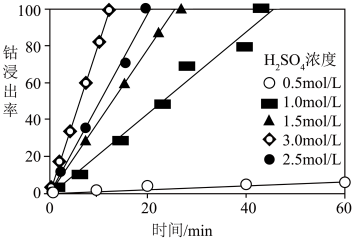
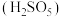 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
 (已知:
(已知: 的
的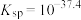 ,离子浓度
,离子浓度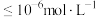 时沉淀完全)。
时沉淀完全)。(3)在萃取剂一定量的情况下,提高萃取率的措施有
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是

您最近半年使用:0次
解题方法
2 . 锂离子电池是新能源重要组成部分,锂离子电池的回收利用日渐成为化学工作者的重要研究课题。某研究组利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺流程如下:
进行氯化处理以回收Li、Co等金属,工艺流程如下: ,
,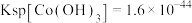 。
。
回答下列问题:
(1)基态Co原子的价层电子排布式是___________ 。
(2)“烧渣”是LiCl、 和
和 的混合物,请写出“500℃焙烧”的化学方程式
的混合物,请写出“500℃焙烧”的化学方程式___________ 。
(3)“500℃焙烧”后剩余的 应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释
应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释 比
比 易水解的原因
易水解的原因___________ 。
(4)若“滤液2”中 浓度为:
浓度为: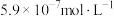 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为___________ 。
(5)“沉锂”步骤的“试剂A”的化学式为___________ 。
(6)将“滤饼2”在通入充足空气后,进行850℃煅烧才能得到 。写出该过程的化学方程式
。写出该过程的化学方程式___________ 。
(7)钴酸锂(LiCoO2)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为___________ 。
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺流程如下:
进行氯化处理以回收Li、Co等金属,工艺流程如下: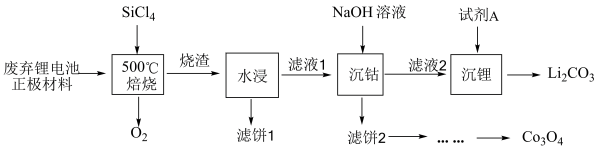
 ,
,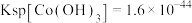 。
。回答下列问题:
(1)基态Co原子的价层电子排布式是
(2)“烧渣”是LiCl、
 和
和 的混合物,请写出“500℃焙烧”的化学方程式
的混合物,请写出“500℃焙烧”的化学方程式(3)“500℃焙烧”后剩余的
 应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释
应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释 比
比 易水解的原因
易水解的原因(4)若“滤液2”中
 浓度为:
浓度为: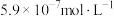 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为(5)“沉锂”步骤的“试剂A”的化学式为
(6)将“滤饼2”在通入充足空气后,进行850℃煅烧才能得到
 。写出该过程的化学方程式
。写出该过程的化学方程式(7)钴酸锂(LiCoO2)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
 的个数为
的个数为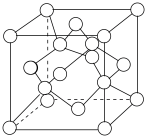
您最近半年使用:0次
解题方法
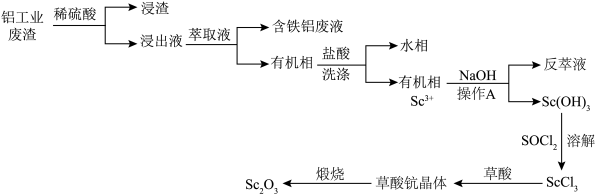
3 . 钪(Sc)可用于制造特种玻璃、轻质耐高温合金及半导体器件等,在航天,航空、核反应、医疗等方面有广泛应用。以制铝工业提取氧化铝时排出的废渣(含有Se2O3,Al2O3、Fe2O3、SiO2等)为原料提取氧化钪(Sc2O3)的流程如下:
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有___________ (任写两条);浸渣的主要用途有___________ 。
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe= ×100%]的影响如图2所示:
×100%]的影响如图2所示:___________ ,料液的最适合温度为___________ 。
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为___________ 。
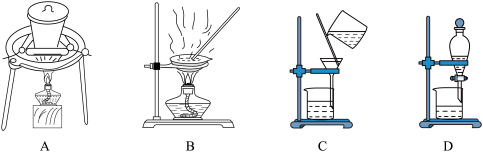
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为___________ (填字母)。___________ 。
(6)25℃时,pH=2的草酸溶液中 =
=___________ 。
②25℃时,Ka1(H2C2O4)=5.0×10-2、Ka2(H2C2O4)=5.0×10-5。
回答下列问题:
(1)废渣酸浸时,为了提高浸出率,可采取的措施有
(2)“萃取”时选用酸性磷酸酯(P507)为主的复合萃取剂,其中P507的质量分数(ω)对萃取率的影响如图1所示,料液温度对分离系数[分离系数指分离后混合体系中某物质的物质的量分数,如βSc/Fe=
 ×100%]的影响如图2所示:
×100%]的影响如图2所示:
(3)一般认为c≤1.0×10-5mol/L时沉淀完全,已知lg2≈0.3,反萃取时,为了让Sc3+沉淀完全,应控制溶液pH的最小值为
(4)在实验室中完成操作A和煅烧草酸钪晶体,所需装置分别为
(6)25℃时,pH=2的草酸溶液中
 =
=
您最近半年使用:0次
解题方法
4 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①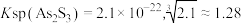 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有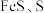 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当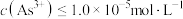 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: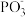
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①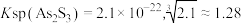 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
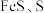 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当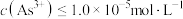 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: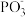
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近半年使用:0次
7日内更新
|
124次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题
名校
解题方法
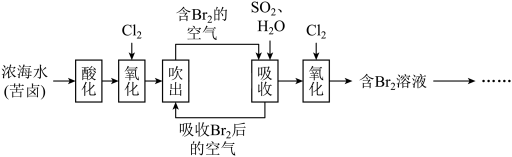
5 . 已知海水中溴元素主要以Br形式存在,工业上从海水中提取溴的流程如下:____________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:_____________ 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是____________ 。
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:_________ 。
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是

| A.NaOH | B.FeCl2 | C.Na2SO3 | D.H2O |
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为
您最近半年使用:0次
名校
解题方法
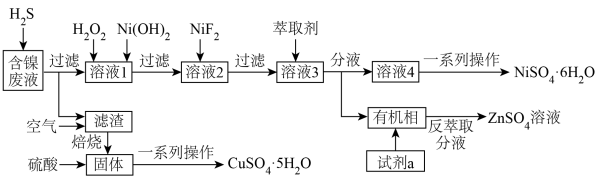
6 . 从工业含镍的废液(主要含Ni2+,Cu2+,Fe2+,Ca2+,Zn2+等)中提纯得到硫酸镍晶体并回收胆矾晶体,某课题小组设计了图流程:
(1)基态Ni2+的价层电子排布式为_______ 。
(2)“滤渣”在空气中焙烧产生一种气体,其化学式为_______ 。
(3)请写出向“溶液1”中依次加入 、
、 的离子方程式
的离子方程式_______ 。
(4)若“溶液2”中 的浓度为0.01mol/L,取等体积的
的浓度为0.01mol/L,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时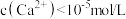 ,则所加
,则所加 溶液的浓度至少为
溶液的浓度至少为_______  。[已知室温下
。[已知室温下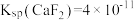 ]
]
(5)室温下选择萃取剂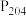 (二乙基已基磷酸,用HR表示),其萃取原理为(
(二乙基已基磷酸,用HR表示),其萃取原理为( ,试剂a为
,试剂a为_______ (填化学式);若溶液3加萃取剂前pH=3,c(Zn2+)=0.011mol/L,多次萃取后水相中c(H+)为1.3×10-2mol/L,则锌的萃取率为_______ %(结果保留一位小数,溶液体积变化忽略不计)。溶液pH对几种离子的萃取率的影响如图,萃取锌时,控制pH的范围为3~4原因是_______ 。
| 金属离子 |  |  |  |  |  |  |
| 开始沉淀的pH | 4.2 | 6.3 | 1.5 | 11.8 | 6.2 | 6.9 |
| 沉淀完全的pH | 6.7 | 8.3 | 2.8 | 13.8 | 8.2 | 8.9 |
(1)基态Ni2+的价层电子排布式为
(2)“滤渣”在空气中焙烧产生一种气体,其化学式为
(3)请写出向“溶液1”中依次加入
 、
、 的离子方程式
的离子方程式(4)若“溶液2”中
 的浓度为0.01mol/L,取等体积的
的浓度为0.01mol/L,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时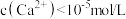 ,则所加
,则所加 溶液的浓度至少为
溶液的浓度至少为 。[已知室温下
。[已知室温下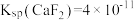 ]
](5)室温下选择萃取剂
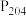 (二乙基已基磷酸,用HR表示),其萃取原理为(
(二乙基已基磷酸,用HR表示),其萃取原理为( ,试剂a为
,试剂a为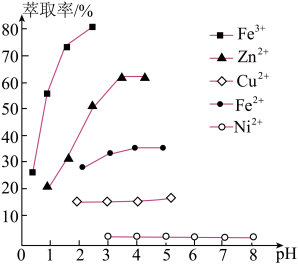
您最近半年使用:0次
解题方法
7 . 一种利用铅铋合金(主要成分为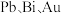 ,杂质为
,杂质为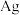 )制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为
)制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为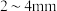 的合金颗粒。
的合金颗粒。
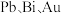 ,杂质为
,杂质为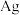 )制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为
)制备草酸铅的工艺流程如图所示。其中,熔化和制粒两步工序的具体操作为:将铅铋合金加热熔化后,以一定的流速加入水中,形成直径为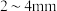 的合金颗粒。
的合金颗粒。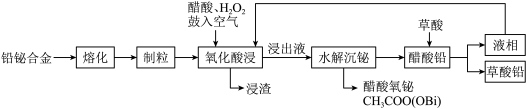
| A.熔化和制粒的目的是增大铅铋合金与反应物的接触面积 |
B.氧化酸浸工序中, 和空气中的 和空气中的 作氧化剂 作氧化剂 |
C.氧化酸浸工序所得浸渣的主要成分为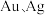 |
D.制备草酸铅的反应可表示为: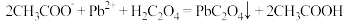 |
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
8 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示: 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(2)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(2)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
您最近半年使用:0次
名校
解题方法
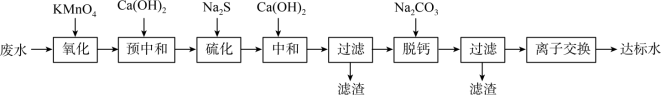
9 . 湿法炼锌的工业废水中主要阳离子有Zn2+、H+、Tl+、Tl3+,废水除铊的工艺流程如图。 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。
②部分物质的 如表:
如表:
③排放标准:Tl的含量低于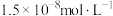 。
。
回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为___________ ,价电子排布式为___________ 。
(2)已知“氧化”步骤中 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式:___________ ,反应后仍存在少量的 。
。
(3)“预中和”步骤中加入 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少___________ (填化学式)污染物的生成。
(4)“硫化”步骤的主要目的是除去___________ (填离子符号)。
(5)在“中和”步骤中,若要使溶液中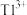 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于___________ 。
(6)“离子交换”步骤中可用普鲁士蓝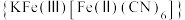 (其摩尔质量为
(其摩尔质量为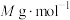 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为___________ cm(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 能够在pH为0~14的范围内以离子态稳定存在,不易与
能够在pH为0~14的范围内以离子态稳定存在,不易与 形成沉淀。
形成沉淀。②部分物质的
 如表:
如表:| 物质 |  | 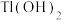 | ZnS |  |
 | 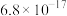 |  |  |  |
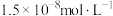 。
。回答下列问题:
(1)Tl的原子序数为81,在元素周期表中的位置为
(2)已知“氧化”步骤中
 被还原为
被还原为 ,请写出该反应的离子方程式:
,请写出该反应的离子方程式: 。
。(3)“预中和”步骤中加入
 至溶液的pH约为7,可减少“硫化”步骤中
至溶液的pH约为7,可减少“硫化”步骤中 的使用量,还能减少
的使用量,还能减少(4)“硫化”步骤的主要目的是除去
(5)在“中和”步骤中,若要使溶液中
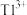 的含量低于排放标准,请根据
的含量低于排放标准,请根据 计算溶液的pH应大于
计算溶液的pH应大于(6)“离子交换”步骤中可用普鲁士蓝
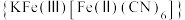 (其摩尔质量为
(其摩尔质量为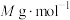 )中的
)中的 与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[
与残余铊离子进行离子交换,进一步实现废水中铊的去除。普鲁士蓝晶胞的如下[ 未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为
未标出,其占据四个互不相邻的小立方体(晶胞的部分)的体心]。若该晶体的密度为 ,则
,则 和
和 的最短距离为
的最短距离为 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。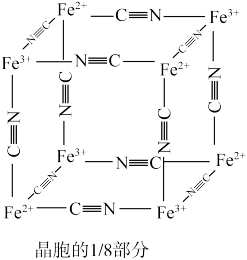
您最近半年使用:0次
名校
解题方法
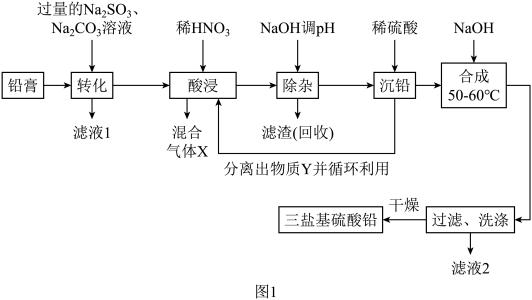
10 . 现以铅蓄电池的填充物铅膏(主要含PbSO4、PbO2、PbO和少量FeO)为原料,可生产三盐基硫酸铅(PbSO4·3PbO·H2O)和副产品Fe2O3·xH2O,其工艺流程如下: ,
,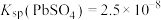 ,
,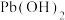 具有两性,PbO2有强氧化性。
具有两性,PbO2有强氧化性。
(1)铅和碳同主族,与Cs同周期,则铅的外围电子轨道表示式为__________ 。
(2)“转化”后的难溶物质为PbCO3和少量PbSO4,则PbO2转化为PbCO3的离子方程式为__________ ,滤液1中 和
和 的浓度之比为
的浓度之比为__________ 。
(3)在50~60℃“合成”三盐基硫酸铅的化学方程式为__________ 。“合成”需控制溶液的pH不能大于10的原因为__________ 。
(4)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得Na2SO4晶体的操作为将“滤液”调节pH为7,然后蒸发浓缩、__________ ,洗涤后干燥 作抗震添加剂,但皮肤长期接触对身体有害。
作抗震添加剂,但皮肤长期接触对身体有害。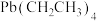 是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于
是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于__________ 晶体。已知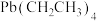 晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是__________ 。
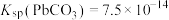 ,
,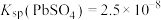 ,
,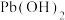 具有两性,PbO2有强氧化性。
具有两性,PbO2有强氧化性。(1)铅和碳同主族,与Cs同周期,则铅的外围电子轨道表示式为
(2)“转化”后的难溶物质为PbCO3和少量PbSO4,则PbO2转化为PbCO3的离子方程式为
 和
和 的浓度之比为
的浓度之比为(3)在50~60℃“合成”三盐基硫酸铅的化学方程式为
(4)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得Na2SO4晶体的操作为将“滤液”调节pH为7,然后蒸发浓缩、
 作抗震添加剂,但皮肤长期接触对身体有害。
作抗震添加剂,但皮肤长期接触对身体有害。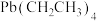 是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于
是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于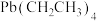 晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
您最近半年使用:0次
2024-04-18更新
|
407次组卷
|
3卷引用:2024届河北省部分示范性高中2023-2024学年高三下学期一模化学试题
2024届河北省部分示范性高中2023-2024学年高三下学期一模化学试题河北省2024届高三下学期3月大数据应用调研联合测评(六)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)



