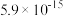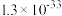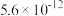名校
解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)写出基态 价电子的轨道表示式
价电子的轨道表示式___________ 。第三周期主族元素中,第一电离能比Mg元素高的有___________ 种。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中S元素的化合价为
),其中S元素的化合价为___________ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、 ;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被
;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;再加入石灰乳,所得滤渣中主要成分是 、
、___________ (填化学式)。
(4)①将“钴镍渣”酸溶后,先加入NaClO溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②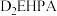 (以
(以 表示)为一种有效的金属萃取剂,不溶于水。用
表示)为一种有效的金属萃取剂,不溶于水。用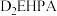 萃取酸浸液中的镍:
萃取酸浸液中的镍: ,已知萃取前溶液pH=3,
,已知萃取前溶液pH=3,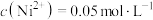 ,萃取完成后溶液pH=1,则镍的萃取率=
,萃取完成后溶液pH=1,则镍的萃取率=___________ [萃取率= ]。
]。
(5)一种钴镍氧化物的立方晶胞结构如图,晶胞结构中有两种八面体空隙,一种全部由O构成(用x表示),另一种由O和Ni共同构成(用y表示),则晶体中x和y的数目之比为___________ ;已知晶胞参数为a pm,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
___________ (列出计算式)。
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)写出基态
 价电子的轨道表示式
价电子的轨道表示式(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中S元素的化合价为
),其中S元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、 ;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被
;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、(4)①将“钴镍渣”酸溶后,先加入NaClO溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:②
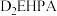 (以
(以 表示)为一种有效的金属萃取剂,不溶于水。用
表示)为一种有效的金属萃取剂,不溶于水。用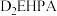 萃取酸浸液中的镍:
萃取酸浸液中的镍: ,已知萃取前溶液pH=3,
,已知萃取前溶液pH=3,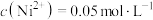 ,萃取完成后溶液pH=1,则镍的萃取率=
,萃取完成后溶液pH=1,则镍的萃取率= ]。
]。(5)一种钴镍氧化物的立方晶胞结构如图,晶胞结构中有两种八面体空隙,一种全部由O构成(用x表示),另一种由O和Ni共同构成(用y表示),则晶体中x和y的数目之比为
 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数

您最近半年使用:0次
名校
解题方法
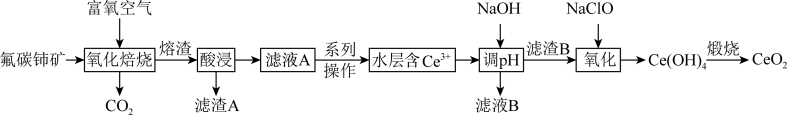
2 . 二氧化铈(CeO2)是一种典型的金属氧化物,具有较强的氧化性广泛应用于多相催化反应,并作为汽车尾气净化的三效催化剂的重要组成成分。以氟碳铈矿(主要含CeFCO3、BaO等)为原料制备CeO2的一种工艺流程如下图所示: ;②滤液A中含:
;②滤液A中含: 、
、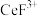 等离子。
等离子。
回答下列问题:
(1)滤渣A的主要成分是___________ (填化学式);“酸浸”不用盐酸的理由是_________ (答一点即可)。
(2)“系列操作”包含以下几个过程:已知: 不能溶于有机物TBP;
不能溶于有机物TBP;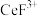 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: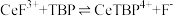 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是___________ ,“有机层B”中发生反应的离子方程式为___________ 。水层中的一种溶质,理论上可以在工艺流程图中的_________ 工序中循环利用,减小“调pH”工序中 的用量,节约生产成本。
的用量,节约生产成本。 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于________ (已知25℃时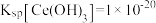 )。
)。
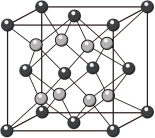
(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是________ ;晶体中一个Ce周围与其最近的O的个数为________ 。
 ;②滤液A中含:
;②滤液A中含: 、
、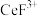 等离子。
等离子。回答下列问题:
(1)滤渣A的主要成分是
(2)“系列操作”包含以下几个过程:已知:
 不能溶于有机物TBP;
不能溶于有机物TBP;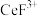 能溶于有机物TBP,且存在反应:
能溶于有机物TBP,且存在反应: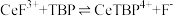 。“滤液A”中加入有机物TBP后的分离方法是
。“滤液A”中加入有机物TBP后的分离方法是 的用量,节约生产成本。
的用量,节约生产成本。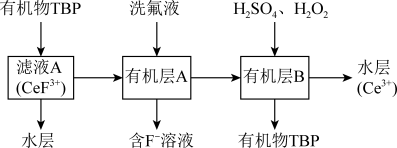
 沉淀完全(通常认为溶液中离子浓度小于
沉淀完全(通常认为溶液中离子浓度小于 为沉淀完全),应控制pH大于
为沉淀完全),应控制pH大于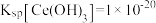 )。
)。(4)二氧化铈立方晶胞如图所示,则铈原子Ce在晶胞中的位置是
您最近半年使用:0次
解题方法
3 . 催化裂化是石油精炼中最重要的转化之一、FCC催化剂中含有多种金属元素,一种针对FCC废催化剂(含较多的CeO2、铁铝的氧化物和少量其他可溶于酸的物质)综合回收利用的工艺流程如下:
②常温下Ksp[Fe(OH)2]=4.0×10-16,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=3.0×10-33,lg2=0.3。
回答下列问题:
(1)已知基态Ce原子价层电子排布式为4f15d16s2,它有___________ 个未成对电子,它的最高正化合价为___________ 。
(2)物质X为___________ ,若利用pH传感器监测反应2,当pH=___________ 时,Fe3+已沉淀完全。(c(Fe3+) ≤ 1×10-5mol/L时视为完全沉淀)
(3)从溶液中获得NH4Al(SO4)2•6H2O晶体的“一系列操作”包括___________ 、过滤、洗涤、常温干燥。SO 的空间构型为
的空间构型为___________ 。
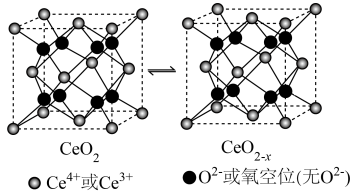
(4)CeO2是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,假设CeO2晶胞边长为a pm,CeO2晶体结构中与Ce4+相邻且最近的Ce4+有___________ 个,CeO2晶胞中Ce4+与最近O2-的核间距为___________ ,每个CeO2-x晶胞中Ce4+个数为___________ 。

②常温下Ksp[Fe(OH)2]=4.0×10-16,Ksp[Fe(OH)3]=8.0×10-38,Ksp [Al(OH)3]=3.0×10-33,lg2=0.3。
回答下列问题:
(1)已知基态Ce原子价层电子排布式为4f15d16s2,它有
(2)物质X为
(3)从溶液中获得NH4Al(SO4)2•6H2O晶体的“一系列操作”包括
 的空间构型为
的空间构型为(4)CeO2是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示,假设CeO2晶胞边长为a pm,CeO2晶体结构中与Ce4+相邻且最近的Ce4+有
您最近半年使用:0次
解题方法
4 . 铊(Tl)广泛应用于电子、军工、航天等领域。一种从铅精矿焙烧产生的富铊灰(主要成分为PbO、ZnO、FeO、Fe2O3、Tl2O)中回收铊的工艺流程如图所示:
①Tl+易被氧化为Tl3+
②在氯化物-硫酸水溶液中,Tl元素以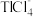 形式存在
形式存在
③萃取过程的反应原理为:H++CH3CONR2+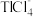
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
④常温下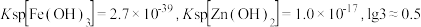
请回答下列问题:
(1)铊(81Tl)与铝同主族,基态 原子的价电子轨道表示式为
原子的价电子轨道表示式为________ 。
(2)“浸取Ⅰ”中Tl2O发生反应的化学方程式为________ 。
(3)滤渣的主要成分为________ 。
(4)常温下,向“萃取分液”后的水相中加入NaOH溶液,调pH回收铁。已知水相中c(Zn2+)=0.1mol/L,控制pH范围为_______ (已知当溶液中离子浓度小于10-5mol/L时,通常认为该离子沉淀完全,结果保留一位小数)。
(5)请从化学平衡的角度解释“反萃取”过程中加入CH3COONH4溶液的原因________ 。
(6)“还原氯化沉淀”中反应的离子方程式为_______ 。
(7)铊镉合金是原子能工业重要材料,其一种立方晶胞结构如图所示,已知该铊镉合金密度为 ,设
,设 为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=
为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=_____ nm(用含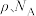 的代数式表示)。
的代数式表示)。
①Tl+易被氧化为Tl3+
②在氯化物-硫酸水溶液中,Tl元素以
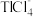 形式存在
形式存在③萃取过程的反应原理为:H++CH3CONR2+
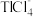
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4 ④常温下
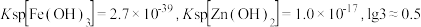
请回答下列问题:
(1)铊(81Tl)与铝同主族,基态
 原子的价电子轨道表示式为
原子的价电子轨道表示式为(2)“浸取Ⅰ”中Tl2O发生反应的化学方程式为
(3)滤渣的主要成分为
(4)常温下,向“萃取分液”后的水相中加入NaOH溶液,调pH回收铁。已知水相中c(Zn2+)=0.1mol/L,控制pH范围为
(5)请从化学平衡的角度解释“反萃取”过程中加入CH3COONH4溶液的原因
(6)“还原氯化沉淀”中反应的离子方程式为
(7)铊镉合金是原子能工业重要材料,其一种立方晶胞结构如图所示,已知该铊镉合金密度为
 ,设
,设 为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d=
为阿伏加德罗常数的值,则铊原子和镉原子之间的最短距离d= 的代数式表示)。
的代数式表示)。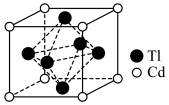
您最近半年使用:0次
解题方法
5 . 硒和碲是重要的稀散元素,都可以作为半导体材料。一种从碲碱渣(碲和硒的含量较高,还含有少量 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下: 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。
② 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。
③亚硒酸为二元弱酸,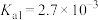 、
、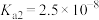
回答下列问题:
(1)硒与氧同族,基态 原子价电子排布式为
原子价电子排布式为___________ 。比较键角大小:
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ 。
(2)“除杂渣”的主要成分为___________ 。
(3)“中和”时控制 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是___________ 。
(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的 为2,此时溶液中
为2,此时溶液中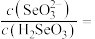
___________ 。
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式___________ 。
(6)一种以 和
和 为电极、
为电极、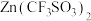 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成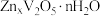 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式___________ 。
 、
、 等元素)分离硒回收碲的工艺流程如下:
等元素)分离硒回收碲的工艺流程如下:
 、
、 及少量可溶性的铜、铅化合物等。
及少量可溶性的铜、铅化合物等。②
 为两性氧化物,微溶于水。
为两性氧化物,微溶于水。③亚硒酸为二元弱酸,
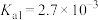 、
、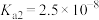
回答下列问题:
(1)硒与氧同族,基态
 原子价电子排布式为
原子价电子排布式为
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是(2)“除杂渣”的主要成分为
(3)“中和”时控制
 为
为 ,生成
,生成 沉淀,若硫酸过量,将导致
沉淀,若硫酸过量,将导致 的回收率下降的原因是
的回收率下降的原因是(4)“酸浸液”中硒主要以亚硒酸的形式存在。若控制“酸浸液”的
 为2,此时溶液中
为2,此时溶液中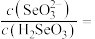
(5)“沉硒”时生成了一种无污染的单质气体,写出“沉硒”时发生的主要反应的化学方程式
(6)一种以
 和
和 为电极、
为电极、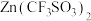 水溶液为电解质的电池,放电时,
水溶液为电解质的电池,放电时, 插入
插入 层间形成
层间形成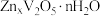 。写出该电池放电时正极的电极反应式
。写出该电池放电时正极的电极反应式
您最近半年使用:0次
名校
解题方法
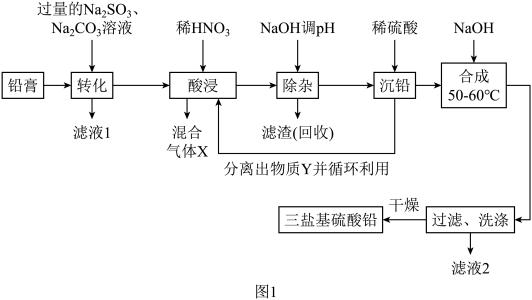
6 . 现以铅蓄电池的填充物铅膏(主要含PbSO4、PbO2、PbO和少量FeO)为原料,可生产三盐基硫酸铅(PbSO4·3PbO·H2O)和副产品Fe2O3·xH2O,其工艺流程如下: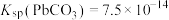 ,
,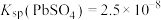 ,
,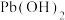 具有两性,PbO2有强氧化性。
具有两性,PbO2有强氧化性。
(1)铅和碳同主族,与Cs同周期,则铅的外围电子轨道表示式为__________ 。
(2)“转化”后的难溶物质为PbCO3和少量PbSO4,则PbO2转化为PbCO3的离子方程式为__________ ,滤液1中 和
和 的浓度之比为
的浓度之比为__________ 。
(3)在50~60℃“合成”三盐基硫酸铅的化学方程式为__________ 。“合成”需控制溶液的pH不能大于10的原因为__________ 。
(4)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得Na2SO4晶体的操作为将“滤液”调节pH为7,然后蒸发浓缩、__________ ,洗涤后干燥 作抗震添加剂,但皮肤长期接触对身体有害。
作抗震添加剂,但皮肤长期接触对身体有害。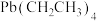 是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于
是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于__________ 晶体。已知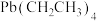 晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是__________ 。
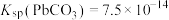 ,
,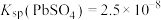 ,
,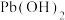 具有两性,PbO2有强氧化性。
具有两性,PbO2有强氧化性。(1)铅和碳同主族,与Cs同周期,则铅的外围电子轨道表示式为
(2)“转化”后的难溶物质为PbCO3和少量PbSO4,则PbO2转化为PbCO3的离子方程式为
 和
和 的浓度之比为
的浓度之比为(3)在50~60℃“合成”三盐基硫酸铅的化学方程式为
(4)根据图2所示的溶解度随温度的变化曲线,由“滤液1”和“滤液2”获得Na2SO4晶体的操作为将“滤液”调节pH为7,然后蒸发浓缩、
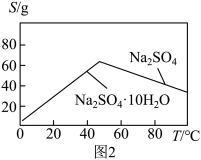
 作抗震添加剂,但皮肤长期接触对身体有害。
作抗震添加剂,但皮肤长期接触对身体有害。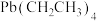 是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于
是一种难电离且易溶于有机溶剂的配合物,其晶体类型属于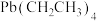 晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
晶体的堆积方式如图3,则其在xy平面上的二维堆积中的配位数是
您最近半年使用:0次
2024-05-03更新
|
586次组卷
|
4卷引用:2024届河北省部分示范性高中2023-2024学年高三下学期一模化学试题
2024届河北省部分示范性高中2023-2024学年高三下学期一模化学试题河北省2024届高三下学期3月大数据应用调研联合测评(六)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)(已下线)提升练07 工艺流程综合-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)
2024高三·全国·专题练习
解题方法
7 . 氯化亚铜(CuCl)是重要的铜盐系列产品,某学习小组用海绵铜制取氯化亚铜的流程如下: )。
)。
Ⅰ.海绵铜的溶解。
经观察,海绵铜(主要成分是Cu和CuO)在“溶解”过程中未产生气泡,反应原理如下。
反应①:CuO+H2SO4=CuSO4+H2O (较快)。
反应②:_______ (较慢)。
(1)写出反应②的化学方程式:_______ 。
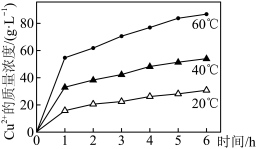
(2)实验过程中,测得不同温度下浸出液中Cu2+的质量浓度如下图所示。图中显示在第1h内铜的浸出率较大,其原因是_______ 。
利用海绵铜“溶解”后的溶液与(NH4)2SO3、NH4Cl反应,可制备氯化亚铜,装置如下图所示。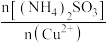 =0.6最为适宜,原因是
=0.6最为适宜,原因是_______ 。
(4)氯化铵用量 与Cu2+沉淀率的关系如下表所示,Cu2+沉淀率在比值为1.1时最大的原因是
与Cu2+沉淀率的关系如下表所示,Cu2+沉淀率在比值为1.1时最大的原因是_______ 。
(5)“醇洗”的优点是_______ 。
Ⅲ.氯化亚铜的提纯。
(6)已知: 水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。
水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。_______ 。(实验中须使用的试剂与仪器:饱和NaCl溶液、0.1 mol·L-1的H2SO4溶液、乙醇、真空干燥箱)
 )。
)。Ⅰ.海绵铜的溶解。
经观察,海绵铜(主要成分是Cu和CuO)在“溶解”过程中未产生气泡,反应原理如下。
反应①:CuO+H2SO4=CuSO4+H2O (较快)。
反应②:_______ (较慢)。
(1)写出反应②的化学方程式:
(2)实验过程中,测得不同温度下浸出液中Cu2+的质量浓度如下图所示。图中显示在第1h内铜的浸出率较大,其原因是
利用海绵铜“溶解”后的溶液与(NH4)2SO3、NH4Cl反应,可制备氯化亚铜,装置如下图所示。
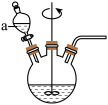
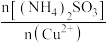 =0.6最为适宜,原因是
=0.6最为适宜,原因是(4)氯化铵用量
 与Cu2+沉淀率的关系如下表所示,Cu2+沉淀率在比值为1.1时最大的原因是
与Cu2+沉淀率的关系如下表所示,Cu2+沉淀率在比值为1.1时最大的原因是 | 0.8 | 0.9 | 1.0 | 1.1 | 1.2 | 1.3 |
| Cu2+沉淀率/% | 35.3 | 73.2 | 85.2 | 91.3 | 79.2 | 65.4 |
(5)“醇洗”的优点是
Ⅲ.氯化亚铜的提纯。
(6)已知:
 水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。
水解可生成CuCl。温度、pH对CuCl产率的影响如下图所示。 
您最近半年使用:0次
解题方法
8 . 钪(Sc)及其化合物在超导合金和催化剂等领域有重要应用。一种利用钛白废酸液(含Sc3+、TiO2+、Fe3+的硫酸废液)和赤泥(含Sc2O3,Al2O3,Fe2O3,SiO2)联合制备Sc2O3的工艺流程如图所示。
②常温下,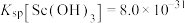 ;
; 。
。
请回答下列问题:
(1)若“浸取”后的浸取液pH<1,则浸渣的主要成分是___________ (填化学式)。
(2)“除钛”时,加入H2O2的作用是___________ 。
(3)25°C时,若使“反萃取”后水溶液中的Sc3+沉淀完全(离子浓度小于10-5mol⋅L ),应控制溶液的pH不低于
),应控制溶液的pH不低于___________ (保留两位有效数字)。
(4)写出“沉钪”时生成Sc2(C2O4)3·6H2O的离子方程式:___________ 。
(5)1 mol草酸钪晶体Sc2(C2O4)3·6H2O充分“灼烧”时,理论上转移电子的物质的量为___________ 。

②常温下,
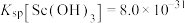 ;
; 。
。请回答下列问题:
(1)若“浸取”后的浸取液pH<1,则浸渣的主要成分是
(2)“除钛”时,加入H2O2的作用是
(3)25°C时,若使“反萃取”后水溶液中的Sc3+沉淀完全(离子浓度小于10-5mol⋅L
 ),应控制溶液的pH不低于
),应控制溶液的pH不低于(4)写出“沉钪”时生成Sc2(C2O4)3·6H2O的离子方程式:
(5)1 mol草酸钪晶体Sc2(C2O4)3·6H2O充分“灼烧”时,理论上转移电子的物质的量为
您最近半年使用:0次
名校
解题方法
9 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: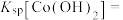
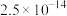 、
、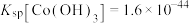 、
、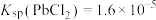 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,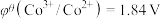 、
、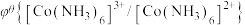
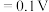 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: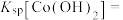
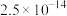 、
、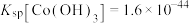 、
、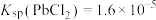 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,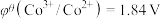 、
、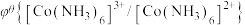
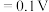 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近半年使用:0次
名校
解题方法
10 . Ni、Co均是重要的战略性金属。从处理后的矿石硝酸浸取液(Ni2+、Co2+、Al3+、Mg2+)中,利用氨浸工艺可提取Ni、Co,并获得高附加值化工产品。工艺流程如下: 、
、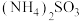 和
和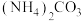 配制。常温下,
配制。常温下,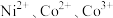 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: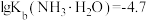 ;
; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。
回答下列问题:
(1)活性 可与水反应,化学方程式为
可与水反应,化学方程式为_____________ 。
(2)常温下, 的氨性溶液中,
的氨性溶液中,
__________ 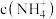 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)“氨浸”时,由 转化为
转化为 的离子方程式为
的离子方程式为_________________ 。
(4)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。
①NH4Al(OH)2CO3属于__________ (填“晶体”或“非晶体”)。
②(NH4)2CO3提高了 、
、 的浸取速率,其原因是
的浸取速率,其原因是_______________ 。
(5)由 可制备
可制备 晶体,其立方晶胞如图。A1与O最小间距大于
晶体,其立方晶胞如图。A1与O最小间距大于 与O最小间距,x、y为整数,则
与O最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为__________ 。 溶液中
溶液中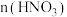 与
与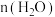 的比值,理论上最高为
的比值,理论上最高为__________ 。

 、
、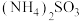 和
和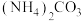 配制。常温下,
配制。常温下,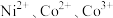 与
与 形成可溶于水的配离子:
形成可溶于水的配离子: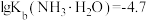 ;
; 易被空气氧化为
易被空气氧化为 ;部分氢氧化物的
;部分氢氧化物的 如下表。
如下表。氢氧化物 |
|
|
|
|
|
|
|
|
|
|
|
(1)活性
 可与水反应,化学方程式为
可与水反应,化学方程式为(2)常温下,
 的氨性溶液中,
的氨性溶液中,
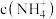 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)“氨浸”时,由
 转化为
转化为 的离子方程式为
的离子方程式为(4)(NH4)2CO3会使滤泥中的一种胶状物质转化为疏松分布的棒状颗粒物。滤渣的X射线衍射图谱中,出现了NH4Al(OH)2CO3的明锐衍射峰。
①NH4Al(OH)2CO3属于
②(NH4)2CO3提高了
 、
、 的浸取速率,其原因是
的浸取速率,其原因是(5)由
 可制备
可制备 晶体,其立方晶胞如图。A1与O最小间距大于
晶体,其立方晶胞如图。A1与O最小间距大于 与O最小间距,x、y为整数,则
与O最小间距,x、y为整数,则 在晶胞中的位置为
在晶胞中的位置为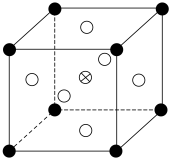
 溶液中
溶液中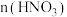 与
与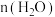 的比值,理论上最高为
的比值,理论上最高为
您最近半年使用:0次