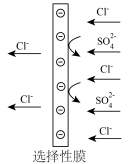
1 . 常温下,用0.5mol·L-1NaHCO3溶液滴定25.00mL0.25mol·L-1CaCl2溶液,消耗NaHCO3溶液的体积与混合液pH关系如下图所示。滴定过程中有白色沉淀生成,但整个过程未见气泡产生。已知:碳酸Ka1=4.5×10-7,Ka2=4.7×10-11;Ksp(CaCO3)=3.4×10-9。下列说法正确的是
| A.ab段溶液有白色沉淀生成 |
B.ab段pH升高的主要原因: +Ca2+=CaCO3↓+H+ +Ca2+=CaCO3↓+H+ |
C.b点:c( )>c(H2CO3) )>c(H2CO3) |
D.c点2c( )+c( )+c( )<2c(Ca2+) )<2c(Ca2+) |
您最近半年使用:0次
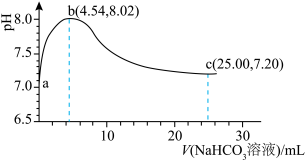
2 . 向10mLHCOOH-NH4Cl混合溶液(浓度均为0.1mol·L−1)中滴加0.1mol·L−1NaOH溶液,并监测溶液pH变化,实验数据如图。由该实验可得到的结论是
| A.HCOOH电离方程式为HCOOH=H++HCOO− |
| B.由a点数据可推出电离能力:HCOOH>NH3·H2O |
| C.b点溶液中的OH−主要来自HCOO−水解 |
| D.0.05mol·L−1氨水的pH<10.89 |
您最近半年使用:0次
3 . 室温下,向Mg(NO3)2溶液、HF溶液、CH3CH2COOH溶液中分别滴加NaOH溶液,测得溶液中pH与pX[pX=-lgX,X代表 、
、 、
、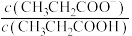 ]的关系如图所示。
]的关系如图所示。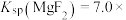
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是
已知:
 、
、 、
、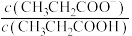 ]的关系如图所示。
]的关系如图所示。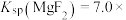
 ,HF的酸性比CH3CH2COOH强。下列叙述正确的是
,HF的酸性比CH3CH2COOH强。下列叙述正确的是已知:

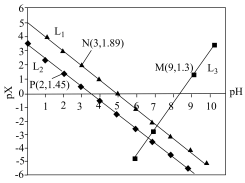
A. 代表的是pH与 代表的是pH与 的关系 的关系 |
B. 的 的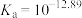 |
C. 的 的 |
| D.含相同浓度NaF、HF的混合溶液的pH>7 |
您最近半年使用:0次
解题方法
4 . 亚砷酸 在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法
在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法不正确 的是
 在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法
在溶液中存在多种微粒形态,KOH溶液滴入亚砷酸溶液,各种微粒物质的量分数与溶液pH关系如图所示。下列说法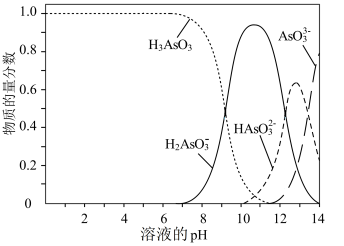
A. 的 的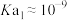 |
B.由图像信息可知 为三元弱酸 为三元弱酸 |
C.当pH调至8~11时,主要反应的离子方程式为 |
D. 时溶液中: 时溶液中: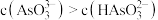 |
您最近半年使用:0次
5 . 氧化钪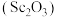 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪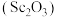 的一种流程如下图。
的一种流程如下图。

回答下列问题:
(1)基态钪原子的价层电子排布式为___________ 。
(2)“萃取”时,钛白工业废酸中加入 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的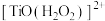 ,其中钛的化合价为
,其中钛的化合价为___________ ; 的作用是
的作用是___________ (填标号)。
A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将 试剂沿烧杯内壁缓慢注入
试剂沿烧杯内壁缓慢注入 试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入
试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入 试剂中,并不断搅拌,则A、C分别对应上述试剂中的
试剂中,并不断搅拌,则A、C分别对应上述试剂中的___________ 、___________ 。
(4)萃取剂萃取 的原理为
的原理为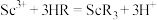 (
( 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成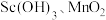 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为___________ 。 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为___________  (已知:
(已知: 时,
时,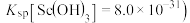 。
。
(5)“沉钪”时用到草酸。已知草酸的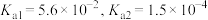 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中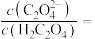
___________ 。
(6)在空气中焙烧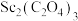 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为___________ 。
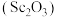 可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含
可用作半导体镀层的蒸镀材料,也可制成可变波长的固体激光器和高清晰度的电视电子枪、金属卤化物灯等。以钛白工业废酸(含 、
、 等离子)为原料制备氧化钪
等离子)为原料制备氧化钪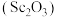 的一种流程如下图。
的一种流程如下图。
回答下列问题:
(1)基态钪原子的价层电子排布式为
(2)“萃取”时,钛白工业废酸中加入
 可降低钛的萃取率,可能是生成了难萃取的
可降低钛的萃取率,可能是生成了难萃取的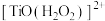 ,其中钛的化合价为
,其中钛的化合价为 的作用是
的作用是A.作氧化剂 B.作还原剂 C.提供配体
(3)“洗涤”时,洗涤剂是用
 和
和 三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将
三种试剂按一定比例混合而成。实验室中混合三种试剂的操作是:将 试剂沿烧杯内壁缓慢注入
试剂沿烧杯内壁缓慢注入 试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入
试剂中,并用玻璃棒不断搅拌,冷却后再将所得混合液缓慢注入 试剂中,并不断搅拌,则A、C分别对应上述试剂中的
试剂中,并不断搅拌,则A、C分别对应上述试剂中的(4)萃取剂萃取
 的原理为
的原理为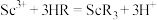 (
( 代表萃取剂)。在“反萃取”中,加入
代表萃取剂)。在“反萃取”中,加入 溶液后生成
溶液后生成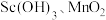 等物质,其中生成含
等物质,其中生成含 化合物的化学方程式为
化合物的化学方程式为 时,经“反萃取”后所得滤液的
时,经“反萃取”后所得滤液的 ,则残留的
,则残留的 浓度为
浓度为 (已知:
(已知: 时,
时,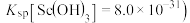 。
。(5)“沉钪”时用到草酸。已知草酸的
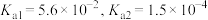 ,则在
,则在 时,
时, 的草酸溶液中
的草酸溶液中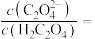
(6)在空气中焙烧
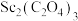 只生成一种碳氧化物的化学方程式为
只生成一种碳氧化物的化学方程式为
您最近半年使用:0次
6 . Al3+与F-具有很强的亲和性,AlF在NaF溶液中存在分步电离: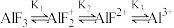 。常温下实验测定
。常温下实验测定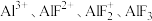 的百分含量随
的百分含量随 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
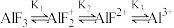 。常温下实验测定
。常温下实验测定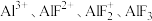 的百分含量随
的百分含量随 变化如图所示,下列说法错误的是
变化如图所示,下列说法错误的是
A.曲线b表示 |
B.N点时, |
C.M点溶液中 |
D.常温下, 化学平衡常数的数量级为1015 化学平衡常数的数量级为1015 |
您最近半年使用:0次
7 . 请回答下列问题:
(1)现有常温下 的盐酸(甲)和
的盐酸(甲)和  的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:
①常温下 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是___________ (填字母)。
A.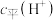 B.
B.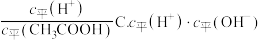 D.
D.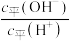
②取 的乙溶液,加入等体积的水,醋酸的电离平衡
的乙溶液,加入等体积的水,醋酸的电离平衡___________ (填“向左”“向右”或“不”)移动;另取10 的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中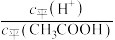 的值将
的值将___________ (填“增大”“减小”或“无法确定”)。
③相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的 大小关系为
大小关系为  (甲)
(甲)___________  (乙)(填>、<”或“=”)。
(乙)(填>、<”或“=”)。
(2)联氨(又称肼, ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为___________ ,其一级电离常数 
___________ 。
(已知: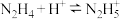 的
的 )
)
(3)已知 的
的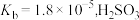 的
的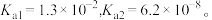 若氨水的浓度为
若氨水的浓度为 ,溶液中的c平(OH-)=
,溶液中的c平(OH-)=___________ mol/L。将  通入该氨水中,当
通入该氨水中,当  降至
降至  时,溶液中的
时,溶液中的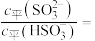
___________ 。
(1)现有常温下
 的盐酸(甲)和
的盐酸(甲)和  的醋酸溶液(乙),请根据下列操作回答:
的醋酸溶液(乙),请根据下列操作回答:①常温下
 溶液加水稀释过程,下列表达式的数值一定变小的是
溶液加水稀释过程,下列表达式的数值一定变小的是A.
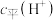 B.
B.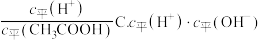 D.
D.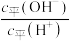
②取
 的乙溶液,加入等体积的水,醋酸的电离平衡
的乙溶液,加入等体积的水,醋酸的电离平衡 的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中
的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中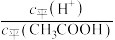 的值将
的值将③相同条件下,取等体积的甲、乙两溶液,分别加水稀释100倍,所得溶液的
 大小关系为
大小关系为  (甲)
(甲) (乙)(填>、<”或“=”)。
(乙)(填>、<”或“=”)。(2)联氨(又称肼,
 ,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨是二元弱碱,在水中的电离方程式与氨相似,其一级电离方程式为
(已知:
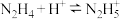 的
的 )
)(3)已知
 的
的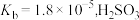 的
的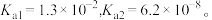 若氨水的浓度为
若氨水的浓度为 ,溶液中的c平(OH-)=
,溶液中的c平(OH-)= 通入该氨水中,当
通入该氨水中,当  降至
降至  时,溶液中的
时,溶液中的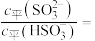
您最近半年使用:0次
8 . 气态亚硝酸( 或HONO)是大气中的一种污染物。
或HONO)是大气中的一种污染物。
(1)亚硝酸的电离平衡常数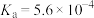 ,其电离方程式为
,其电离方程式为___________ 。
(2)亚硝酸进入人体可以与二甲胺[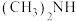 ]迅速反应生成亚硝酸胺[
]迅速反应生成亚硝酸胺[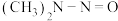 ],亚硝酸胺是一种化学致癌物。
],亚硝酸胺是一种化学致癌物。
①亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:___________ 、消去反应。
②上述反应机理的反应过程与能量变化的关系如图所示。亚硝酸与二甲胺反应生成亚硝酸胺的△H___________ (填“>”或“<”)0。反应难度更大的是过程___________ (填“ⅰ”或“ⅱ”)。
①已知:
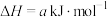 ;
;

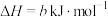 ;
;

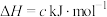 。
。
则反应 的∆H=
的∆H=___________  。
。
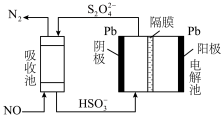
②用间接电化学法除去NO的过程如图所示。用离子方程式表示吸收池中除去NO的原理:___________ 。
 或HONO)是大气中的一种污染物。
或HONO)是大气中的一种污染物。(1)亚硝酸的电离平衡常数
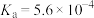 ,其电离方程式为
,其电离方程式为(2)亚硝酸进入人体可以与二甲胺[
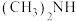 ]迅速反应生成亚硝酸胺[
]迅速反应生成亚硝酸胺[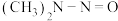 ],亚硝酸胺是一种化学致癌物。
],亚硝酸胺是一种化学致癌物。①亚硝酸与二甲胺反应生成亚硝酸胺的一种反应机理如下:
HONO+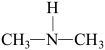

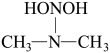


②上述反应机理的反应过程与能量变化的关系如图所示。亚硝酸与二甲胺反应生成亚硝酸胺的△H

①已知:

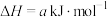 ;
;
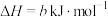 ;
;
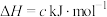 。
。则反应
 的∆H=
的∆H= 。
。②用间接电化学法除去NO的过程如图所示。用离子方程式表示吸收池中除去NO的原理:
您最近半年使用:0次
9 . 常温下,水溶液中H2A、HA-、A2-、HB、B-的分布系数 [如
[如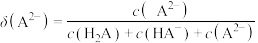 ]随POH变化曲线如图1所示,溶液中
]随POH变化曲线如图1所示,溶液中 与
与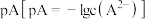 关系如图2所示。用0.1mol·L-1H2A溶液滴定20.00mL0.1mol·L-1BaB2溶液,若混合后溶液体积变化忽略不计,下列说法错误的是
关系如图2所示。用0.1mol·L-1H2A溶液滴定20.00mL0.1mol·L-1BaB2溶液,若混合后溶液体积变化忽略不计,下列说法错误的是
 [如
[如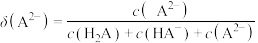 ]随POH变化曲线如图1所示,溶液中
]随POH变化曲线如图1所示,溶液中 与
与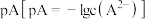 关系如图2所示。用0.1mol·L-1H2A溶液滴定20.00mL0.1mol·L-1BaB2溶液,若混合后溶液体积变化忽略不计,下列说法错误的是
关系如图2所示。用0.1mol·L-1H2A溶液滴定20.00mL0.1mol·L-1BaB2溶液,若混合后溶液体积变化忽略不计,下列说法错误的是
A.常温下,H2A的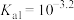 |
B.当滴入5.00mLH2A溶液时,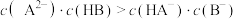 |
| C.当滴入20.00mLH2A溶液时,此时溶液的pH约为5.1 |
D.当溶液的pOH=7时, |
您最近半年使用:0次
7日内更新
|
555次组卷
|
2卷引用:山东省济南市2023-2024学年高三下学期3月模拟(一模)考试化学试题
解题方法
10 . 氯碱厂制备的原盐中含有的杂质主要为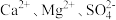 及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。
及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。 的电离常数
的电离常数
(1)溶浸工序中,以下除杂试剂:①过量的 ②过量的
②过量的 ③过量的
③过量的 ,正确的加入顺序为
,正确的加入顺序为_____ 。
A.②①③ B.③①② C.①③②
(2)在脱氯工序中加入 除去游离的氯的离子方程式为
除去游离的氯的离子方程式为_____ 。
(3)用 溶液吸收一定量
溶液吸收一定量 气体形成
气体形成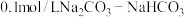 缓冲溶液,
缓冲溶液, 时,溶液中
时,溶液中
_____ 。
(4)利用膜的选择性,可除去脱氯过程中引入的 ,通过“错流”方式截留下
,通过“错流”方式截留下 ,使
,使 以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
最好的选择是_____ 膜,该膜脱硫率高的原因是_____ 。
(5)一种镧镍储氢合金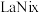 晶体的结构单元如图所示,“电解2”产生的
晶体的结构单元如图所示,“电解2”产生的 与其结合后形成
与其结合后形成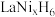 (
( 进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。
进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。 中,
中,
_____ , 的配位数为
的配位数为_____ 。
② 该合金可以储存
该合金可以储存_____ 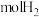 。
。
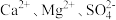 及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。
及大分子有机物和难溶性泥沙等物质。为供给电解槽以合格的盐水,可采用以下工艺流程精制盐水。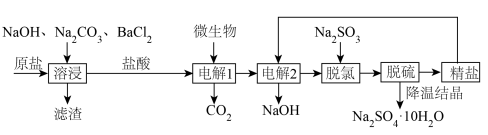
 的电离常数
的电离常数
(1)溶浸工序中,以下除杂试剂:①过量的
 ②过量的
②过量的 ③过量的
③过量的 ,正确的加入顺序为
,正确的加入顺序为A.②①③ B.③①② C.①③②
(2)在脱氯工序中加入
 除去游离的氯的离子方程式为
除去游离的氯的离子方程式为(3)用
 溶液吸收一定量
溶液吸收一定量 气体形成
气体形成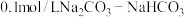 缓冲溶液,
缓冲溶液, 时,溶液中
时,溶液中
(4)利用膜的选择性,可除去脱氯过程中引入的
 ,通过“错流”方式截留下
,通过“错流”方式截留下 ,使
,使 以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:
以渗透液的形式输送到后续工序。不同膜对介质的截留率,相关离子系数如下表:| 截留率 物质 | 反渗透膜(%) | 纳滤膜(%) | 超滤膜(%) |
|
 | 99 | 15.6 | 0 | |
 | 99 | 99 | 0 | |
| 系数 离子 | 水合离子半径 | 扩散系数/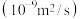 | ||
 | 0.397 | 1.065 | ||
 | 0.332 | 2.032 | ||
(5)一种镧镍储氢合金
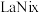 晶体的结构单元如图所示,“电解2”产生的
晶体的结构单元如图所示,“电解2”产生的 与其结合后形成
与其结合后形成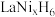 (
( 进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。
进入合金后解离成氢原子并填充在晶胞空隙中,晶胞体积不变)。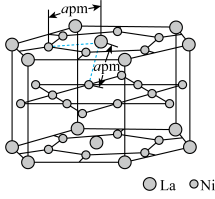
 中,
中,
 的配位数为
的配位数为②
 该合金可以储存
该合金可以储存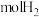 。
。
您最近半年使用:0次