名校
解题方法
1 . 高磷镍铁是生产钙镁磷肥的副产品。以高磷镍铁(主要含金属单质 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
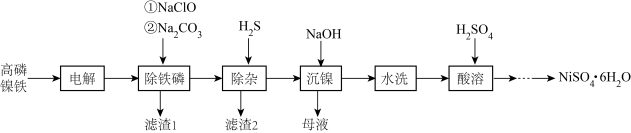
(1)“电解”时,选用 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作___________ (填“阳极”或“阴极”);另一极的主要电极反应为:_____________________ 。此外,溶液中的 有部分在阴极放电。
有部分在阴极放电。
(2)“沉镍”时,离子方程式为___________________________________________ ,为确保镍沉淀完全,理论上应调节溶液
_____________ (已知:在该工业环境下, ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。
(3)已知: 时,
时, 、
、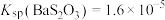 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为________ 。
(4)从 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:___________ 、__________ 、过滤、洗涤、干燥。
 、
、 、非金属单质P,还含有少量
、非金属单质P,还含有少量 、
、 、
、 的磷化物)为原料生产硫酸镍晶体
的磷化物)为原料生产硫酸镍晶体 的工艺流程如图。
的工艺流程如图。
(1)“电解”时,选用
 硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作
硫酸溶液为电解液。将高磷镍铁制成电极板,则该电极板作 有部分在阴极放电。
有部分在阴极放电。(2)“沉镍”时,离子方程式为

 ;当溶液中离子浓度
;当溶液中离子浓度 时,可认为该离子沉淀完全)。
时,可认为该离子沉淀完全)。(3)已知:
 时,
时, 、
、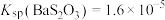 。向上述流程制得的
。向上述流程制得的 溶液中加入
溶液中加入 固体,充分反应后,过滤可得到
固体,充分反应后,过滤可得到 溶液。生成
溶液。生成 的化学方程式为
的化学方程式为(4)从
 溶液里获取
溶液里获取 的操作主要有:
的操作主要有:
您最近一年使用:0次
2024-03-01更新
|
109次组卷
|
2卷引用:江西省上饶市2023-2024学年高二上学期期末教学质量测试化学试卷
解题方法
2 . 某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
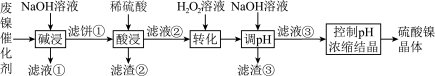
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是___________ (写一个化学方程式就可以)。为回收金属,通常用稀硫酸将“滤液①”调为中性,生成沉淀,该沉淀的化学式为___________ 。
(2)“滤液②”中含有的金属离子除了“ ”,还有
”,还有___________ 。
(3)“转化”中加入 的主要作用是
的主要作用是___________ (用离子方程式表示)。
(4)利用上述表格数据,计算 的
的
___________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:___________ (填数值)。
 ):
):
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是(2)“滤液②”中含有的金属离子除了“
 ”,还有
”,还有(3)“转化”中加入
 的主要作用是
的主要作用是(4)利用上述表格数据,计算
 的
的
 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:
您最近一年使用:0次
名校
解题方法
3 . 某科研小组制备了新型锂离子电池电极材料-ZnLix/Li3N。科研小组以废旧锌锰电池的锌皮为原料合成该电极材料,简易流程如下:

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
回答下列问题:
(1)提高“酸浸”速率的措施有_____ (答一条即可),“调pH”的范围为_____ 。
(2)“沉锌”的离子方程式为_____ 。
(3)系列操作包括的操作步骤有_____ 、过滤、洗涤、干燥
(4)SOCl2的作用是_____ (用化学方程式表示)。
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
如果氧化剂X选择硝酸,其后果是_____ 和会产生大气污染物。从下列物质中选择氧化剂X,杂质除去率最高的是_____ (填标号)。
A.NaClO B.Cl2 C.O2 D.O3
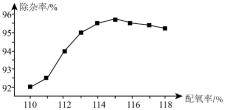
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:_____ 。

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 2.2 | 7.5 | 8.0 | 6.5 |
| 完全沉淀的pH | 3.5 | 9.5 | 10.8 | 8.5 |
(1)提高“酸浸”速率的措施有
(2)“沉锌”的离子方程式为
(3)系列操作包括的操作步骤有
(4)SOCl2的作用是
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
| 物质 | HClO/Cl- | Cl2/Cl- | O2/H2O | O3/O2 | HNO3/NO | Fe3+/Fe2+ | MnO2/Mn2+ |
| φ0 | 1.482 | 1.358 | 1.229 | 2.076 | 0.983 | 0.771 | 1.224 |
A.NaClO B.Cl2 C.O2 D.O3
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:

您最近一年使用:0次
名校
解题方法
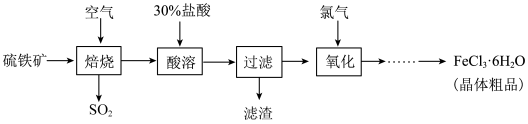
4 . 以硫铁矿(主要成分为 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下:
)的工艺流程如下:
(1)焙烧产生的 可以继续制备硫酸,以下有关接触法制硫酸的论述错误的是___________。
可以继续制备硫酸,以下有关接触法制硫酸的论述错误的是___________。
(2)转化器是接触法制硫酸的核心场所,写出该场所发生的化学方程式:___________ 。
(3)热交换器是转化器中发挥着至关重要的作用,其中包括___________。
(4)酸溶时,不能用硫酸代替盐酸,原因:___________ 。
(5)“氧化”后,测得室温下溶液的pH=3,若忽略溶液中HCl的影响,相较于纯水,此时水的电离程度被___________ (填“促进”或“抑制”)了___________ 倍;若将溶液中HCl的影响考虑在内,则此时水的电离___________ 。
A.被促进 B.被抑制 C.无法直接判断
 )为原料制备氯化铁晶体(
)为原料制备氯化铁晶体( )的工艺流程如下:
)的工艺流程如下:
(1)焙烧产生的
 可以继续制备硫酸,以下有关接触法制硫酸的论述错误的是___________。
可以继续制备硫酸,以下有关接触法制硫酸的论述错误的是___________。| A.为提高反应速率和原料利用率,硫铁矿要在“沸腾”状态下燃烧 |
| B.为防止催化剂中毒,气体在进转化器前要先净化 |
C.为提高 的利用率,需通入过量空气 的利用率,需通入过量空气 |
D.吸收塔中 从下而上,水从上而喷下,剩余气体从上部出来放空 从下而上,水从上而喷下,剩余气体从上部出来放空 |
(2)转化器是接触法制硫酸的核心场所,写出该场所发生的化学方程式:
(3)热交换器是转化器中发挥着至关重要的作用,其中包括___________。
| A.预热未反应的气体,充分利用热能 |
| B.降低产物的温度,便于液化分离 |
| C.减小已达平衡的混合气体的压强,进一步提高产率 |
| D.降低已达平衡的混合气体温度,进一步提高转化率 |
(4)酸溶时,不能用硫酸代替盐酸,原因:
(5)“氧化”后,测得室温下溶液的pH=3,若忽略溶液中HCl的影响,相较于纯水,此时水的电离程度被
A.被促进 B.被抑制 C.无法直接判断
您最近一年使用:0次
名校
解题方法
5 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中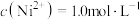 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中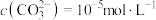 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。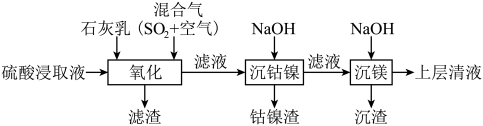
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
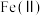 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是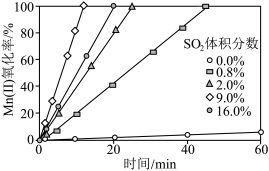
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
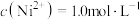 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中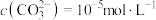 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近一年使用:0次
2024-02-17更新
|
463次组卷
|
4卷引用:安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题
安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
解题方法
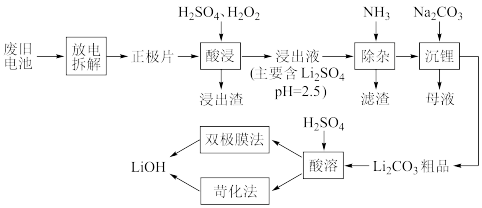
6 . 利用以下流程回收废旧电池正极材料(主要含 、
、 等)中
等)中 金属资源.
金属资源.
已知:i. 难溶于水可溶于酸,
难溶于水可溶于酸, 、
、 微溶于水.
微溶于水.
ii.25℃时,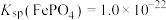 ,
, 的
的 ,
, ,
, .
.
(1)“放电拆解”过程中 从
从__________ (填“正”或“负”,下同)极经电解质溶液移向__________ 极.
(2)“酸浸”过程生成 的化学方程式为
的化学方程式为_________ .
(3)“浸出液”检测出微量 ,此时
,此时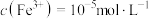 ,则溶液中
,则溶液中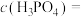
________ .
(4) 溶解度随温度升高而降低.“沉锂”后为提高
溶解度随温度升高而降低.“沉锂”后为提高 的析出量和纯度应进行的操作为
的析出量和纯度应进行的操作为_________ .
(5)“双极膜法”获得 的原理如图.
的原理如图.

① 从
从__________ (选填“一室”“二室”或“三室”)获得.
②该法总反应化学方程式为__________ .
③该法产生可在流程中循环使用的物质为__________ (填化学式).
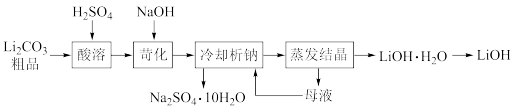
(6)“苛化法”获得 的流程如图.
的流程如图.
下列有关苛化法和双极膜法说法正确的是____________(填标号).
 、
、 等)中
等)中 金属资源.
金属资源.
已知:i.
 难溶于水可溶于酸,
难溶于水可溶于酸, 、
、 微溶于水.
微溶于水.ii.25℃时,
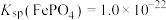 ,
, 的
的 ,
, ,
, .
.(1)“放电拆解”过程中
 从
从(2)“酸浸”过程生成
 的化学方程式为
的化学方程式为(3)“浸出液”检测出微量
 ,此时
,此时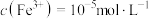 ,则溶液中
,则溶液中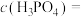
(4)
 溶解度随温度升高而降低.“沉锂”后为提高
溶解度随温度升高而降低.“沉锂”后为提高 的析出量和纯度应进行的操作为
的析出量和纯度应进行的操作为(5)“双极膜法”获得
 的原理如图.
的原理如图.
①
 从
从②该法总反应化学方程式为
③该法产生可在流程中循环使用的物质为
(6)“苛化法”获得
 的流程如图.
的流程如图.
下列有关苛化法和双极膜法说法正确的是____________(填标号).
| A.相较于苛化法,双极膜法工艺更简单 | B.相较于苛化法,双极膜法副产物之一为清洁能源 |
| C.相较于双极膜法,苛化法的产物纯度更高 | D.相较于双极膜法,苛化法耗酸量更少 |
您最近一年使用:0次
7 . 利用某钒废渣(主要成分为 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;
Ⅱ. 。
。
回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有____________________ (写出一条即可),该过程发生反应的离子方程式为______________________________ 。
(2)滤渣2的主要成分为____________________ 。
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有____________________ 。
(4)“氧化2”中发生反应的离子方程式为______________________________ 。
(5)“沉钒”前若滤液中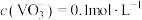 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中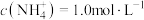 ,则钒元素的沉降率=
,则钒元素的沉降率=__________ %[ ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。
(6)在Ar气氛中“煅烧” 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式______________________________ 。
 、
、 、
、 、
、 、
、 等)制备
等)制备 的工艺流程如下:
的工艺流程如下: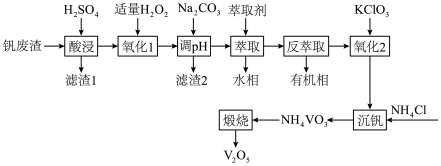
 溶于酸后以
溶于酸后以 的形式存在;过量
的形式存在;过量 可氧化
可氧化 ;
;Ⅱ.
 。
。回答下列问题:
(1)为加快“氧化1”速率,可以采取的措施有
(2)滤渣2的主要成分为
(3)实验室进行萃取、分液操作时,需要的玻璃仪器有
(4)“氧化2”中发生反应的离子方程式为
(5)“沉钒”前若滤液中
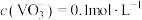 ,“沉钒”完成时,若上层清液中
,“沉钒”完成时,若上层清液中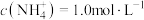 ,则钒元素的沉降率=
,则钒元素的沉降率= ,反应过程中溶液的体积不变]。
,反应过程中溶液的体积不变]。(6)在Ar气氛中“煅烧”
 生成
生成 ,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
,分解产物中还含有氮气和一种氮的氢化物,发生反应的化学方程式
您最近一年使用:0次
2024-02-01更新
|
111次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题
2024·河南·模拟预测
解题方法
8 . 一种回收锌电解阳极泥(主要成分为 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物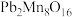 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
(1)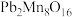 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为___________ 。
(2)“还原酸浸”过程中主要反应的化学方程式为___________ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是___________ 、___________ ,用___________ (填物质的名称)洗涤、干燥。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为___________ 。
(5)通过计算说明可用 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因___________ 。[已知:25℃时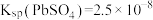 ,
,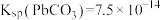 ]
]
(6)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物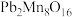 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: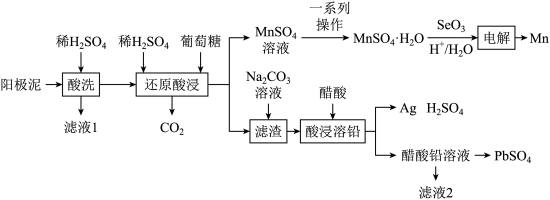
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。(1)
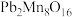 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是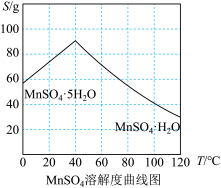
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)通过计算说明可用
 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因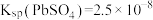 ,
,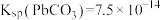 ]
](6)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。
 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
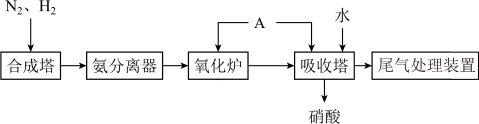
9 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
(1) 和
和 必须经过净化才能进入合成塔,最主要的原因是
必须经过净化才能进入合成塔,最主要的原因是______________ 。
(2)简述氨分离器中,将氨从平衡混合物中分离出去的方法:______________ 。
(3)氧化炉中主要反应的化学方程式为______________ 。
(4)向吸收塔中通入 的作用是
的作用是______________ 。
(5)工业上常用碱液来进行尾气处理,有关的化学反应为
①
②
现有一定条件下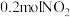 和
和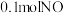 的混合气体恰好被
的混合气体恰好被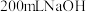 溶液完全吸收,则
溶液完全吸收,则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  。
。
(6)实验室中硝酸一般盛放在棕色试剂瓶中,用化学方程式说明其原因:______________ 。
(7)利用下图所示装置进行铜与稀硝酸反应的实验可以观察到的实验现象为______________ 。
(1)
 和
和 必须经过净化才能进入合成塔,最主要的原因是
必须经过净化才能进入合成塔,最主要的原因是(2)简述氨分离器中,将氨从平衡混合物中分离出去的方法:
(3)氧化炉中主要反应的化学方程式为
(4)向吸收塔中通入
 的作用是
的作用是(5)工业上常用碱液来进行尾气处理,有关的化学反应为
①

②

现有一定条件下
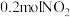 和
和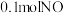 的混合气体恰好被
的混合气体恰好被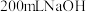 溶液完全吸收,则
溶液完全吸收,则 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(6)实验室中硝酸一般盛放在棕色试剂瓶中,用化学方程式说明其原因:
(7)利用下图所示装置进行铜与稀硝酸反应的实验可以观察到的实验现象为
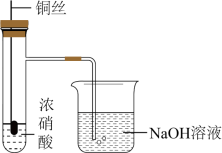
您最近一年使用:0次
名校
解题方法
10 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从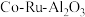 催化剂废料中分离制各
催化剂废料中分离制各 和
和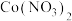 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为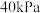 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于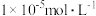 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,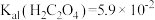 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是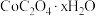 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从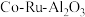 催化剂废料中分离制各
催化剂废料中分离制各 和
和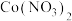 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
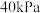 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于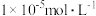 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,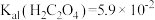 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
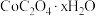 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1191次组卷
|
5卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)



