名校
解题方法
1 . 硫酸是工农业生产的重要化工原料。以黄铁矿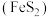 为原料生产硫酸的工艺流程如下图所示。
为原料生产硫酸的工艺流程如下图所示。___________ 。
(2)黄铁矿燃烧主要经过以下两个过程:
I.分解: ;
;
Ⅱ.燃烧: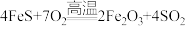 、
、___________ 。
(3)实验发现,在二氧化硫与氧气的反应中,无论怎样改变条件都不能使二氧化硫全部转化为三氧化硫,原因是___________ 。
(4)空气中二氧化硫的简易测定方法如下图所示。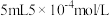 碘溶液,注入测定装置的试管中,加入
碘溶液,注入测定装置的试管中,加入 滴淀粉溶液,此时溶液呈
滴淀粉溶液,此时溶液呈___________ 色。
②连接仪器,在测定地点慢慢抽气,每次抽气 ,直到溶液的颜色全部褪尽为止,共抽气n次。空气中二氧化硫的含量为
,直到溶液的颜色全部褪尽为止,共抽气n次。空气中二氧化硫的含量为___________ 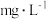 。
。
③若空气中二氧化硫的允许含量以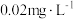 为标准,则抽气次数
为标准,则抽气次数
___________ 次才符合标准,否则超标。
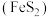 为原料生产硫酸的工艺流程如下图所示。
为原料生产硫酸的工艺流程如下图所示。
(2)黄铁矿燃烧主要经过以下两个过程:
I.分解:
 ;
;Ⅱ.燃烧:
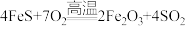 、
、(3)实验发现,在二氧化硫与氧气的反应中,无论怎样改变条件都不能使二氧化硫全部转化为三氧化硫,原因是
(4)空气中二氧化硫的简易测定方法如下图所示。
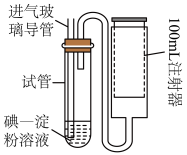
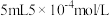 碘溶液,注入测定装置的试管中,加入
碘溶液,注入测定装置的试管中,加入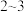 滴淀粉溶液,此时溶液呈
滴淀粉溶液,此时溶液呈②连接仪器,在测定地点慢慢抽气,每次抽气
 ,直到溶液的颜色全部褪尽为止,共抽气n次。空气中二氧化硫的含量为
,直到溶液的颜色全部褪尽为止,共抽气n次。空气中二氧化硫的含量为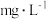 。
。③若空气中二氧化硫的允许含量以
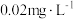 为标准,则抽气次数
为标准,则抽气次数
您最近一年使用:0次
名校
解题方法
2 . 用磷铁渣(含Fe、FeP、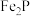 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:___________ 。
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是___________ 。
(3)废气中含有 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有___________ (写出两项),加入活性炭的目的是吸附氮氧化物;若用NaOH溶液吸收,物质的量比为 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为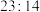 ,其化学式是
,其化学式是___________ 。
(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有___________ mol。
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、___________ 。
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为___________ 。
(7)最终产品应洗涤,检验是否洗净的试剂是___________ 。
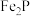 及少量杂质)制备磷酸铁晶体(
及少量杂质)制备磷酸铁晶体( )的工艺流程如下:
)的工艺流程如下:
(2)“浸取”时,硝酸浓度过高会较多分解,化学方程式是
(3)废气中含有
 、NO,直接排放产生的危害主要有
、NO,直接排放产生的危害主要有 的
的 、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为
、NO被完全吸收转化生成的是一种盐,盐中Na、N质量比为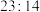 ,其化学式是
,其化学式是(4)若HNO₃的还原产物为NO,与1molFe2P完全反应而生成的NO有
(5)实验室完成操作X中用到的玻璃仪器有:烧杯、
(6)“调pH”时,碱性过高产物中含铁量会增大,其原因有可能为
(7)最终产品应洗涤,检验是否洗净的试剂是
您最近一年使用:0次
名校
解题方法
3 . 海水是巨大的资源宝库。
Ⅰ海带中含有碘元素,从海带中提取碘的实验过程如下图所示___________ 。
(2)步骤④中的氧化剂可使用 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
(3)步骤⑤中可用苯做萃取剂,理由有___________ (填序号)
a.苯与水不能互溶
b.碘单质在苯中的溶解度远大于在水中的溶解度
c.苯是无色液体
Ⅱ通过传统的海带提碘工艺后,所得卤水中的碘元素可通过以下流程回收利用: 溶液只能将I-氧化为
溶液只能将I-氧化为 ,同时生成NO
,同时生成NO
ⅱ将湿润的淀粉KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(4)写出氧化含 的卤水中发生的离子方程式:
的卤水中发生的离子方程式:___________ 。
(5)分离操作X的装置如图所示,电加热器的作用是,得到 的位置位于该装置中
的位置位于该装置中___________ 处(填图中选项)。 的氧化性强于
的氧化性强于 ,但该方法中却选择了价格较高的
,但该方法中却选择了价格较高的 ,原因是
,原因是______ 。
Ⅲ碘水可以用来测定溶液中的 浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
已知:
(7)已知标准 溶液的浓度和消耗的体积分别为c和V,计算待测液中
溶液的浓度和消耗的体积分别为c和V,计算待测液中 浓度还需要的实验数据有
浓度还需要的实验数据有___________ 。
Ⅰ海带中含有碘元素,从海带中提取碘的实验过程如下图所示

(2)步骤④中的氧化剂可使用
 ,发生反应的离子方程式为
,发生反应的离子方程式为(3)步骤⑤中可用苯做萃取剂,理由有
a.苯与水不能互溶
b.碘单质在苯中的溶解度远大于在水中的溶解度
c.苯是无色液体
Ⅱ通过传统的海带提碘工艺后,所得卤水中的碘元素可通过以下流程回收利用:

 溶液只能将I-氧化为
溶液只能将I-氧化为 ,同时生成NO
,同时生成NOⅱ将湿润的淀粉KI试纸伸入盛满氯气的集气瓶中,试纸先变蓝,后褪色
(4)写出氧化含
 的卤水中发生的离子方程式:
的卤水中发生的离子方程式:(5)分离操作X的装置如图所示,电加热器的作用是,得到
 的位置位于该装置中
的位置位于该装置中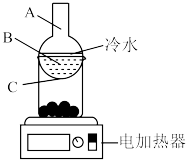
 的氧化性强于
的氧化性强于 ,但该方法中却选择了价格较高的
,但该方法中却选择了价格较高的 ,原因是
,原因是Ⅲ碘水可以用来测定溶液中的
 浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。
浓度;取待测液20mL,盐酸酸化后加入过量碘水,溶液中出现淡黄色浑浊。再加入2滴淀粉,之后逐滴加入标准溶液至蓝色褪去。已知:

(7)已知标准
 溶液的浓度和消耗的体积分别为c和V,计算待测液中
溶液的浓度和消耗的体积分别为c和V,计算待测液中 浓度还需要的实验数据有
浓度还需要的实验数据有
您最近一年使用:0次
名校
解题方法
4 . 以辉铜矿(主要含Cu2S、Fe2O3、SiO2)和软锰矿(主要含MnO2、SiO2)为原料联合提取铜和锰的一种流程示意图如下。
ii.25℃,金属离子的起始浓度为 时生成氢氧化物沉淀的pH
时生成氢氧化物沉淀的pH
iii.HR萃取 时发生的反应为
时发生的反应为
(1)“酸浸”过程是利用硫酸没出矿石中的铜、锰元素。
①“酸浸”过程中,为提高矿石的没出率,可采取的措施有___________ (填字母序号)
A.适当提高浸出温度 B.适当延长反应时间 C.增大矿石的粒径
②若浸出渣中含有单质S,补全“酸浸”过程中 与
与 反应的离子方程式:
反应的离子方程式:___________ 。
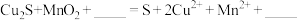
(2)若“酸浸”后溶液中 的浓度为
的浓度为 ,则“除铁”后溶液pH的范围为
,则“除铁”后溶液pH的范围为___________ 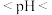
___________ 。
(3)“萃取”过程是利用萃取剂HR与 的选择性配位反应生成易溶于有机相的
的选择性配位反应生成易溶于有机相的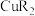 ,从而实现铜、锰元素的分离。
,从而实现铜、锰元素的分离。___________ 。
(4)“碳化沉锰”过程中发生反应的离子方程式为___________ 。
(5)结合“酸浸”过程,从两种矿石中各物质性质的角度,分析联合提取铜和锰的优势:_____ 。
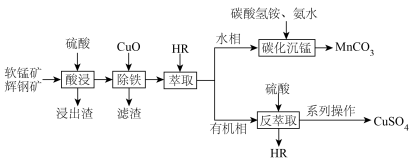
ii.25℃,金属离子的起始浓度为
 时生成氢氧化物沉淀的pH
时生成氢氧化物沉淀的pH |  |  | |
| 开始沉淀时 | 1.8 | 5.2 | 8.6 |
| 完全沉淀时 | 2.8 | 6.7 | 10.1 |
 时发生的反应为
时发生的反应为
(1)“酸浸”过程是利用硫酸没出矿石中的铜、锰元素。
①“酸浸”过程中,为提高矿石的没出率,可采取的措施有
A.适当提高浸出温度 B.适当延长反应时间 C.增大矿石的粒径
②若浸出渣中含有单质S,补全“酸浸”过程中
 与
与 反应的离子方程式:
反应的离子方程式: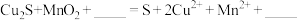
(2)若“酸浸”后溶液中
 的浓度为
的浓度为 ,则“除铁”后溶液pH的范围为
,则“除铁”后溶液pH的范围为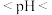
(3)“萃取”过程是利用萃取剂HR与
 的选择性配位反应生成易溶于有机相的
的选择性配位反应生成易溶于有机相的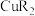 ,从而实现铜、锰元素的分离。
,从而实现铜、锰元素的分离。①某种HR的结构简式为 ,判断该分子中可能与
,判断该分子中可能与 形成配位键的原子并说明理由:
形成配位键的原子并说明理由:
(4)“碳化沉锰”过程中发生反应的离子方程式为
(5)结合“酸浸”过程,从两种矿石中各物质性质的角度,分析联合提取铜和锰的优势:
您最近一年使用:0次
名校
解题方法
5 .  为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以
为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以 废料(含少量
废料(含少量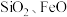 等)为原料制备
等)为原料制备 ,流程如下图所示:
,流程如下图所示:_________ (任填一种)。
(2)“废渣”的主要成分为_________ (填化学式)。
(3)“酸浸”不宜将稀 换成稀
换成稀 的原因是:
的原因是:_______________ 。
(4)为验证“酸浸”后溶液中存在 ,可加入一种试剂是
,可加入一种试剂是_________ (写名称)。“试剂X”是铁粉,其作用是______________ 。
(5)向滤液2中加入乙醇即可析出 晶体,乙醇的作用是
晶体,乙醇的作用是_________ 。
(6)由 转化为
转化为 的离子方程式是:
的离子方程式是:______________ 。
(7)取 废料参与反应,若反应过程中铁元素损失
废料参与反应,若反应过程中铁元素损失 ,最后制得
,最后制得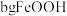 固体,试计算废料中铁元素的质量分数为
固体,试计算废料中铁元素的质量分数为_________ (列计算式)。
 为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以
为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以 废料(含少量
废料(含少量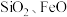 等)为原料制备
等)为原料制备 ,流程如下图所示:
,流程如下图所示: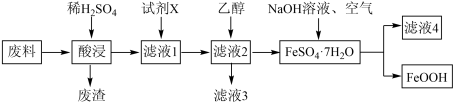
(2)“废渣”的主要成分为
(3)“酸浸”不宜将稀
 换成稀
换成稀 的原因是:
的原因是:(4)为验证“酸浸”后溶液中存在
 ,可加入一种试剂是
,可加入一种试剂是(5)向滤液2中加入乙醇即可析出
 晶体,乙醇的作用是
晶体,乙醇的作用是(6)由
 转化为
转化为 的离子方程式是:
的离子方程式是:(7)取
 废料参与反应,若反应过程中铁元素损失
废料参与反应,若反应过程中铁元素损失 ,最后制得
,最后制得 固体,试计算废料中铁元素的质量分数为
固体,试计算废料中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 下面是以硫黄为原料制备硫酸的工业流程。已知SO₃的熔点是:16.8℃,沸点是44.8℃。___________ 。
(2)每轮反应后都要进行热交换降温的目的是___________ 。
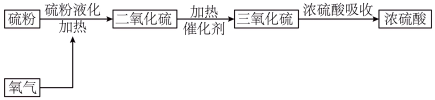
(2)每轮反应后都要进行热交换降温的目的是
您最近一年使用:0次
名校
解题方法
7 . 电镀在工业生产中具有重要作用,某电镀厂生产的废水经预处理后含有 和少量的
和少量的 、
、 ,能够采用如图流程进行逐一分离,实现资源再利用。
,能够采用如图流程进行逐一分离,实现资源再利用。 ,
,
回答下列问题:
(1) 在酸性条件下和
在酸性条件下和 反应可生成蓝色的
反应可生成蓝色的 ,该反应可用于检验
,该反应可用于检验 。该反应的方程式如下:
。该反应的方程式如下: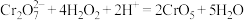 ,反应中没有元素化合价发生变化。则1 mol
,反应中没有元素化合价发生变化。则1 mol  中含有
中含有______ 条过氧键。
(2)还原池中有 生成,还原池中反应的离子方程式为
生成,还原池中反应的离子方程式为____________ 。
(3)沉淀1为 ,其性质与
,其性质与 相似,则
相似,则 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式____________ 。
(4)①将 溶液中离子浓度按照从大到小排列:
溶液中离子浓度按照从大到小排列:____________ ;
②沉淀池2加入硫酸溶液,调 时,此时溶液中
时,此时溶液中 的浓度为
的浓度为______ ,由此可知。沉淀池2中加入 生成的沉淀主要是
生成的沉淀主要是______ 。(设 平衡浓度为
平衡浓度为 mol⋅L
mol⋅L 。已知:
。已知: 的
的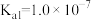 ,
,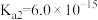 )。
)。
(5)沉淀池3如果没有加NaOH调 ,会导致
,会导致__________________ 。
 和少量的
和少量的 、
、 ,能够采用如图流程进行逐一分离,实现资源再利用。
,能够采用如图流程进行逐一分离,实现资源再利用。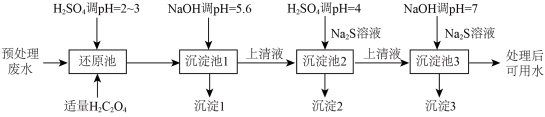
 ,
,
回答下列问题:
(1)
 在酸性条件下和
在酸性条件下和 反应可生成蓝色的
反应可生成蓝色的 ,该反应可用于检验
,该反应可用于检验 。该反应的方程式如下:
。该反应的方程式如下: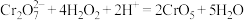 ,反应中没有元素化合价发生变化。则1 mol
,反应中没有元素化合价发生变化。则1 mol  中含有
中含有(2)还原池中有
 生成,还原池中反应的离子方程式为
生成,还原池中反应的离子方程式为(3)沉淀1为
 ,其性质与
,其性质与 相似,则
相似,则 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式(4)①将
 溶液中离子浓度按照从大到小排列:
溶液中离子浓度按照从大到小排列:②沉淀池2加入硫酸溶液,调
 时,此时溶液中
时,此时溶液中 的浓度为
的浓度为 生成的沉淀主要是
生成的沉淀主要是 平衡浓度为
平衡浓度为 mol⋅L
mol⋅L 。已知:
。已知: 的
的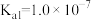 ,
,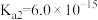 )。
)。(5)沉淀池3如果没有加NaOH调
 ,会导致
,会导致
您最近一年使用:0次
7日内更新
|
35次组卷
|
2卷引用:安徽省江南十校2023-2024学年高二下学期5月阶段联考化学B试题
解题方法
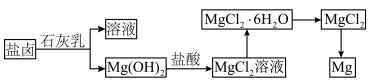
8 . 海洋中蕴藏着多种金属元素的资源,例如,海水中镁的含量仅次于氯和钠,位居第三,总储量约为1.8×1016t。镁用途广泛,用海水提取金属镁,成本较低,其流程如下图所示:
1.获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是_____ 。
2.已知:Ca(OH)2微溶于水,Mg(OH)2难溶于水。为除去Mg(OH)2沉淀中混有少量Ca(OH)2,先将沉淀加到_____ 溶液浸洗,再经过滤、洗涤可得较纯净的Mg(OH)2.
3.上述流程中用过量盐酸溶解氢氧化镁的原因是:_____ 。
4.已知Mg(OH)2的Ksp=5.6×10-12(25℃),则溶液中镁离子沉淀完全时pH=_____ 。
5.从MgCl2溶液获得MgCl2·6H2O操作步骤包括:_____ 。
6.如要得到无水氯化镁需在干燥的HCl气流中加热MgCl2·6H2O,HCl作用是_____ 。
7.写出MgC12制Mg的化学方程式_____ 。
8.不用MgO制Mg是因为_____ 。
1.获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
2.已知:Ca(OH)2微溶于水,Mg(OH)2难溶于水。为除去Mg(OH)2沉淀中混有少量Ca(OH)2,先将沉淀加到
3.上述流程中用过量盐酸溶解氢氧化镁的原因是:
4.已知Mg(OH)2的Ksp=5.6×10-12(25℃),则溶液中镁离子沉淀完全时pH=
5.从MgCl2溶液获得MgCl2·6H2O操作步骤包括:
6.如要得到无水氯化镁需在干燥的HCl气流中加热MgCl2·6H2O,HCl作用是
7.写出MgC12制Mg的化学方程式
8.不用MgO制Mg是因为
您最近一年使用:0次
解题方法
9 . 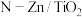 光催化氧化处理含硫废液的机理如图所示,
光催化氧化处理含硫废液的机理如图所示, 和
和 分别与
分别与 反应生成
反应生成 和
和 。下列说法错误的是
。下列说法错误的是
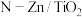 光催化氧化处理含硫废液的机理如图所示,
光催化氧化处理含硫废液的机理如图所示, 和
和 分别与
分别与 反应生成
反应生成 和
和 。下列说法错误的是
。下列说法错误的是
A.④的反应为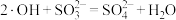 |
B. 过低或过高均会影响催化剂的催化效果 过低或过高均会影响催化剂的催化效果 |
C.①②过程和③④过程产生的 之比为 之比为 |
D.氧化含硫废液的总反应为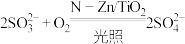 |
您最近一年使用:0次
名校
解题方法
10 . 工业利用软锰矿进行烟气脱硫并制备MnSO4和Mg(OH)2的工艺流程如图所示。软锰矿的主要成分是MnO2,还含有FeO、Fe2O3、Al2O3、MgO、ZnO、NiO、SiO2等物质。
(1)反应前,需先将软锰矿石粉碎制成软锰矿浆,其目的是___________ 。
(2)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为___________ 。
(3)向浸出液中添加适量MnO2的作用是___________ ;调节pH时应不低于___________ 。
(4)已知滤渣1的主要成分为SiO2,则除杂时,滤渣2的主要成分为___________ 。
(5)“沉锰”的离子方程式为___________ 。
(6)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示。___________ 。
②45℃以上时,随温度升高,Mn2+和Mg2+沉淀率变化的原因是:___________ 。
(7)为测定所得MnSO4的纯度,称取上述样品ag加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配制为100mL溶液。取20.00mL该溶液,用cmol/L的FeSO4溶液进行滴定,发生反应:Fe2++Mn3+=Fe3++Mn2+,达到滴定终点时消耗FeSO4溶液VmL则MnSO4纯度=___________ 。[已知:M(MnSO4)=151g/mol]。

 |  |  |  |  |  |  | |
| 开始沉淀 | 8.8 | 7.5 | 2.2 | 4.1 | 9.6 | 6.5 | 6.4 |
| 完全沉淀 | 10.8 | 9.5 | 3.5 | 5.4 | 11.6 | 8.5 | 8.4 |
(1)反应前,需先将软锰矿石粉碎制成软锰矿浆,其目的是
(2)“脱硫浸锰”中软锰矿浆吸收SO2的化学方程式为
(3)向浸出液中添加适量MnO2的作用是
(4)已知滤渣1的主要成分为SiO2,则除杂时,滤渣2的主要成分为
(5)“沉锰”的离子方程式为
(6)“沉锰”过程中pH和温度对Mn2+和Mg2+沉淀率的影响如图所示。

②45℃以上时,随温度升高,Mn2+和Mg2+沉淀率变化的原因是:
(7)为测定所得MnSO4的纯度,称取上述样品ag加入适量H2SO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+后,配制为100mL溶液。取20.00mL该溶液,用cmol/L的FeSO4溶液进行滴定,发生反应:Fe2++Mn3+=Fe3++Mn2+,达到滴定终点时消耗FeSO4溶液VmL则MnSO4纯度=
您最近一年使用:0次



