名校
解题方法
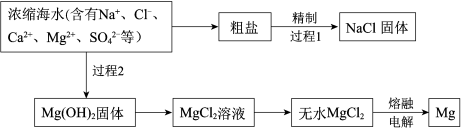
1 . 浩瀚的海洋中蕴藏着丰富的资源。
过程1除去粗盐中的Ca2+、Mg2+、SO 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
①加入沉淀剂的顺序正确的是___________ (填序号)。
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++CO =H2O+CO2↑和
=H2O+CO2↑和___________ 。
(2)海水提镁。
过程2中加入的试剂是___________ 。由无水MgCl2获得Mg的化学方程式是___________ 。
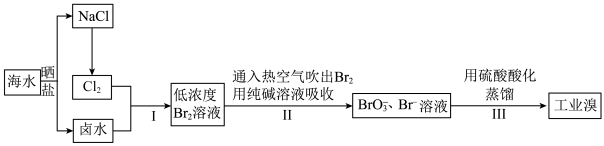
(3)海水提溴。
主要工业生产流程如下图所示:___________ 。
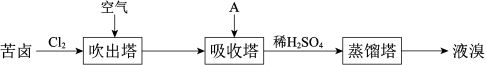
②吸收塔中,A吸收了Br2后的溶液中含有Br‒和BrO ,则A是
,则A是___________ (填序号)。
a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
③从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___________ 。
过程1除去粗盐中的Ca2+、Mg2+、SO
 杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。
杂质时,粗盐溶解后加入沉淀剂:a.过量的Na2CO3溶液b.过量的BaCl2溶液c.过量的NaOH溶液过滤除去沉淀,再加入适量的盐酸。①加入沉淀剂的顺序正确的是
A.abc B.bac C.cba
②加入适量盐酸,反应的离子方程式有2H++CO
 =H2O+CO2↑和
=H2O+CO2↑和(2)海水提镁。
过程2中加入的试剂是
(3)海水提溴。
主要工业生产流程如下图所示:
②吸收塔中,A吸收了Br2后的溶液中含有Br‒和BrO
 ,则A是
,则A是a.NaCl溶液 b.Na2CO3溶液 c.SO2气体
③从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是
您最近半年使用:0次
名校
2 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

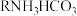 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近半年使用:0次
名校
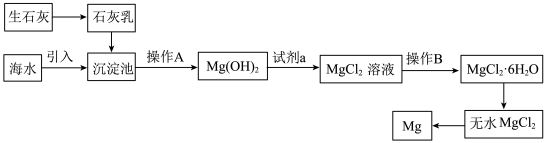
3 . 海洋资源丰富,从海水中获取镁和溴的流程示意图如下:

| A.从经济效益角度考虑,工业上使用的试剂X是氢氧化钠 |
B.可用 代替 代替 吸收含溴的空气 吸收含溴的空气 |
C.直接将 溶液加热蒸干得无水 溶液加热蒸干得无水 |
| D.虚线框内流程的主要目的是减少环境污染 |
您最近半年使用:0次
7日内更新
|
206次组卷
|
3卷引用:2024届内蒙古自治区赤峰市高三一模化学试题
2024届内蒙古自治区赤峰市高三一模化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
4 . 海洋是资源的宝库,以海水为原料可以制取粗盐、Br2、镁等多种物质。
I.粗盐中主要含NaCl,还含有少量泥沙、CaCl2、MgCl2和Na2SO4。
(1)将粗盐提纯的方法是:将粗盐溶于水,向里面依次加入稍过量的_______ (填字母),过滤,将滤液用盐酸酸化后,蒸发结晶。
A.Na2CO3 B.NaOH C.BaCl2
(2)实验中,判断所加BaCl2溶液已经过量的方法是_______ 。
II.浓缩海水中含有NaCl、NaBr等物质。从浓缩海水中提取溴的流程如下:_______ 。
(4)“吸收”时是用SO2水溶液吸收空气吹出的溴蒸汽。写出“吸收”时发生反应的化学方程式,并用双线桥标出电子转移的方向和数目:_______ 。
III.从海水中提取镁流程如下:
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)操作②是_______ 、过滤。
(6)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质,而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制取金属镁,其原因是_______ 。
I.粗盐中主要含NaCl,还含有少量泥沙、CaCl2、MgCl2和Na2SO4。
(1)将粗盐提纯的方法是:将粗盐溶于水,向里面依次加入稍过量的
A.Na2CO3 B.NaOH C.BaCl2
(2)实验中,判断所加BaCl2溶液已经过量的方法是
II.浓缩海水中含有NaCl、NaBr等物质。从浓缩海水中提取溴的流程如下:

(4)“吸收”时是用SO2水溶液吸收空气吹出的溴蒸汽。写出“吸收”时发生反应的化学方程式,并用双线桥标出电子转移的方向和数目:
III.从海水中提取镁流程如下:
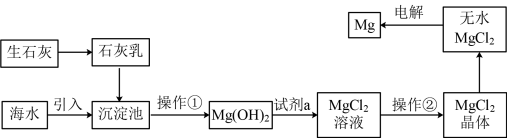
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
(5)操作②是
(6)工业上是将氢氧化镁转变为氯化镁,再电解氯化镁来制取镁单质,而不采用加热Mg(OH)2得到MgO,再电解熔融MgO的方法制取金属镁,其原因是
您最近半年使用:0次
名校
5 . 海水资源非常丰富。某化学实验小组同学为了从海带中提取碘和海水提溴,进行以下实验:
Ⅰ.从海带中提取碘单质,实验流程图如下:
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入___________ 中灼烧至海带完全成灰烬。
(2)步骤④中使用稀硫酸和 溶液能更有利于提取碘,写出离子方程式
溶液能更有利于提取碘,写出离子方程式___________ 。
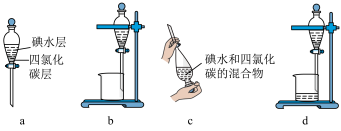
(3)步骤⑤中用分液漏斗得到碘的四氮化碳溶液,其操作顺序是___________ (填字母)。___________ 。
Ⅱ.海水中主要离子的含量如下:
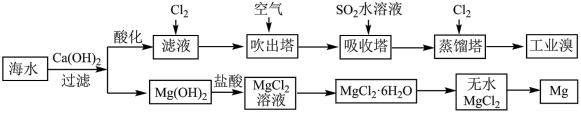
(5)利用海水可以提取溴和镁,提取过程如下: 溶液中得到
溶液中得到 晶体的主要实验操作是
晶体的主要实验操作是___________ 、洗涤、烘干。从 晶体中得到无水
晶体中得到无水 的主要方法是
的主要方法是___________ 。
②用 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为___________ 。
③依据上述流程,若将5 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为___________ L(忽略 溶解)。
溶解)。
Ⅰ.从海带中提取碘单质,实验流程图如下:
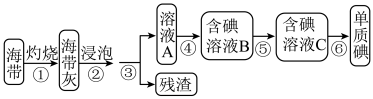
(1)在进行步骤①之前,称取m g干海带,甲同学提出将海带先剪碎,然后用水浸泡、洗净、晾干放入
(2)步骤④中使用稀硫酸和
 溶液能更有利于提取碘,写出离子方程式
溶液能更有利于提取碘,写出离子方程式(3)步骤⑤中用分液漏斗得到碘的四氮化碳溶液,其操作顺序是
Ⅱ.海水中主要离子的含量如下:
| 成分 |  |  |  |  |  |  |  |
含量/( ) ) | 18980 | 10560 | 2560 | 1272 | 400 | 142 | 64 |
(5)利用海水可以提取溴和镁,提取过程如下:
 溶液中得到
溶液中得到 晶体的主要实验操作是
晶体的主要实验操作是 晶体中得到无水
晶体中得到无水 的主要方法是
的主要方法是②用
 水溶液吸收
水溶液吸收 ,吸收率可达95%,有关反应的离子方程式为
,吸收率可达95%,有关反应的离子方程式为③依据上述流程,若将5
 海水中的溴元素转化为工业溴,至少需要标准状况下
海水中的溴元素转化为工业溴,至少需要标准状况下 的体积为
的体积为 溶解)。
溶解)。
您最近半年使用:0次
名校
6 . 化学与生产、生活、科技密切相关,下列说法正确的是
| A.从海水中提取液溴和镁的生产过程都涉及氧化还原反应 |
| B.目前我国加碘食盐中主要添加的是碘化钾 |
| C.“酒曲”的酿酒工艺,是利用了催化剂使平衡正向移动的原理 |
| D.医用外科口罩使用的聚丙烯材料,能使酸性高锰酸钾溶液褪色 |
您最近半年使用:0次
7 . 化学与人类生活、生产有着密切联系。下列有关叙述错误的是
| A.海水提镁、炼铁、制造玻璃等工业都用到石灰石 |
| B.制造大型抛物面天线的铝合金和玻璃钢均为金属材料 |
| C.“落红不是无情物,化作春泥更护花”体现了自然界中的碳、氮循环 |
| D.增味剂味精主要以小麦面筋等蛋白质为原料通过发酵法生产 |
您最近半年使用:0次
解题方法
8 . 下列有关海水综合利用涉及的离子方程式不正确的是
A.利用石灰乳沉镁: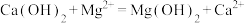 |
B.利用NaOH溶液反萃取 中的 中的 : :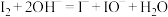 |
C.利用 吸收 吸收 二次富集溴: 二次富集溴: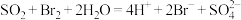 |
D.电解饱和食盐水: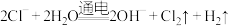 |
您最近半年使用:0次
解题方法
9 . 下列有关金属冶炼的方法不 正确的是
| A.制镁:将海水富集得到的氯化镁溶液电解得到镁和氯气 |
B.制铁:用焦炭和空气反应产生的 在高温下还原铁矿石中的铁的氧化物 在高温下还原铁矿石中的铁的氧化物 |
| C.制汞:加热氧化汞得到汞,同时生成氧气 |
D.制锰:将铝粉与难熔的 以一定比例混合后,高温冶炼得到锰 以一定比例混合后,高温冶炼得到锰 |
您最近半年使用:0次
解题方法
10 . MgCl2是制备金属Mg的原料。某研究小组用侯氏制碱法获得的NH4Cl制备MgCl2,同时实现NH3、CO2的循环利用的流程如图所示。
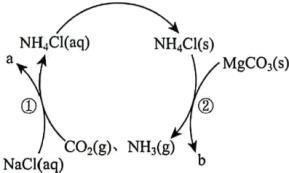
| A.a、b分别是Na2CO3、MgCl2 |
| B.将NH4Cl溶液直接蒸发结晶可以得到NH4Cl固体 |
C.理论上反应①消耗的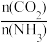 和反应②生成的 和反应②生成的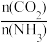 相等 相等 |
D.工业上由MgCl2制Mg的化学方程式:MgCl2(熔融) Mg+Cl2↑ Mg+Cl2↑ |
您最近半年使用:0次
2024-04-18更新
|
115次组卷
|
2卷引用:2024届贵州省高三下学期二模化学试题



