1 . 某工厂的工业废水中含有大量的 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:___________ 。
(2)实验室进行操作Ⅰ的名称为___________ 。
(3)检验溶液①中含有 的实验方法是
的实验方法是___________ 。
(4)试剂X是___________ (填名称),加入试剂 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)固体②是___________ (填化学式)。
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中, ,
,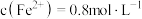 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则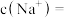
___________ 。
 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:
(2)实验室进行操作Ⅰ的名称为
(3)检验溶液①中含有
 的实验方法是
的实验方法是(4)试剂X是
 发生反应的离子方程式为
发生反应的离子方程式为(5)固体②是
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中,
 ,
,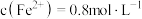 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则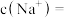
您最近半年使用:0次
名校
解题方法
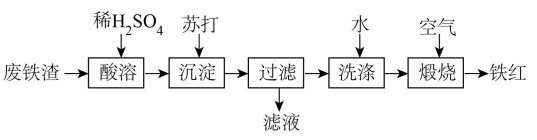
2 . 铁红可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含Fe和少量Fe2O3)制取铁红,所设计的流程如下:
(1)苏打中的化学键类型为___________ ;沉淀的化学式为___________ ;“滤液”中主要溶质的化学式为___________ 。
(2)要检测“酸溶”后,溶液中是否含有Fe3+所用的试剂是___________ (名称);若溶液中检测不到Fe3+的原因是___________ 。
(3)“酸溶”时,Fe2O3与稀硫酸反应的离子方程式为___________ 。
(4)实验室过滤所需的玻璃仪器(填名称)有___________ 。
(5)煅烧的化学方程式为___________ 。
(1)苏打中的化学键类型为
(2)要检测“酸溶”后,溶液中是否含有Fe3+所用的试剂是
(3)“酸溶”时,Fe2O3与稀硫酸反应的离子方程式为
(4)实验室过滤所需的玻璃仪器(填名称)有
(5)煅烧的化学方程式为
您最近半年使用:0次
名校
解题方法
3 . 硫铁矿(主要成分为FeS2)是工业制硫酸的主要原料。硫铁矿烧渣中含有Fe2O3、Fe3O4、Al2O3等成分,可用于制备硫酸和绿矾(FeSO4·7H2O),流程示意图如下。
(1)硫元素位于周期表中第___________ 周期,第___________ 族。
(2)硫铁矿煅烧时反应的化学方程式为___________ 。
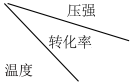
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
为提高SO2的转化率,该反应应选择的温度是___________ ℃,压强采用“常压”的主要原因为___________ 。
(4)“还原”和“除铝”能否交换顺序?___________ (填“能”或“否”),原因是___________
(5)“结晶”过程的步骤如下:___________ (填操作和现象)。
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++ +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为___________ 。
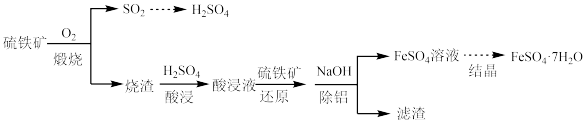
| Fe3+ | A13+ | Fe2+ | |
| 开始沉淀时的pH | |1.5 | 3.3 | 6.5 |
| 沉淀完全时的pH | 3.7 | 5.2 | 9.7 |
(1)硫元素位于周期表中第
(2)硫铁矿煅烧时反应的化学方程式为
(3)SO2的催化氧化是工业制硫酸的关键步骤,压强和温度对SO2转化率的影响如下表:
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(4)“还原”和“除铝”能否交换顺序?
(5)“结晶”过程的步骤如下:
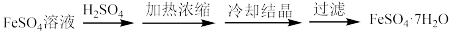
(6)称取w g制得的晶体样品,加入适量水和稀硫酸溶解,滴入c mol/L的K2Cr2O7溶液,发生反应:6Fe2++
 +14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
+14H+ =6Fe3++2Cr3++7H2O,恰好完全反应时,消耗K2Cr2O7溶液VmL。则制得晶体样品中Fe2+的质量分数为
您最近半年使用:0次
解题方法
4 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近半年使用:0次
解题方法
5 . 某磁铁矿石 的主要成分是磁性氧化铁
的主要成分是磁性氧化铁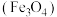 ,还含少量的
,还含少量的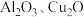 。某工厂利用此矿石进行有关物质的回收利用,其中
。某工厂利用此矿石进行有关物质的回收利用,其中 为常见的补铁剂,工艺流程如图(已知
为常见的补铁剂,工艺流程如图(已知 不溶于水和碱,但溶于强酸:
不溶于水和碱,但溶于强酸: )。根据流程回答下列问题:
)。根据流程回答下列问题: 的溶质主要是
的溶质主要是___________ ,铝离子的结构示意图为___________ 。
(2)溶液D与过量试剂 反应的离子方程式有
反应的离子方程式有___________ 。
(3)在溶液 中滴加
中滴加 溶液的现象是
溶液的现象是___________ 。
(4)㩰作1的名称为___________ 。
(5)写出检验溶液 中
中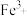 原理的离子方程式:
原理的离子方程式:___________ 。
 的主要成分是磁性氧化铁
的主要成分是磁性氧化铁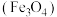 ,还含少量的
,还含少量的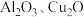 。某工厂利用此矿石进行有关物质的回收利用,其中
。某工厂利用此矿石进行有关物质的回收利用,其中 为常见的补铁剂,工艺流程如图(已知
为常见的补铁剂,工艺流程如图(已知 不溶于水和碱,但溶于强酸:
不溶于水和碱,但溶于强酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:
 的溶质主要是
的溶质主要是(2)溶液D与过量试剂
 反应的离子方程式有
反应的离子方程式有(3)在溶液
 中滴加
中滴加 溶液的现象是
溶液的现象是(4)㩰作1的名称为
(5)写出检验溶液
 中
中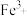 原理的离子方程式:
原理的离子方程式:
您最近半年使用:0次
名校
解题方法
6 . 聚合硫酸铝铁(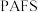 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为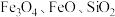 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为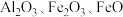 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下:___________ (填序号)。
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有___________ (填化学符号)。
(2)检验“氧化”后溶液中金属阳离子的方法是___________ 。
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是___________ 。
(4)“酸溶”过程中发生反应的离子方程式为___________ 。
(5)滤渣Ⅱ中可以循环利用的物质是___________ (填化学式)。
 )是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为
)是一种高效净水剂,广泛应用于饮用水处理、工业废水处理和污水处理。它能有效去除悬浊物、胶体颗粒、重金属、氨氨、有机物和色度等污染物,提高水质,保护环境。它的生产可以利用硫铁矿烧渣(主要成分为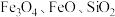 等)和粉煤灰(主要成分为
等)和粉煤灰(主要成分为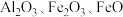 等),经过一系列的反应制得,具体流程如下:
等),经过一系列的反应制得,具体流程如下: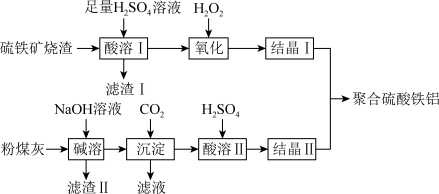
A.降低温度 B.烧渣粉碎 C.适当提高硫酸浓度 D.加水稀释
“酸溶”后得到的溶液中,主要存在的金属阳离子有
(2)检验“氧化”后溶液中金属阳离子的方法是
(3)实验测得“氧化”过程中温度过高氧化效率会下降,原因可能是
(4)“酸溶”过程中发生反应的离子方程式为
(5)滤渣Ⅱ中可以循环利用的物质是
您最近半年使用:0次
解题方法
7 . 利用废旧镀锌铁皮制备Fe3O4胶体粒子的流程如下:
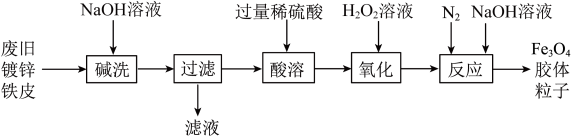
| A.Fe3O4俗称铁红 |
| B.“碱洗”的主要目的是除去镀锌铁皮表面的油污 |
| C.“酸溶”反应的离子方程式为Fe+2H+=Fe2++H2↑ |
D.“氧化”后溶液中所存在的离子为:H+、Fe3+、SO |
您最近半年使用:0次
名校
解题方法
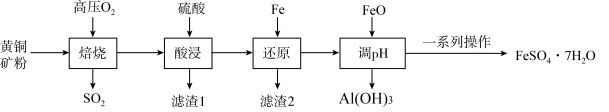
8 . 绿矾(FeSO4⋅7H2O))是一种重要的药物,也是一种工业原料。一种以黄铜矿(主要成分是CuFeS2,含SiO2、Al2O3等杂质)为原料制备绿矾的流程如图:
(1)“焙烧”时,需将黄铜矿粉碎,其目的是_______ ;高温“焙烧”过程中生成了三种氧化物,其化学方程式是_______ 。
(2)滤渣1的主要成分为_______ (填化学式,下同);滤渣2的主要成分为_______ 。
(3)“一系列操作”为:_______ 、_______ 、过滤、洗涤、干燥。
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为_______ 。
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中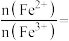
_______ 。
(1)“焙烧”时,需将黄铜矿粉碎,其目的是
(2)滤渣1的主要成分为
(3)“一系列操作”为:
(4)硫代硫酸钠(Na2S2O3)俗称“海波”或“大苏打”,也是一种重要的含硫盐。在酸性条件下不稳定,易生成一种固体和一种气体,其离子方程式为
(5)绿矾在空气中容易被部分氧化。现取被部分氧化的绿矾晶体溶于稀盐酸后,加入足量的BaCl2溶液,过滤得沉淀9.32g;再通入112mL(标准状况)氯气恰好将其中的Fe2+完全氧化。推测所取晶体中
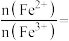
您最近半年使用:0次
名校
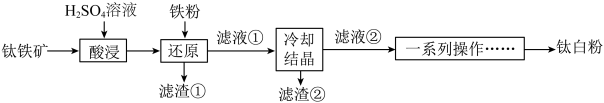
9 . 一种以钛铁矿(FeTiO3,含Fe2O3、CaO、SiO2等杂质)为主要原料制备钛白粉(TiO2)的工艺流程如图所示。 形式存在,
形式存在, 在80℃左右水解生成
在80℃左右水解生成 。
。
下列说法不正确的是
 形式存在,
形式存在, 在80℃左右水解生成
在80℃左右水解生成 。
。下列说法不正确的是
| A.“酸溶”时不宜用硝酸替换硫酸 |
B.滤渣①的主要成分为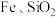 和 和 |
C.常温下溶解度: 小于 小于 |
| D.制备过程中硫酸可以循环使用 |
您最近半年使用:0次
名校
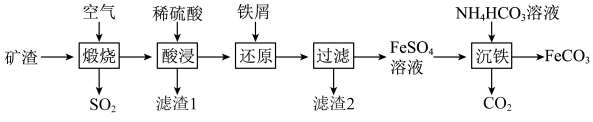
10 . 利用金属矿渣(含有FeS2、SiO2及Cu2O)制备FeCO3的实验流程如下。已知煅烧过程中FeS2和Cu2O转化为Fe2O3和CuO。___________ (写化学式),该物质是工业制备硅的原料,写出该物质与焦炭反应制备硅的化学方程式:___________ 。
(2)FeS2在空气中煅烧的化学方程式为___________ 。
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将 转化为
转化为 外,还能
外,还能___________ 。若将6g铁粉加入200mLFe2(SO4)3和CuSO4的混合溶液中,充分反应得到200mL FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。
①5.2g固体沉淀物的成份为___________ (写化学式)。
②原Fe2(SO4)3溶液的物质的量浓度是___________ 。(写出计算过程)
(4)检验 是否完全被还原的实验操作是
是否完全被还原的实验操作是___________ 。
(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:___________ 。
(2)FeS2在空气中煅烧的化学方程式为
(3)在“还原”步骤,在向酸浸后溶液加入过量铁屑,除了能将
 转化为
转化为 外,还能
外,还能 FeSO4溶液和5.2g固体沉淀物。
FeSO4溶液和5.2g固体沉淀物。①5.2g固体沉淀物的成份为
②原Fe2(SO4)3溶液的物质的量浓度是
(4)检验
 是否完全被还原的实验操作是
是否完全被还原的实验操作是(5)制备FeCO3,写出“沉铁”步骤发生反应的离子方程式:
您最近半年使用:0次