名校
解题方法
1 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:___________ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(2)加入H2O2的目的是___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了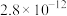 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为___________ 。证明Fe3+已除尽的化学方法是___________ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:___________ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
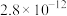 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近半年使用:0次
名校
解题方法
2 . 钼(Mo)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以NiS和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
(1) 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
(3) 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为_______ ,结合图1中信息说明理由:_______ 。 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为_______ (填标号)。
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为: ,放电时负极的电极反应式为
,放电时负极的电极反应式为_______ 。
 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下: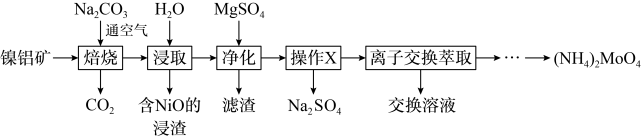
(1)
 元素的基态原子核外电子排布式为
元素的基态原子核外电子排布式为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 实验用量与理论用量的比值为1.0、1.1、1.2、1.3时,
实验用量与理论用量的比值为1.0、1.1、1.2、1.3时, 的浸出率和
的浸出率和 残留浓度的变化如图所示,则
残留浓度的变化如图所示,则 的最佳用量比为
的最佳用量比为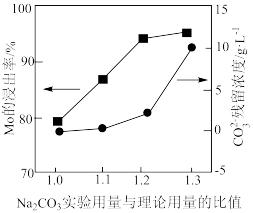
 、
、 的溶解度曲线如图所示,为充分分离
的溶解度曲线如图所示,为充分分离 ,工艺流程中的“操作X”应为
,工艺流程中的“操作X”应为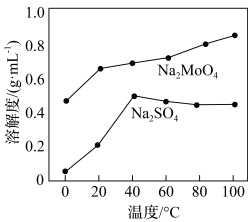
(5)锂化二硫化钼纳米片可用于高性能锂硫电池,其工作原理为:
 ,放电时负极的电极反应式为
,放电时负极的电极反应式为
您最近半年使用:0次
解题方法
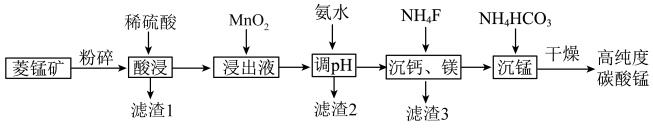
3 . 碳酸钛用作脱硫的催化剂,瓷釉、涂料和清漆的颜料,是合成二氧化锰和制造其他锰盐的原料。工业上制备高纯度碳酸锰的工艺流程如下:
②该工艺下,0.1mol/L的金属离子形成氢氧化物沉淀的pH如下:
③常温下,Ksp(CaF2)=1.60×10-10,Ksp(MgF2)=6.40×10-11.回答下列问题:
(1)基态Mn2+价电子的轨道表示式为___________ 。
(2)滤渣1的主要成份是:___________ ,其附着在矿粉颗粒表面会阻碍菱锰矿与酸的反应,若此时加入H2O2,利用其迅速分解产生的大量气泡可消除其不利影响,导致H2O2分解的因素是___________ 。
(3)在“浸出液”中加入“MnO2”所发生反应的离子方程式为___________ 。
(4)加入氨水调节溶液pH的范围___________ 。
(5)常温下,当溶液中Ca2+、Mg2+完全除去时,则c(F-)≥___________ mol/L。
(6)沉锰步骤发生主要反应的离子方程式为:___________ 。
(7)已知:5 +2Mn2++8H2O=16H++10
+2Mn2++8H2O=16H++10 +2
+2 ,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?___________ 。
②该工艺下,0.1mol/L的金属离子形成氢氧化物沉淀的pH如下:
| 金属离子Mn+ | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.9 | 3.4 | 7.0 | 8.1 | 9.1 |
| 沉淀完全的pH[c(Mn2+)≤1.0×10-5mol/L] | 3.2 | 4.7 | 9.0 | 10.1 | 11.1 |
(1)基态Mn2+价电子的轨道表示式为
(2)滤渣1的主要成份是:
(3)在“浸出液”中加入“MnO2”所发生反应的离子方程式为
(4)加入氨水调节溶液pH的范围
(5)常温下,当溶液中Ca2+、Mg2+完全除去时,则c(F-)≥
(6)沉锰步骤发生主要反应的离子方程式为:
(7)已知:5
 +2Mn2++8H2O=16H++10
+2Mn2++8H2O=16H++10 +2
+2 ,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
,实验室可利用Na2S2O8溶液来检验Mn2+是否反应完全。如何确定Mn2+已完全反应?
您最近半年使用:0次
4 . 从某工业废水中(含 、
、 、
、 、
、 、
、 )回收利用Al和
)回收利用Al和 的工艺流程如图所示。下列说法错误的是
的工艺流程如图所示。下列说法错误的是
 、
、 、
、 、
、 、
、 )回收利用Al和
)回收利用Al和 的工艺流程如图所示。下列说法错误的是
的工艺流程如图所示。下列说法错误的是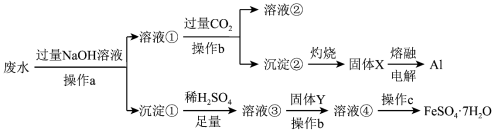
| A.操作a、b均是过滤,c蒸发浓缩、冷却结晶 |
B.溶液①中不止一种物质与 发生反应 发生反应 |
| C.溶液②的溶质主要是NaCl和Na2CO3 |
| D.固体Y可以是铁粉 |
您最近半年使用:0次
解题方法
5 . 金属钛( )广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为
)广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为 、
、 、
、 、
、 、
、 、
、 等)的综合利用具有重要的经济价值和社会效益。工艺流程如下:
等)的综合利用具有重要的经济价值和社会效益。工艺流程如下: 形式存在,易水解;
形式存在,易水解;
②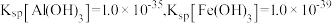 。
。
回答下列问题:
(1)基态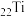 原子有
原子有_______ 个未成对电子,有_______ 个运动状态不同的电子。
(2)“酸浸”时,若要提高浸取速率,可采取的措施是_______ (任写一条)
(3)操作Ⅱ中加热将 水解得
水解得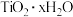 ,写出其反应的离子方程式:
,写出其反应的离子方程式:_______ 。
(4)由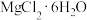 晶体得到无水
晶体得到无水 ,需要
,需要_______ 氛围中加热。
(5)为了使滤渣2沉淀完全(离子浓度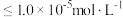 时认为沉淀完全),需“调
时认为沉淀完全),需“调 ”最小为
”最小为_______ 。
 )广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为
)广泛应用于航空、军工、医疗等领域。某火电厂粉煤灰(主要成分为 、
、 、
、 、
、 、
、 、
、 等)的综合利用具有重要的经济价值和社会效益。工艺流程如下:
等)的综合利用具有重要的经济价值和社会效益。工艺流程如下: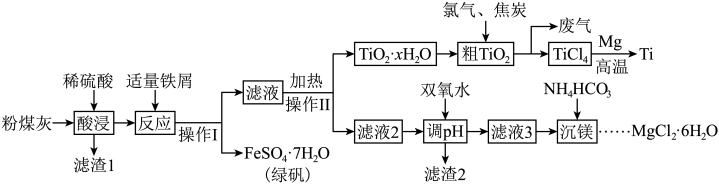
 形式存在,易水解;
形式存在,易水解;②
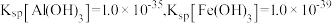 。
。回答下列问题:
(1)基态
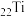 原子有
原子有(2)“酸浸”时,若要提高浸取速率,可采取的措施是
(3)操作Ⅱ中加热将
 水解得
水解得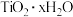 ,写出其反应的离子方程式:
,写出其反应的离子方程式:(4)由
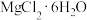 晶体得到无水
晶体得到无水 ,需要
,需要(5)为了使滤渣2沉淀完全(离子浓度
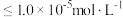 时认为沉淀完全),需“调
时认为沉淀完全),需“调 ”最小为
”最小为
您最近半年使用:0次
解题方法
6 . 丰富多彩的氯家族
18世纪70年代,瑞典化学家舍勒将软锰矿主要成分是MnO2与浓盐酸混合加热。产生了氯气。氯气是一种重要的化工原料,工业上大量用于制造盐酸、次氯酸盐、有机溶剂、农药、染料和药品等,从而形成了品种繁多、功能各异的氯家族。工业上通过电解饱和食盐水的方法制取率气,称为氯碱工业,氯碱工业的产品除应用于化学工业本身之外,还广泛应用于冶金、造纸、农药、有机合成等工业。食盐水在电解前需要精制,主要是为了除去混在氯化钠中的杂质。1.下列物质不能通过单质间的化合反应得到的是________。
| A.FeCl2 | B.FeCl3 | C.CuCl2 | D.HCl |
3.将一瓶新制的氯水长期放置后,溶液中离子取分子浓度不会减少的是________。
| A.Cl2 | B.Cl- | C.H2O | D.HClO |

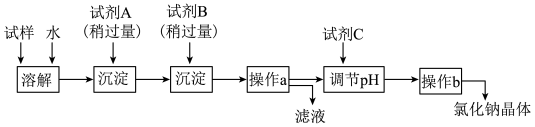
②试剂B是
③试剂C是
④操作b的名称是
您最近半年使用:0次
解题方法
7 . 工业上用FeCl3溶液做印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有H+、Fe3+、Fe2+和Cu2+)进行处理,实现FeCl3溶液再生并回收Cu。___________ ;
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为___________ ,
(3)步骤Ⅱ中发生反应的离子方程式为___________ ;
(4)调节pH时可选用下列哪些试剂___________。
(5)溶液C中的溶质为___________ (填化学式);
(6)步骤Ⅲ中发生反应的化学方程式为___________ 。
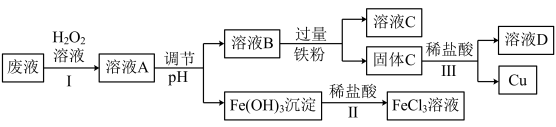
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为
(3)步骤Ⅱ中发生反应的离子方程式为
(4)调节pH时可选用下列哪些试剂___________。
| A.NaOH | B.Cu(OH)2 | C.Fe | D.CuO |
(5)溶液C中的溶质为
(6)步骤Ⅲ中发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
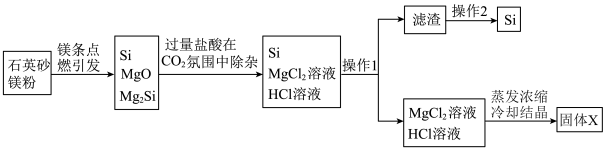
8 . 近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”。某小组拟在实验室制造硅,其流程如图:
除杂原理: ,
,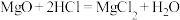
下列说法中正确的是

除杂原理:
 ,
,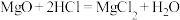
下列说法中正确的是
| A.操作1所需玻璃仪器仅为烧杯、漏斗 |
| B.操作2为重结晶 |
C.固体X为 ,可用于电解制Mg ,可用于电解制Mg |
D.点燃石英砂和镁粉的混合物发生的副反应为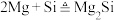 |
您最近半年使用:0次
9 . 某工厂的工业废水中含有大量的 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:___________ 。
(2)实验室进行操作Ⅰ的名称为___________ 。
(3)检验溶液①中含有 的实验方法是
的实验方法是___________ 。
(4)试剂X是___________ (填名称),加入试剂 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)固体②是___________ (填化学式)。
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中, ,
,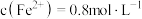 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则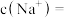
___________ 。
 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:
(2)实验室进行操作Ⅰ的名称为
(3)检验溶液①中含有
 的实验方法是
的实验方法是(4)试剂X是
 发生反应的离子方程式为
发生反应的离子方程式为(5)固体②是
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中,
 ,
,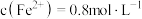 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则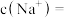
您最近半年使用:0次
10 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①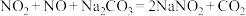 ;
;
②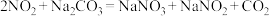 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
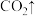 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
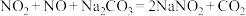 ;
;②
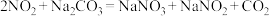 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近半年使用:0次



