解题方法
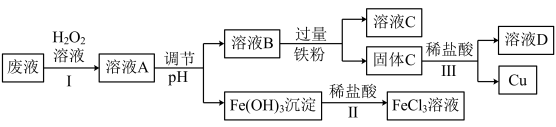
1 . 工业上用FeCl3溶液做印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有H+、Fe3+、Fe2+和Cu2+)进行处理,实现FeCl3溶液再生并回收Cu。___________ ;
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为___________ ,
(3)步骤Ⅱ中发生反应的离子方程式为___________ ;
(4)调节pH时可选用下列哪些试剂___________。
(5)溶液C中的溶质为___________ (填化学式);
(6)步骤Ⅲ中发生反应的化学方程式为___________ 。
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为
(3)步骤Ⅱ中发生反应的离子方程式为
(4)调节pH时可选用下列哪些试剂___________。
| A.NaOH | B.Cu(OH)2 | C.Fe | D.CuO |
(5)溶液C中的溶质为
(6)步骤Ⅲ中发生反应的化学方程式为
您最近半年使用:0次
名校
解题方法
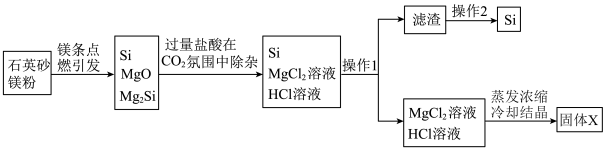
2 . 近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”。某小组拟在实验室制造硅,其流程如图:
除杂原理: ,
,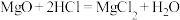
下列说法中正确的是

除杂原理:
 ,
,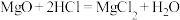
下列说法中正确的是
| A.操作1所需玻璃仪器仅为烧杯、漏斗 |
| B.操作2为重结晶 |
C.固体X为 ,可用于电解制Mg ,可用于电解制Mg |
D.点燃石英砂和镁粉的混合物发生的副反应为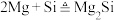 |
您最近半年使用:0次
3 . 某工厂的工业废水中含有大量的 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:___________ 。
(2)实验室进行操作Ⅰ的名称为___________ 。
(3)检验溶液①中含有 的实验方法是
的实验方法是___________ 。
(4)试剂X是___________ (填名称),加入试剂 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(5)固体②是___________ (填化学式)。
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中, ,
,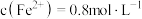 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则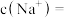
___________ 。
 、较多的
、较多的 和少量的
和少量的 。为了减少污染并变废为宝,工厂计划从该废水中回收
。为了减少污染并变废为宝,工厂计划从该废水中回收 和金属铜。根据以下流程图,请回答下列问题:
和金属铜。根据以下流程图,请回答下列问题:
(2)实验室进行操作Ⅰ的名称为
(3)检验溶液①中含有
 的实验方法是
的实验方法是(4)试剂X是
 发生反应的离子方程式为
发生反应的离子方程式为(5)固体②是
(6)若硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液中,
 ,
,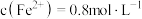 ,
, ,不考虑溶液中含有极少量的
,不考虑溶液中含有极少量的 和
和 ,则
,则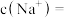
您最近半年使用:0次
4 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①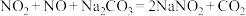 ;
;
②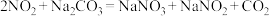 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
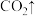 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
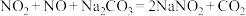 ;
;②
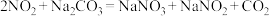 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近半年使用:0次
名校
解题方法
5 . 二氧化碲( )是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为
)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为 ,还含有少量
,还含有少量 、
、 )为原料制备
)为原料制备 并获得海绵铜的工艺流程如图所示。
并获得海绵铜的工艺流程如图所示。 是不溶于水的固体;碱浸液的主要成分为
是不溶于水的固体;碱浸液的主要成分为 和
和 。
。
请回答下列问题:
(1)浸渣 的主要成分为
的主要成分为______ (填化学式)。
(2)“氧化酸浸”时,为了加快反应速率,除将铜碲渣粉碎外,还可以采取的措施为______ (写一种即可);配平该过程中发生反应的离子方程式_______ :
______ +______
+______ +______
+______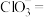 ______
______ +______
+______ +______
+______ +______
+______
若用稀硝酸代替 ,不足之处可能是
,不足之处可能是______ 。
(3)“净化中和”时, 转化为
转化为 反应的化学方程式为
反应的化学方程式为______ ;“过滤”弃去中和废液后,须洗涤沉淀,洗涤的操作为______ 。
(4)工业上制备的海绵铜中含有杂质 和
和 ,可以用______除去海绵铜中的杂质(填标号)。
,可以用______除去海绵铜中的杂质(填标号)。
 )是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为
)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为 ,还含有少量
,还含有少量 、
、 )为原料制备
)为原料制备 并获得海绵铜的工艺流程如图所示。
并获得海绵铜的工艺流程如图所示。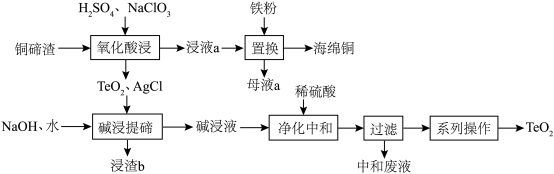
 是不溶于水的固体;碱浸液的主要成分为
是不溶于水的固体;碱浸液的主要成分为 和
和 。
。请回答下列问题:
(1)浸渣
 的主要成分为
的主要成分为(2)“氧化酸浸”时,为了加快反应速率,除将铜碲渣粉碎外,还可以采取的措施为
______
 +______
+______ +______
+______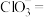 ______
______ +______
+______ +______
+______ +______
+______
若用稀硝酸代替
 ,不足之处可能是
,不足之处可能是(3)“净化中和”时,
 转化为
转化为 反应的化学方程式为
反应的化学方程式为(4)工业上制备的海绵铜中含有杂质
 和
和 ,可以用______除去海绵铜中的杂质(填标号)。
,可以用______除去海绵铜中的杂质(填标号)。| A.稀硝酸 | B.稀盐酸 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近半年使用:0次
名校
解题方法
6 . 锑(Sb)及其化合物广泛用于化工生产。以粗锑氧为原料制备Sb和 的工艺流程如图所示。
的工艺流程如图所示。 ,含有
,含有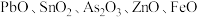 等杂质;
等杂质;
Ⅱ.浸出液主要含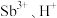 和
和 ,还含有
,还含有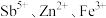 和
和 等杂质;
等杂质;
Ⅲ. 为两性氧化物;
为两性氧化物;
回答下列问题:
(1)已知 在熔融状态下不导电,写出
在熔融状态下不导电,写出 的电子式
的电子式___________ 。
(2)“水解”是利用 的水解反应制取
的水解反应制取 (
( 水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将
水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将 慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:
慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:___________ 。
(3)“过滤”得到滤渣成分SbOCl,加氨水对其“除氯”的离子反应方程式为:___________ 。
(4)为提高 的纯度,需要洗掉“滤渣Ⅱ”表面的
的纯度,需要洗掉“滤渣Ⅱ”表面的 ,最好选取的洗涤剂是___________(填标号)。
,最好选取的洗涤剂是___________(填标号)。
(5)“沉锌”时,若溶液中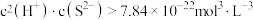 ,会逸出
,会逸出 气体,影响“沉锌”的顺利进行。则要使
气体,影响“沉锌”的顺利进行。则要使 沉淀完全,溶液中的
沉淀完全,溶液中的 最大为
最大为___________  。(已知:①25℃时,
。(已知:①25℃时, ;②溶液中离子浓度:
;②溶液中离子浓度: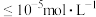 时,认为沉淀完全。)
时,认为沉淀完全。)
(6)“除砷”时有 生成(不含其他含P微粒),该反应的化学方程式为
生成(不含其他含P微粒),该反应的化学方程式为___________ 。
(7)某企业对粗铜精炼阳极泥中锑元素进行回收。
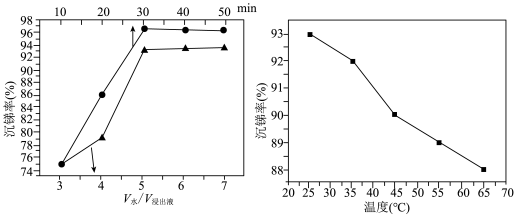
经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为___________ 。
 的工艺流程如图所示。
的工艺流程如图所示。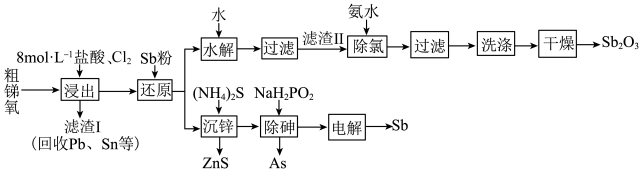
 ,含有
,含有 等杂质;
等杂质;Ⅱ.浸出液主要含
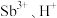 和
和 ,还含有
,还含有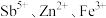 和
和 等杂质;
等杂质;Ⅲ.
 为两性氧化物;
为两性氧化物;回答下列问题:
(1)已知
 在熔融状态下不导电,写出
在熔融状态下不导电,写出 的电子式
的电子式(2)“水解”是利用
 的水解反应制取
的水解反应制取 (
( 水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将
水解反应分三步,中间产物有SbOCl等)。为了促进水解趋于完全,操作时将 慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:
慢慢加入大量水中,反应后期还有加入少量氨水。试结合平衡移动原理解释这两项操作的用:(3)“过滤”得到滤渣成分SbOCl,加氨水对其“除氯”的离子反应方程式为:
(4)为提高
 的纯度,需要洗掉“滤渣Ⅱ”表面的
的纯度,需要洗掉“滤渣Ⅱ”表面的 ,最好选取的洗涤剂是___________(填标号)。
,最好选取的洗涤剂是___________(填标号)。| A.NaOH溶液 | B. | C.KOH溶液 | D.NaCl溶液 |
(5)“沉锌”时,若溶液中
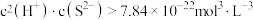 ,会逸出
,会逸出 气体,影响“沉锌”的顺利进行。则要使
气体,影响“沉锌”的顺利进行。则要使 沉淀完全,溶液中的
沉淀完全,溶液中的 最大为
最大为 。(已知:①25℃时,
。(已知:①25℃时, ;②溶液中离子浓度:
;②溶液中离子浓度: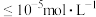 时,认为沉淀完全。)
时,认为沉淀完全。)(6)“除砷”时有
 生成(不含其他含P微粒),该反应的化学方程式为
生成(不含其他含P微粒),该反应的化学方程式为(7)某企业对粗铜精炼阳极泥中锑元素进行回收。
经硫酸和氯化钠浸出后的Sb(Ⅲ)在一定条件下可发生水解反应进而沉淀出锑,为了寻求最佳沉锑条件,分别对水解时间、浸出液稀释倍数、温度等因素进行探究,结果如图所示。水解沉锑的最佳条件为
您最近半年使用:0次
解题方法
7 . 铁是人类较早使用的金属之一、运用铁及其化合物的知识,完成下列问题。
(1)现有铁和铜的混合物,可以通过___________ 把他们分开。
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:___________ 。
反应后的废液中含有Fe3+,可以用___________ 检验。
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。___________ ,黄绿色气体C可以把滤液转化成FeCl3腐蚀液,写出反应过程中的离子方程式___________ 。
(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,___________ (补全实验现象),此过程涉及氧化还原反应的化学方程式是___________ 。
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________ 。
(1)现有铁和铜的混合物,可以通过
A.盐酸 B.NaOH C.FeCl3
(2)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。
请写出FeCl3溶液与铜反应的离子方程式:
反应后的废液中含有Fe3+,可以用
(3)现将反应后的废液采用以下流程进行回收再生,根据流程图完成下列填空。

(4)取“滤液”少许于试管中,然后滴加氢氧化钠溶液,产生白色沉淀,
(5)把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为
您最近半年使用:0次
名校
解题方法
8 . 溴主要用于制造汽油抗爆剂、照相感光材料、药物、试剂和农药等。空气吹出法工艺利用制盐后的卤水提取溴。这种卤水含溴离子的浓度很低,在生产中用下列方法制取液溴。 、
、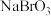
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含 的海水”中溴的质量分数
的海水”中溴的质量分数___________ (填“高”、“低”)。
(2)步骤③的操作是:___________________ ;经过该操作获得含 的空气,利用了
的空气,利用了
_________________ 的性质。
步骤⑥的蒸馏过程中,溴出口温度要控制在 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:_______________________ 。
(3)步骤④和⑤的目的是:__________________ ;步骤④用浓的 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:___________________ 。
(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:___________ ,然后操作名称是:___________ 。
 、
、
(1)第⑤步后的“溴水混合物”中溴的质量分数比“含
 的海水”中溴的质量分数
的海水”中溴的质量分数(2)步骤③的操作是:
 的空气,利用了
的空气,利用了
步骤⑥的蒸馏过程中,溴出口温度要控制在
 ,温度过高或过低都不利于生产,请解释原因:
,温度过高或过低都不利于生产,请解释原因:(3)步骤④和⑤的目的是:
 溶液,发生反应的离子方程式为:
溶液,发生反应的离子方程式为:(4)第⑧步分离的目的是除去溴中混有的少量氯气和水蒸气,要除去少量的氯气,加入的试剂是:
您最近半年使用:0次
解题方法
9 . 某磁铁矿石 的主要成分是磁性氧化铁
的主要成分是磁性氧化铁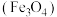 ,还含少量的
,还含少量的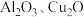 。某工厂利用此矿石进行有关物质的回收利用,其中
。某工厂利用此矿石进行有关物质的回收利用,其中 为常见的补铁剂,工艺流程如图(已知
为常见的补铁剂,工艺流程如图(已知 不溶于水和碱,但溶于强酸:
不溶于水和碱,但溶于强酸: )。根据流程回答下列问题:
)。根据流程回答下列问题: 的溶质主要是
的溶质主要是___________ ,铝离子的结构示意图为___________ 。
(2)溶液D与过量试剂 反应的离子方程式有
反应的离子方程式有___________ 。
(3)在溶液 中滴加
中滴加 溶液的现象是
溶液的现象是___________ 。
(4)㩰作1的名称为___________ 。
(5)写出检验溶液 中
中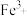 原理的离子方程式:
原理的离子方程式:___________ 。
 的主要成分是磁性氧化铁
的主要成分是磁性氧化铁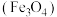 ,还含少量的
,还含少量的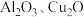 。某工厂利用此矿石进行有关物质的回收利用,其中
。某工厂利用此矿石进行有关物质的回收利用,其中 为常见的补铁剂,工艺流程如图(已知
为常见的补铁剂,工艺流程如图(已知 不溶于水和碱,但溶于强酸:
不溶于水和碱,但溶于强酸: )。根据流程回答下列问题:
)。根据流程回答下列问题:
 的溶质主要是
的溶质主要是(2)溶液D与过量试剂
 反应的离子方程式有
反应的离子方程式有(3)在溶液
 中滴加
中滴加 溶液的现象是
溶液的现象是(4)㩰作1的名称为
(5)写出检验溶液
 中
中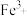 原理的离子方程式:
原理的离子方程式:
您最近半年使用:0次
解题方法
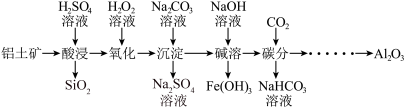
10 . 工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。_______ 。
(2)氧化:用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为_______ 。
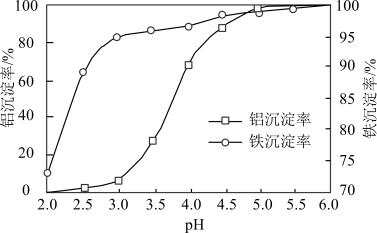
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。_______ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3.下列措施中能提高单位时间内铝元素浸出率的有_______ (填序号)。
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为_______ 。
(2)氧化:用H2O2溶液将Fe2+氧化为Fe3+,反应的离子方程式为
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3.下列措施中能提高单位时间内铝元素浸出率的有
A.适当增大NaOH溶液浓度 B.适当加快搅拌速率 C.适当降低温度
(5)碳分:向“碱溶”后的溶液中通入足量CO2气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近半年使用:0次



