名校
解题方法
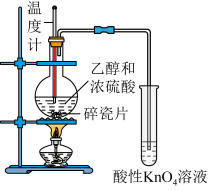
1 . 近日,清华大学等重点高校为解决中国“芯”——半导体芯片,成立了“芯片学院”。某小组拟在实验室制造硅,其流程如图:
除杂原理: ,
,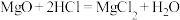
下列说法中正确的是
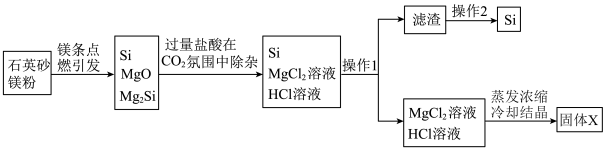

除杂原理:
 ,
,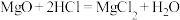
下列说法中正确的是
| A.操作1所需玻璃仪器仅为烧杯、漏斗 |
| B.操作2为重结晶 |
C.固体X为 ,可用于电解制Mg ,可用于电解制Mg |
D.点燃石英砂和镁粉的混合物发生的副反应为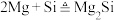 |
您最近半年使用:0次
名校
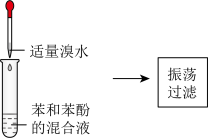
2 . 如图图示实验能达成相应目的的是
|
|
| A.除去苯中少量苯酚 | B.检验乙醇发生消去反应生成乙烯 |
|
|
| C.鉴别乙醛和乙醇 | D.分离水和硝基苯 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
3 . 钛酸钡( )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
已知:①氧化性: ;
; 。
。
②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图) 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的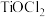 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入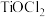 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。
(1)仪器B的名称是_______ 。
(2)仪器A的作用是_______ ,冷凝水从_______ (填“a”或“b”)口通入。
(3)写出氨水与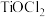 溶液反应产生
溶液反应产生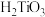 的化学方程式
的化学方程式_______ 。
Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。
(4)写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是_______ ,若想获得比亚微米级钛酸钡晶体更大颗粒的晶体,应置于_______ (填“<”或“>”)100℃的烘箱中反应3h。
Ⅲ.测定产品纯度
取 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用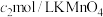 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)
(6)实验中所用滴定管为_______ (填“酸式”或“碱式”或“酸式和碱式”)滴定管。
(7)产品的纯度为_______ %。
 )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。已知:①氧化性:
 ;
; 。
。②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图)

 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的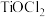 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入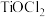 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。(1)仪器B的名称是
(2)仪器A的作用是
(3)写出氨水与
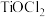 溶液反应产生
溶液反应产生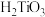 的化学方程式
的化学方程式Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为
 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。(4)写出
 与
与 反应的化学方程式
反应的化学方程式(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是
Ⅲ.测定产品纯度
取
 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用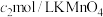 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)(6)实验中所用滴定管为
(7)产品的纯度为
您最近半年使用:0次
名校
解题方法
4 . 某课题组以锂辉石(主要成分为 ,还含有铁、钙、镁等元素)为原料,按下列流程制备
,还含有铁、钙、镁等元素)为原料,按下列流程制备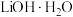 ,并制备锂离子电池正极材料
,并制备锂离子电池正极材料 。
。 不溶于水,能溶于强酸;
不溶于水,能溶于强酸;
② 晶体和
晶体和 晶体的溶解度随温度变化的曲线如图所示:
晶体的溶解度随温度变化的曲线如图所示:
(1)下列操作或描述不正确的是__________。
(2)步骤Ⅴ通过两次结晶,可得到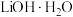 溶液和
溶液和 。需要用到下列操作:
。需要用到下列操作:
a.过滤; b.趁热过滤; c.冷却至0℃; d.用烧杯承接滤液;
e.在40℃时蒸发溶剂至溶液出现少量固体,停止加热;
f.在100℃时蒸发溶剂至溶液体积减小约原来一半,有固体析出,停止加热。
写出“两次结晶”的正确操作顺序_______ :____→____→d→____→____→____。
(3)在步骤Ⅶ,若将 和
和 的混合液滴加到
的混合液滴加到 溶液中,获得的产品纯度较低,请给出可能的原因:
溶液中,获得的产品纯度较低,请给出可能的原因:__________ 。
(4) 标准溶液浓度的测定:准确称取一定质量的硼砂
标准溶液浓度的测定:准确称取一定质量的硼砂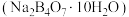 溶于水配成溶液,以如图装置测定
溶于水配成溶液,以如图装置测定 溶液的浓度。已知硼砂与
溶液的浓度。已知硼砂与 发生反应:
发生反应: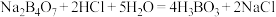 ,则锥形瓶内装入的溶液为
,则锥形瓶内装入的溶液为__________ ;若已知滴定终点pH为5.27,采用甲基橙作指示剂会导致 溶液浓度测定结果
溶液浓度测定结果__________ (填“偏高”、“偏低”或“无影响”)。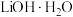 的质量分数(杂质主要为
的质量分数(杂质主要为 ,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为
,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为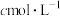 的标准
的标准 溶液滴定至溶液刚好褪色,消耗
溶液滴定至溶液刚好褪色,消耗 ,再加入甲基橙,继续用以上标准
,再加入甲基橙,继续用以上标准 溶液滴定至溶液刚好变色,又消耗
溶液滴定至溶液刚好变色,又消耗 。则样品中
。则样品中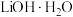 的质量分数为
的质量分数为__________ 。(已知: 溶液pH在8左右,且溶液的pH随浓度变化不大)
溶液pH在8左右,且溶液的pH随浓度变化不大)
 ,还含有铁、钙、镁等元素)为原料,按下列流程制备
,还含有铁、钙、镁等元素)为原料,按下列流程制备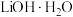 ,并制备锂离子电池正极材料
,并制备锂离子电池正极材料 。
。
 不溶于水,能溶于强酸;
不溶于水,能溶于强酸;②
 晶体和
晶体和 晶体的溶解度随温度变化的曲线如图所示:
晶体的溶解度随温度变化的曲线如图所示: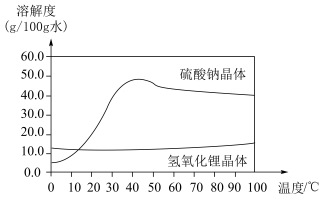
(1)下列操作或描述不正确的是__________。
A.步骤Ⅰ矿石研磨,可提高酸化焙烧效率,促进 的溶解 的溶解 |
B.步骤Ⅱ若减少浓硫酸用量,会导致 在步骤Ⅲ水解产生胶体吸附 在步骤Ⅲ水解产生胶体吸附 ,降低 ,降低 的浸出率 的浸出率 |
| C.模拟上述流程,步骤Ⅰ、Ⅲ所用的仪器有蒸发皿、烧杯、玻璃棒、耐酸过滤器及热源 |
D.步骤Ⅳ中加入的X可以是先加入 调节pH以除去 调节pH以除去 ,再加入 ,再加入 除尽 除尽 和 和 |
(2)步骤Ⅴ通过两次结晶,可得到
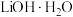 溶液和
溶液和 。需要用到下列操作:
。需要用到下列操作:a.过滤; b.趁热过滤; c.冷却至0℃; d.用烧杯承接滤液;
e.在40℃时蒸发溶剂至溶液出现少量固体,停止加热;
f.在100℃时蒸发溶剂至溶液体积减小约原来一半,有固体析出,停止加热。
写出“两次结晶”的正确操作顺序
(3)在步骤Ⅶ,若将
 和
和 的混合液滴加到
的混合液滴加到 溶液中,获得的产品纯度较低,请给出可能的原因:
溶液中,获得的产品纯度较低,请给出可能的原因:(4)
 标准溶液浓度的测定:准确称取一定质量的硼砂
标准溶液浓度的测定:准确称取一定质量的硼砂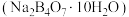 溶于水配成溶液,以如图装置测定
溶于水配成溶液,以如图装置测定 溶液的浓度。已知硼砂与
溶液的浓度。已知硼砂与 发生反应:
发生反应: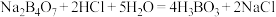 ,则锥形瓶内装入的溶液为
,则锥形瓶内装入的溶液为 溶液浓度测定结果
溶液浓度测定结果
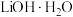 的质量分数(杂质主要为
的质量分数(杂质主要为 ,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为
,其他杂质不参与反应),取a g样品溶解,以酚酞为指示剂,用浓度为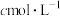 的标准
的标准 溶液滴定至溶液刚好褪色,消耗
溶液滴定至溶液刚好褪色,消耗 ,再加入甲基橙,继续用以上标准
,再加入甲基橙,继续用以上标准 溶液滴定至溶液刚好变色,又消耗
溶液滴定至溶液刚好变色,又消耗 。则样品中
。则样品中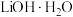 的质量分数为
的质量分数为 溶液pH在8左右,且溶液的pH随浓度变化不大)
溶液pH在8左右,且溶液的pH随浓度变化不大)
您最近半年使用:0次
名校
解题方法
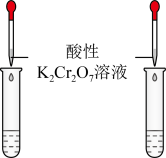
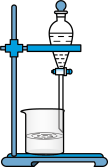
5 . 下列实验装置使用不正确 的是
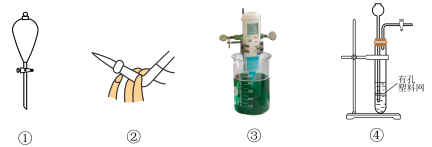
| A.图①装置可用于分离溴苯和水的混合物,且溴苯从下口放出 |
| B.可用图②方法排出碱式滴定管下端的气泡 |
| C.图③装置是用pH计测定溶液pH值,使用前pH计需洗涤和校正 |
| D.图④装置用于电石与水制取乙炔 |
您最近半年使用:0次
解题方法
6 . 一个由北理工、北大、南阳理工等科学家组成的联合研究团队,首次提出并构筑出全新的2D-1D的本征异维超结构形式,该异维超结构由2DVS2和1DVS相互交叉排列,实现了多重研究突破。某科研小组以钒渣(主要成分是V2O3、Fe2O3、Al2O3、MgO、CuO和有机杂质)为主要原料制备VS、VS2的流程如下:
①含钒元素的离子在溶液中的主要存在形式与pH如下表所示。
②钒酸(H3VO4)是强酸,NH4VO3是白色粉末,微溶于冷水,可溶于热水。
请回答下列问题:
(1)写两种质子数和电子数均与 相同的离子:
相同的离子:_______ (填化学式)。
(2)废料中有机杂质在_______ (填工序名称)中被除去。
(3)“净化1”中pH=6时Fe3+、Al3+、Cu2+已完全沉淀,但在实际生产中仍然调节pH=7左右,其目的是_______ 。
(4)滤渣2的主要成分是_______ (填化学式)。
(5)洗涤NH4VO3沉淀时,与选用热水洗涤相比,流程中选用冷水洗涤的优点为_______ ;检验是否洗涤干净的方法是_______ 。
(6)试剂A可能是Al、CO、H2,若选择Al,除了生成钒单质,还会生成铝的氧化物和一种能使湿润的红色石蕊试纸变蓝的气体,其化学方程式为_______ 。若制备等质量的钒,需要还原剂Al、CO、H2的质量之比为_______ 。
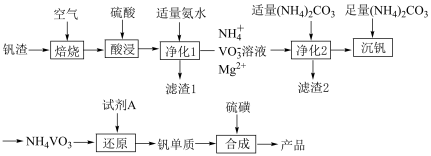
①含钒元素的离子在溶液中的主要存在形式与pH如下表所示。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O | VO |
请回答下列问题:
(1)写两种质子数和电子数均与
 相同的离子:
相同的离子:(2)废料中有机杂质在
(3)“净化1”中pH=6时Fe3+、Al3+、Cu2+已完全沉淀,但在实际生产中仍然调节pH=7左右,其目的是
(4)滤渣2的主要成分是
(5)洗涤NH4VO3沉淀时,与选用热水洗涤相比,流程中选用冷水洗涤的优点为
(6)试剂A可能是Al、CO、H2,若选择Al,除了生成钒单质,还会生成铝的氧化物和一种能使湿润的红色石蕊试纸变蓝的气体,其化学方程式为
您最近半年使用:0次
名校
7 . 丙烯腈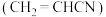 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN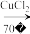 CH2=CHCN
CH2=CHCN
Ⅰ.制备催化剂
(1)通过查阅资料有两种方案可以制备
方案1:铜屑与 在浓盐酸中反应
在浓盐酸中反应
方案2:铜丝在氯气中燃烧
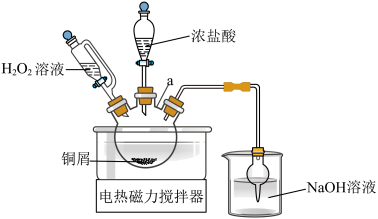
方案1的实验原理如图所示 的名称
的名称___________ 。
②请用离子方程式表达,写出方案1的反应原理___________ 。
(2)用恒压滴液漏斗分批多次滴加 ,且
,且 过量,原因是
过量,原因是___________ 。
(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为___________ 。
Ⅱ.合成丙烯腈 ,还含有少量硫化钙
,还含有少量硫化钙
②易挥发,有毒,具有较强的还原性
(4) 的电子式
的电子式___________ 。
(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是___________ 。
(6)从下列选择装置D中可盛放的溶液___________。
(7)工业用 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈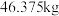 ,计算产率
,计算产率_______ 。(写出计算过程)
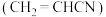 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理如下HC≡CH+HCN
反应制得。原理如下HC≡CH+HCN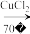 CH2=CHCN
CH2=CHCNⅠ.制备催化剂

(1)通过查阅资料有两种方案可以制备
方案1:铜屑与
 在浓盐酸中反应
在浓盐酸中反应方案2:铜丝在氯气中燃烧
方案1的实验原理如图所示
 的名称
的名称②请用离子方程式表达,写出方案1的反应原理
(2)用恒压滴液漏斗分批多次滴加
 ,且
,且 过量,原因是
过量,原因是(3)方案2燃烧后的固体溶于水,过滤后发现一些白色固体
 ,为检测
,为检测 的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测
的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测 为
为Ⅱ.合成丙烯腈
 ,还含有少量硫化钙
,还含有少量硫化钙②易挥发,有毒,具有较强的还原性
(4)
 的电子式
的电子式(5)纯净的乙炔是无色、无臭的气体。但用电石制取的乙炔时常伴有臭鸡蛋气味,这种物质是
(6)从下列选择装置D中可盛放的溶液___________。
| A.高锰酸钾溶液 | B. 溶液 溶液 | C.饱和食盐水 | D.盐酸溶液 |
(7)工业用
 含
含 质量分数
质量分数 的电石,实际生产得到丙烯腈
的电石,实际生产得到丙烯腈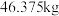 ,计算产率
,计算产率
您最近半年使用:0次
名校
8 . 海洋资源丰富,从海水中获取镁和溴的流程示意图如下:

| A.从经济效益角度考虑,工业上使用的试剂X是氢氧化钠 |
B.可用 代替 代替 吸收含溴的空气 吸收含溴的空气 |
C.直接将 溶液加热蒸干得无水 溶液加热蒸干得无水 |
| D.虚线框内流程的主要目的是减少环境污染 |
您最近半年使用:0次
昨日更新
|
172次组卷
|
3卷引用:2024届内蒙古自治区赤峰市高三一模化学试题
2024届内蒙古自治区赤峰市高三一模化学试题(已下线)通关练02 重要无机化合物的性质及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)河南省郑州市宇华实验学校2024届高三下学期第三次模拟考试化学试题
名校
9 . 亚氯酸钠 是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取
是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取 水溶液等。
水溶液等。
已知:I、 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于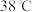 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于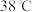 ,则析出
,则析出 ;若溶液温度高于
;若溶液温度高于 分解为
分解为 和
和 。
。
ii. 气体浓度超过
气体浓度超过 时,长期存放易发生爆炸性分解,通常需现用现制。
时,长期存放易发生爆炸性分解,通常需现用现制。
iii. 气体在中性和碱性溶液中不能稳定存在。
气体在中性和碱性溶液中不能稳定存在。
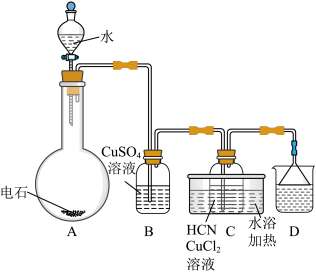
实验室制备亚氯酸钠晶体的装置如图所示(夹持装置已省略)。
(1)装置 为
为 气体的发生装置,产生
气体的发生装置,产生 气体的化学方程式为
气体的化学方程式为___________ 。
(2) 气体与装置
气体与装置 试管中的混合溶液反应生成
试管中的混合溶液反应生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)反应结束后,为从装置 试管中获得
试管中获得 晶体,应将
晶体,应将 试管中的溶液在
试管中的溶液在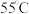 下蒸发结晶、趁热过滤,然后用
下蒸发结晶、趁热过滤,然后用___________  (填“35”“65”或“
(填“35”“65”或“ ”)热水洗涤晶体,最后
”)热水洗涤晶体,最后___________ 干燥,得到成品。
(4)实验须使装置 中
中 稍微过量,原因是
稍微过量,原因是___________ 。
(5)实验结束后,关闭 ,打开
,打开 ;一段时间后,断开
;一段时间后,断开 左侧橡胶管与玻璃管的连接,并从接口处向装置
左侧橡胶管与玻璃管的连接,并从接口处向装置 中鼓入一定量空气。以上操作的目的是
中鼓入一定量空气。以上操作的目的是___________ 。
(6) 纯度的测定:取样品
纯度的测定:取样品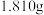 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知:
;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得平均消耗
标准溶液滴定至终点,重复2次,测得平均消耗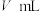 标准溶液(已知:
标准溶液(已知: )。样品中
)。样品中 的纯度为
的纯度为___________  (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
 是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取
是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取 水溶液等。
水溶液等。已知:I、
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于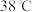 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于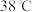 ,则析出
,则析出 ;若溶液温度高于
;若溶液温度高于 分解为
分解为 和
和 。
。ii.
 气体浓度超过
气体浓度超过 时,长期存放易发生爆炸性分解,通常需现用现制。
时,长期存放易发生爆炸性分解,通常需现用现制。iii.
 气体在中性和碱性溶液中不能稳定存在。
气体在中性和碱性溶液中不能稳定存在。实验室制备亚氯酸钠晶体的装置如图所示(夹持装置已省略)。
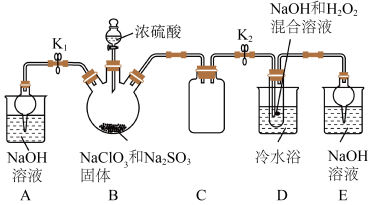
(1)装置
 为
为 气体的发生装置,产生
气体的发生装置,产生 气体的化学方程式为
气体的化学方程式为(2)
 气体与装置
气体与装置 试管中的混合溶液反应生成
试管中的混合溶液反应生成 ,该反应的离子方程式为
,该反应的离子方程式为(3)反应结束后,为从装置
 试管中获得
试管中获得 晶体,应将
晶体,应将 试管中的溶液在
试管中的溶液在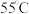 下蒸发结晶、趁热过滤,然后用
下蒸发结晶、趁热过滤,然后用 (填“35”“65”或“
(填“35”“65”或“ ”)热水洗涤晶体,最后
”)热水洗涤晶体,最后(4)实验须使装置
 中
中 稍微过量,原因是
稍微过量,原因是(5)实验结束后,关闭
 ,打开
,打开 ;一段时间后,断开
;一段时间后,断开 左侧橡胶管与玻璃管的连接,并从接口处向装置
左侧橡胶管与玻璃管的连接,并从接口处向装置 中鼓入一定量空气。以上操作的目的是
中鼓入一定量空气。以上操作的目的是(6)
 纯度的测定:取样品
纯度的测定:取样品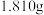 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知:
;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得平均消耗
标准溶液滴定至终点,重复2次,测得平均消耗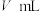 标准溶液(已知:
标准溶液(已知: )。样品中
)。样品中 的纯度为
的纯度为 (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
您最近半年使用:0次
解题方法
10 . 锂离子电池是新能源重要组成部分,锂离子电池的回收利用日渐成为化学工作者的重要研究课题。某研究组利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺流程如下:
进行氯化处理以回收Li、Co等金属,工艺流程如下: ,
,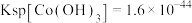 。
。
回答下列问题:
(1)基态Co原子的价层电子排布式是___________ 。
(2)“烧渣”是LiCl、 和
和 的混合物,请写出“500℃焙烧”的化学方程式
的混合物,请写出“500℃焙烧”的化学方程式___________ 。
(3)“500℃焙烧”后剩余的 应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释
应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释 比
比 易水解的原因
易水解的原因___________ 。
(4)若“滤液2”中 浓度为:
浓度为: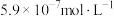 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为___________ 。
(5)“沉锂”步骤的“试剂A”的化学式为___________ 。
(6)将“滤饼2”在通入充足空气后,进行850℃煅烧才能得到 。写出该过程的化学方程式
。写出该过程的化学方程式___________ 。
(7)钴酸锂(LiCoO2)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为___________ 。
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺流程如下:
进行氯化处理以回收Li、Co等金属,工艺流程如下: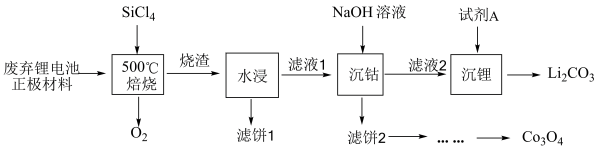
 ,
,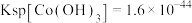 。
。回答下列问题:
(1)基态Co原子的价层电子排布式是
(2)“烧渣”是LiCl、
 和
和 的混合物,请写出“500℃焙烧”的化学方程式
的混合物,请写出“500℃焙烧”的化学方程式(3)“500℃焙烧”后剩余的
 应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释
应先除去,否则水浸时会因其水解产生大量烟雾。试从物质结构的角度解释 比
比 易水解的原因
易水解的原因(4)若“滤液2”中
 浓度为:
浓度为: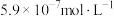 ,“沉钴”时应控制pH为
,“沉钴”时应控制pH为(5)“沉锂”步骤的“试剂A”的化学式为
(6)将“滤饼2”在通入充足空气后,进行850℃煅烧才能得到
 。写出该过程的化学方程式
。写出该过程的化学方程式(7)钴酸锂(LiCoO2)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
 的个数为
的个数为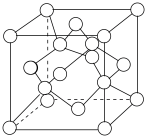
您最近半年使用:0次