2024·河南·模拟预测
解题方法
1 . 一种回收锌电解阳极泥(主要成分为 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物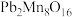 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。
(1)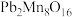 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为___________ 。
(2)“还原酸浸”过程中主要反应的化学方程式为___________ 。
(3)结合 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是___________ 、___________ ,用___________ (填物质的名称)洗涤、干燥。 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为___________ 。
(5)通过计算说明可用 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因___________ 。[已知:25℃时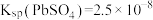 ,
,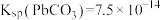 ]
]
(6)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 、
、 和ZnO,还有少量锰铅氧化物
和ZnO,还有少量锰铅氧化物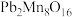 和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题:
和Ag)中金属元素锌、锰、铅和银的工艺如图所示。回答下列问题: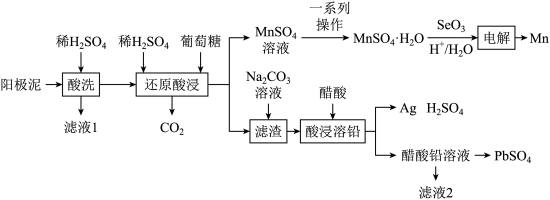
 易溶于水,不溶于乙醇。
易溶于水,不溶于乙醇。(1)
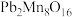 中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为
中Pb的化合价为+2价,Mn的化合价有+2价和+4价,则氧化物中+2价和+4价Mn的个数比为(2)“还原酸浸”过程中主要反应的化学方程式为
(3)结合
 溶解度曲线图分析,由
溶解度曲线图分析,由 溶液制得
溶液制得 晶体的“一系列操作”是
晶体的“一系列操作”是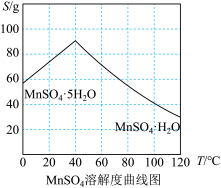
 与水反应生成二元弱酸
与水反应生成二元弱酸 ,在阴极放电生成Se单质,有利于
,在阴极放电生成Se单质,有利于 电还原沉积。则
电还原沉积。则 放电的电极反应式为
放电的电极反应式为(5)通过计算说明可用
 溶液将“滤渣”中的
溶液将“滤渣”中的 转化为
转化为 的原因
的原因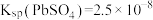 ,
,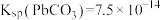 ]
](6)锰、镍、镓的某种磁性形状记忆型合金的晶胞结构如图所示。
 表示阿伏加德罗常数的值。该晶体的密度为
表示阿伏加德罗常数的值。该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近半年使用:0次
名校
解题方法
2 . 茫茫大海是化学元素溴的“故乡”,海水中溴的含量约为67 mg/L。从海水中提取溴的工业流程如下:
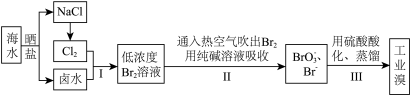
(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是_______ 。
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的______(填字母)。
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是________ , 还原剂是_______ ,然后用氯气氧化上述反应的产物后蒸馏,写出氯气氧化HBr的离子方程式:____________ 。

(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的______(填字母)。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是
您最近半年使用:0次
名校
解题方法
3 . 下面是某科研小组利用废铁屑还原浸出软锰矿(主要成分为 )制备硫酸锰及电解其溶液制锰的工艺流程图:
)制备硫酸锰及电解其溶液制锰的工艺流程图:
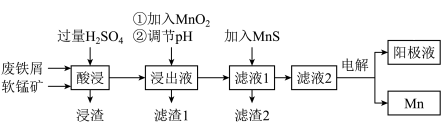
已知:①浸出液中主要含有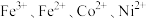 等杂质金属离子;
等杂质金属离子;
②生成氢氧化物的 见下表:
见下表:
③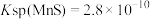 、
、
(1)“酸浸”前将原料粉碎的目的是_______________________________ 。
(2)流程图中“①加入 ”的作用
”的作用_____________ ,若该反应进行不彻底,会使滤液1中有该杂质离子剩余,可以加入_____________ 检验。
(3)流程图中“②调节 ”可以除去某种金属离子,应将溶液
”可以除去某种金属离子,应将溶液 调节控制的范围是
调节控制的范围是_____________ 。
(4)向滤液1中加入 的作用是除去
的作用是除去 等离子,其中除去
等离子,其中除去 发生的反应为
发生的反应为______________________________________ 。当该反应完全后,滤液2中的 与
与 的物质的量浓度之比是
的物质的量浓度之比是_____________ 。
 )制备硫酸锰及电解其溶液制锰的工艺流程图:
)制备硫酸锰及电解其溶液制锰的工艺流程图:
已知:①浸出液中主要含有
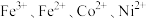 等杂质金属离子;
等杂质金属离子;②生成氢氧化物的
 见下表:
见下表:物质 |
|
|
|
|
|
开始沉淀的 | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
完全沉淀的 | 9.7 | 3.7 | 8.4 | 8.2 | 9.8 |
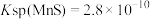 、
、
(1)“酸浸”前将原料粉碎的目的是
(2)流程图中“①加入
 ”的作用
”的作用(3)流程图中“②调节
 ”可以除去某种金属离子,应将溶液
”可以除去某种金属离子,应将溶液 调节控制的范围是
调节控制的范围是(4)向滤液1中加入
 的作用是除去
的作用是除去 等离子,其中除去
等离子,其中除去 发生的反应为
发生的反应为 与
与 的物质的量浓度之比是
的物质的量浓度之比是
您最近半年使用:0次
名校
解题方法
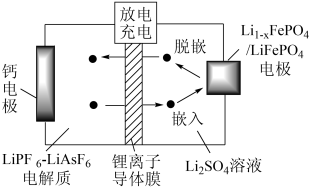
4 . 碳酸锂广泛应用于陶瓷和医药等领域。以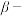 锂辉石(主要成分为
锂辉石(主要成分为 )为原材料制备Li2CO3的工艺流程如下:
)为原材料制备Li2CO3的工艺流程如下:
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH如下表。
(1)步骤Ⅰ前,β-锂辉石要粉碎成细颗粒的目的是______ 。步骤Ⅰ中,酸浸后得到的酸性浊液中含有Li+、 ,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石调节溶液的pH到6沉淀部分杂质离子,然后分离得到浸出液。浸出渣的主要成分是
,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石调节溶液的pH到6沉淀部分杂质离子,然后分离得到浸出液。浸出渣的主要成分是______ (填写化学式)。
(2)①步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______ 。
②下列说法正确的是______ 。
A.步骤Ⅰ的浸出液需冷却后再加入H2O2溶液
B.考虑工业生产成本,步骤Ⅱ中石灰乳更换成烧碱更佳
C.步骤Ⅲ母液中只有Na2SO4和NaOH
D.可通过离子交换膜法电解母液回收利用NaOH
(3)在实验室模拟工业生产中的蒸发浓缩操作,需要用到的硅酸盐仪器有______ 。
(4)步骤Ⅲ中得到的Li2CO3固体需要清洗,简述检验Li2CO3已被清洗干净的操作______ 。
(5)工业上FePO4与Li2CO3在高温条件下与H2C2O4煅烧可得LiFePO4,其常用作锂离子电池电极材料,如图为Ca-LiFePO4可充电电池的工作原理示意图,锂离子导体膜只允许Li+通过。充电时,钙电极为______ (“阳极”或“阴极”),放电时,电极上发生Li+的嵌入的电极反应是______ 。
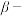 锂辉石(主要成分为
锂辉石(主要成分为 )为原材料制备Li2CO3的工艺流程如下:
)为原材料制备Li2CO3的工艺流程如下:
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH如下表。
| 沉淀物 |  |  |  |  |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
 ,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石调节溶液的pH到6沉淀部分杂质离子,然后分离得到浸出液。浸出渣的主要成分是
,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入石灰石调节溶液的pH到6沉淀部分杂质离子,然后分离得到浸出液。浸出渣的主要成分是(2)①步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有
②下列说法正确的是
A.步骤Ⅰ的浸出液需冷却后再加入H2O2溶液
B.考虑工业生产成本,步骤Ⅱ中石灰乳更换成烧碱更佳
C.步骤Ⅲ母液中只有Na2SO4和NaOH
D.可通过离子交换膜法电解母液回收利用NaOH
(3)在实验室模拟工业生产中的蒸发浓缩操作,需要用到的硅酸盐仪器有
(4)步骤Ⅲ中得到的Li2CO3固体需要清洗,简述检验Li2CO3已被清洗干净的操作
(5)工业上FePO4与Li2CO3在高温条件下与H2C2O4煅烧可得LiFePO4,其常用作锂离子电池电极材料,如图为Ca-LiFePO4可充电电池的工作原理示意图,锂离子导体膜只允许Li+通过。充电时,钙电极为

您最近半年使用:0次
名校
解题方法
5 . 《开宝本草》记载“取钢煅作叶,如笏或团,平面磨错令光净,以盐水洒之,于醋瓮中,阴处埋之百日,铁上衣生,铁华成矣”。铁华粉[主要成分为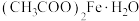 ],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为
],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为 ,含少量
,含少量 等)为原料制备铁华粉的流程如下:
等)为原料制备铁华粉的流程如下:
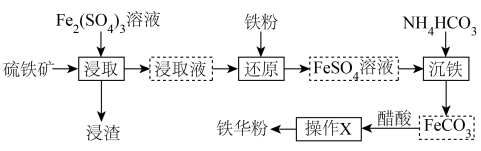
已知:浸渣含有附加值高的非金属单质,浸取液含 和
和 。
。
回答下列问题:
(1)为了提高“浸取”速率,宜采用的措施有___________ (答两条)。
(2)“浸取”中 反应的离子方程式为
反应的离子方程式为___________ 。
(3)若将“还原”中发生的化合反应设计成原电池,则正极反应式为___________ 。
(4)操作X包括蒸发浓缩、___________ 、过滤、洗涤、干燥。“蒸发浓缩”宜在 或
或 保护气氛中进行,其目的是
保护气氛中进行,其目的是___________ 。
(5)已知:常温下, ,
, 的电离常数
的电离常数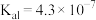 ,
, 。“沉铁”中
。“沉铁”中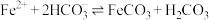 的平衡常数
的平衡常数 为
为________ (结果保留两位有效数字)。
(6)常温下,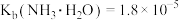 。
。 溶液呈弱碱性,其原因是
溶液呈弱碱性,其原因是________ 。
(7)设计实验证明铁华粉中含 ,宜选择的试剂是___________(填标号)。
,宜选择的试剂是___________(填标号)。
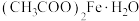 ],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为
],主要功效是养血安神,平肝镇惊,解毒消肿。某小组以硫铁矿(主要成分为 ,含少量
,含少量 等)为原料制备铁华粉的流程如下:
等)为原料制备铁华粉的流程如下:
已知:浸渣含有附加值高的非金属单质,浸取液含
 和
和 。
。回答下列问题:
(1)为了提高“浸取”速率,宜采用的措施有
(2)“浸取”中
 反应的离子方程式为
反应的离子方程式为(3)若将“还原”中发生的化合反应设计成原电池,则正极反应式为
(4)操作X包括蒸发浓缩、
 或
或 保护气氛中进行,其目的是
保护气氛中进行,其目的是(5)已知:常温下,
 ,
, 的电离常数
的电离常数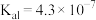 ,
, 。“沉铁”中
。“沉铁”中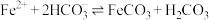 的平衡常数
的平衡常数 为
为(6)常温下,
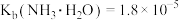 。
。 溶液呈弱碱性,其原因是
溶液呈弱碱性,其原因是(7)设计实验证明铁华粉中含
 ,宜选择的试剂是___________(填标号)。
,宜选择的试剂是___________(填标号)。A. 溶液 溶液 | B.酸性 溶液 溶液 |
C. 溶液 溶液 | D. 溶液 溶液 |
您最近半年使用:0次
解题方法
6 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。
(1) 和
和 必须经过净化才能进入合成塔,最主要的原因是
必须经过净化才能进入合成塔,最主要的原因是______________ 。
(2)简述氨分离器中,将氨从平衡混合物中分离出去的方法:______________ 。
(3)氧化炉中主要反应的化学方程式为______________ 。
(4)向吸收塔中通入 的作用是
的作用是______________ 。
(5)工业上常用碱液来进行尾气处理,有关的化学反应为
①
②
现有一定条件下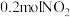 和
和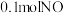 的混合气体恰好被
的混合气体恰好被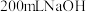 溶液完全吸收,则
溶液完全吸收,则 溶液的物质的量浓度为
溶液的物质的量浓度为_______  。
。
(6)实验室中硝酸一般盛放在棕色试剂瓶中,用化学方程式说明其原因:______________ 。
(7)利用下图所示装置进行铜与稀硝酸反应的实验可以观察到的实验现象为______________ 。
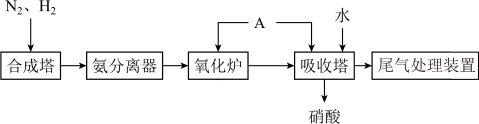
(1)
 和
和 必须经过净化才能进入合成塔,最主要的原因是
必须经过净化才能进入合成塔,最主要的原因是(2)简述氨分离器中,将氨从平衡混合物中分离出去的方法:
(3)氧化炉中主要反应的化学方程式为
(4)向吸收塔中通入
 的作用是
的作用是(5)工业上常用碱液来进行尾气处理,有关的化学反应为
①

②

现有一定条件下
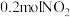 和
和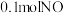 的混合气体恰好被
的混合气体恰好被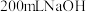 溶液完全吸收,则
溶液完全吸收,则 溶液的物质的量浓度为
溶液的物质的量浓度为 。
。(6)实验室中硝酸一般盛放在棕色试剂瓶中,用化学方程式说明其原因:
(7)利用下图所示装置进行铜与稀硝酸反应的实验可以观察到的实验现象为
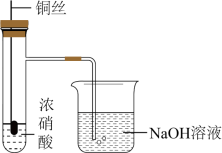
您最近半年使用:0次
解题方法
7 . 某品牌补血剂,主要成分是硫酸亚铁晶体( ),不含其它铁的化合物。
),不含其它铁的化合物。
某研究性学习小组为测定该补血剂中铁元素的含量,并检验其是否变质,进行了如下探究。
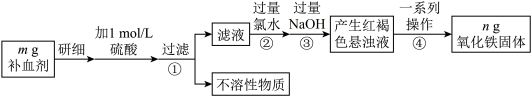
回答下列问题:
(1)实验中用浓硫酸配制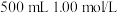 的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、
的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、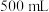 容量瓶外,还需要
容量瓶外,还需要___________ 。
(2)步骤②加入过量氯水发生反应的离子方程式为___________ 。
(3)步骤④中一系列操作为___________ 、洗涤、灼烧、___________ 、称量。
(4)若实验无损耗,则该补血剂含铁元素的质量分数为___________ (用含m、n的式子表示)。
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于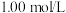 的硫酸溶液,过滤。
的硫酸溶液,过滤。
①取少量滤液滴加___________ (填化学式)溶液,溶液变红说明该补血剂已部分变质。
②检验滤液中是否含有 应选用的试剂是
应选用的试剂是___________ (填标号)。
a.酸性 溶液 b.铁粉 c.
溶液 b.铁粉 c. 溶液 d.硫酸溶液
溶液 d.硫酸溶液
(6)缺铁性贫血患者应补充 ,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是___________ 。
 ),不含其它铁的化合物。
),不含其它铁的化合物。某研究性学习小组为测定该补血剂中铁元素的含量,并检验其是否变质,进行了如下探究。

回答下列问题:
(1)实验中用浓硫酸配制
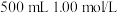 的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、
的硫酸溶液,配制时用到的玻璃仪器除量筒、烧杯、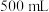 容量瓶外,还需要
容量瓶外,还需要(2)步骤②加入过量氯水发生反应的离子方程式为
(3)步骤④中一系列操作为
(4)若实验无损耗,则该补血剂含铁元素的质量分数为
(5)某同学发现部分补血剂药片表面发黄,取样品研细,溶于
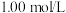 的硫酸溶液,过滤。
的硫酸溶液,过滤。①取少量滤液滴加
②检验滤液中是否含有
 应选用的试剂是
应选用的试剂是a.酸性
 溶液 b.铁粉 c.
溶液 b.铁粉 c. 溶液 d.硫酸溶液
溶液 d.硫酸溶液(6)缺铁性贫血患者应补充
 ,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
,通常以硫酸亚铁的形式补充,而硫酸铁无这种药效。当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是
您最近半年使用:0次
解题方法
8 . CrCl3是重要的化工试剂,用高铝铬铁矿(主要含Cr2O3和Al2O3,还含Fe2O3、FeO、MgO、SiO2)制取CrCl3的流程如下:
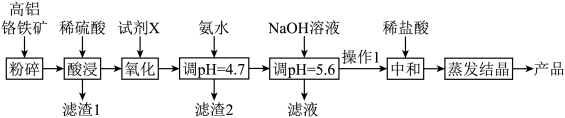
已知:①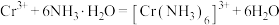
②相关金属离子在不同浓度下生成氢氧化物沉淀的 如图:
如图:
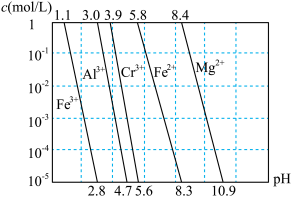
回答下列问题
(1)滤渣1主要成分是___________ ,滤渣2主要成分是___________ 。
(2)试剂X可选用___________ ,简述该流程设计添加X的好处与不好之处,好处是___________ ,不好之处是___________ 。
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是___________ 。
(4)蒸发结晶操作应在___________ 条件下进行
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:___________ 。

已知:①
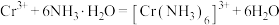
②相关金属离子在不同浓度下生成氢氧化物沉淀的
 如图:
如图:
回答下列问题
(1)滤渣1主要成分是
(2)试剂X可选用
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是
(4)蒸发结晶操作应在
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
9 . 某化学兴趣小组模拟侯氏制碱法进行实验,流程如图所示。下列说法正确的是
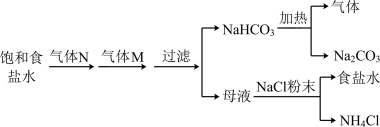

A.气体N,M分别为 和 和 |
B. 气体可以循环利用,因此工业生产时理论上不需要进行补充 气体可以循环利用,因此工业生产时理论上不需要进行补充 |
C.加入NaCl粉末的作用是增 ,促进 ,促进 结晶析出 结晶析出 |
| D.加入NaCl粉末后所得“食盐水”中溶质只有NaCl |
您最近半年使用:0次
名校
解题方法
10 . 五氧化二钒在工业生产中有重要用途。某含钒废料的成分为V2O5、V2O4、SiO2、Fe2O3、Al2O3,实验小组从其中回收V2O5的一种工艺流程如下:
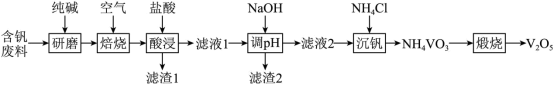
请回答下列问题:
(1)所加纯碱不宜过量太多,否则会造成后某工序中___________ 原料消耗过多。
(2)“酸浸”时,VO3-转化为VO ,转化反应的离子方程式为
,转化反应的离子方程式为___________ ;滤渣1的主要成分为___________ (填化学式)。
(3)已知:常温下,Al(OH)3、Fe(OH)3 饱和溶液中金属阳离子浓度的负对数[-lg c(M3+ )]与pH 的关系如图所示:
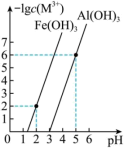
常温下,Ksp[Fe(OH)3]=___________ ;当调pH=4 时,溶液中A13+___________ (填“是”或“否”)沉淀完全。(已知;溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全)

请回答下列问题:
(1)所加纯碱不宜过量太多,否则会造成后某工序中
(2)“酸浸”时,VO3-转化为VO
 ,转化反应的离子方程式为
,转化反应的离子方程式为(3)已知:常温下,Al(OH)3、Fe(OH)3 饱和溶液中金属阳离子浓度的负对数[-lg c(M3+ )]与pH 的关系如图所示:

常温下,Ksp[Fe(OH)3]=
您最近半年使用:0次








