名校
解题方法
1 . 回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属的工艺路线如图: 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、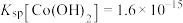 、
、 。
。
回答下列问题:
(1)写出一条提高焙烧效率的措施:_______ 。
(2)若烧渣是LiCl、 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:_______ 。
(3)简述洗涤滤饼3的操作:_______ 。
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①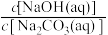
_______ (填“>”、“<”或“=”)1。
②三种溶液中由水电离出的 的浓度的关系是
的浓度的关系是_______ (用a、b、c表示)。
(5)Co2+完全沉淀时(溶液中离子浓度小于 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为_______ 。
(6)煅烧滤饼2时发生反应的化学方程式为_______ ,得到的 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为_______ 。

 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、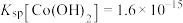 、
、 。
。回答下列问题:
(1)写出一条提高焙烧效率的措施:
(2)若烧渣是LiCl、
 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:(3)简述洗涤滤饼3的操作:
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①
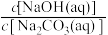
②三种溶液中由水电离出的
 的浓度的关系是
的浓度的关系是(5)Co2+完全沉淀时(溶液中离子浓度小于
 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为(6)煅烧滤饼2时发生反应的化学方程式为
 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为
您最近半年使用:0次
2023-12-12更新
|
132次组卷
|
3卷引用:河南省创新发展联盟2023-2024学年高二上学期第四次联考化学试题
名校
解题方法
2 . 氮化镓(GaN)是一种重要的半导体材料,研究氮化镓的团队获得第二届全国创新争先奖,某工厂利用铝土矿(成分为 、
、 、
、 等)为原料制备GaN的流程如下图所示:
等)为原料制备GaN的流程如下图所示:
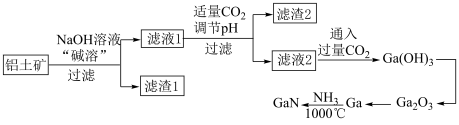
已知:镓与铝同主族,镓的熔点是29.8℃,沸点是2403℃;其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应。
回答下列问题:
(1)滤渣1的成分是___________ 。
(2)为了提高“碱溶”效率应采用的措施是___________ (回答两种措施)
(3)滤液2中通入过量的 反应的离子方程式是
反应的离子方程式是___________ 。
(4)流程中利用镓与 在1000℃反应生成固体半导体材料GaN,每生成1mol GaN时放出15.45kJ热量,写出该反应的热化学方程式
在1000℃反应生成固体半导体材料GaN,每生成1mol GaN时放出15.45kJ热量,写出该反应的热化学方程式___________ 。
(5)在密闭容器中,充入一定量的Ga与 发生反应,并放出热量,测得反应平衡体系中
发生反应,并放出热量,测得反应平衡体系中 的体积分数与压强P和温度T的关系曲线如图所示。
的体积分数与压强P和温度T的关系曲线如图所示。
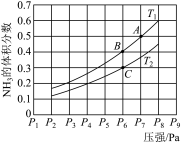
①分析温度 、
、 的大小关系:
的大小关系:
___________  (填写“>”、“<”、“=”),判断的依据是
(填写“>”、“<”、“=”),判断的依据是___________ 。
②分析A点和C点化学平衡常数的大小关系:Ka___________ Kc。
 、
、 、
、 等)为原料制备GaN的流程如下图所示:
等)为原料制备GaN的流程如下图所示:
已知:镓与铝同主族,镓的熔点是29.8℃,沸点是2403℃;其氧化物和氢氧化物均为两性化合物,能与强酸、强碱溶液反应。
回答下列问题:
(1)滤渣1的成分是
(2)为了提高“碱溶”效率应采用的措施是
(3)滤液2中通入过量的
 反应的离子方程式是
反应的离子方程式是(4)流程中利用镓与
 在1000℃反应生成固体半导体材料GaN,每生成1mol GaN时放出15.45kJ热量,写出该反应的热化学方程式
在1000℃反应生成固体半导体材料GaN,每生成1mol GaN时放出15.45kJ热量,写出该反应的热化学方程式(5)在密闭容器中,充入一定量的Ga与
 发生反应,并放出热量,测得反应平衡体系中
发生反应,并放出热量,测得反应平衡体系中 的体积分数与压强P和温度T的关系曲线如图所示。
的体积分数与压强P和温度T的关系曲线如图所示。
①分析温度
 、
、 的大小关系:
的大小关系:
 (填写“>”、“<”、“=”),判断的依据是
(填写“>”、“<”、“=”),判断的依据是②分析A点和C点化学平衡常数的大小关系:Ka
您最近半年使用:0次
名校
解题方法
3 . MnO2是一种两性氧化物,用软锰矿(主要成分为MnO2,含少量铁的氧化物)和BaS可制备高纯MnCO3。
(1)基态锰原子的电子排布式为___________ ,其最高能层电子云轮廓图为___________ 形。
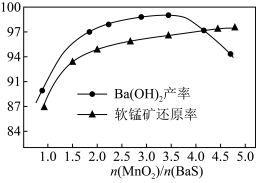
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图所示。当 ,Ba(OH)2产率减小的原因是
,Ba(OH)2产率减小的原因是___________ 。
(3)充分反应后过滤,滤液经过___________ 可获得Ba(OH)2·8H2O晶体。
(4)反应后的滤渣中还含有S和未反应的MnO2.以此滤渣为原料制备高纯度的MnCO3的流程如图。
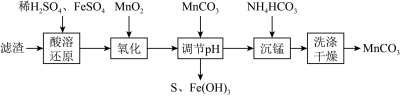
①酸溶还原时,MnO2发生反应的离子方程式___________ 。
②MnSO4溶液和NH4HCO3溶液混合后,反应生成MnCO3.反应的离子方程式为___________ 。实际制取MnCO3时,一般选择使用氨水—NH4HCO3混合溶液代替NH4HCO3溶液,这样改进的优点是___________ 。
③以上制备是在常温下进行,此时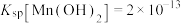 、
、 。工业上,当某离子浓度小于1×10-6mol·L-1时,认为该离子已除净,氧化后所得溶液中,
。工业上,当某离子浓度小于1×10-6mol·L-1时,认为该离子已除净,氧化后所得溶液中,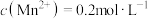 为使溶液中Fe3+除净,调节pH的范围应为
为使溶液中Fe3+除净,调节pH的范围应为___________ 。
(1)基态锰原子的电子排布式为
(2)保持BaS投料量不变,随MnO2与BaS投料比增大,软锰矿还原率和氢氧化钡的产率的变化如图所示。当
 ,Ba(OH)2产率减小的原因是
,Ba(OH)2产率减小的原因是
(3)充分反应后过滤,滤液经过
(4)反应后的滤渣中还含有S和未反应的MnO2.以此滤渣为原料制备高纯度的MnCO3的流程如图。

①酸溶还原时,MnO2发生反应的离子方程式
②MnSO4溶液和NH4HCO3溶液混合后,反应生成MnCO3.反应的离子方程式为
③以上制备是在常温下进行,此时
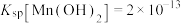 、
、 。工业上,当某离子浓度小于1×10-6mol·L-1时,认为该离子已除净,氧化后所得溶液中,
。工业上,当某离子浓度小于1×10-6mol·L-1时,认为该离子已除净,氧化后所得溶液中,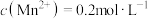 为使溶液中Fe3+除净,调节pH的范围应为
为使溶液中Fe3+除净,调节pH的范围应为
您最近半年使用:0次
名校
解题方法
4 . 电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
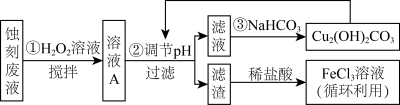
已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以___________ (任写一点)
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要___________
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为___________ 。
(4)FeCl3蚀刻液中加入盐酸的目的是___________ 。
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)___________ 。
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是___________ 。
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是___________ 。

已知: Fe3+在溶液中会发生水解,当溶液呈酸性时可以抑制其水解
(1)步骤①中,为加快反应速率,除搅拌外,还可以
(2)步骤②过滤中,用到的玻璃仪器,除烧杯外,还需要
(3)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为
(4)FeCl3蚀刻液中加入盐酸的目的是
(5)步骤①中加入H2O2溶液的目的是(用离子方程式表示)
(6)生成氢氧化物沉淀的pH如下表根据表中数据推测调节pH的范围是
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(7)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是
您最近半年使用:0次
名校
解题方法
5 . LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3,含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如图:
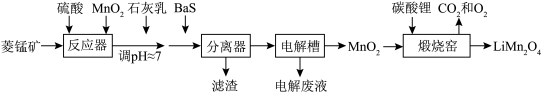
已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为___________ ,硫酸不能太浓且反应温度不宜太高,原因是___________ 。
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式___________ ,不用双氧水氧化亚铁离子的原因是___________ 。
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是___________ ,通过列式计算说明理由___________ (离子浓度小于10-5mol/L即可认为完全沉淀)。
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有___________ 。
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是___________ 。

已知:①Ksp[Fe(OH)3]=2.8×10-39,Ksp[Al(OH)3]=1.0×10-32,Ksp[Ni(OH)2]=5.5×10-16。
②已知亚铁离子沉淀的pH范围是8~9之间
回答下列问题:
(1)硫酸溶矿主要反应的化学方程式为
(2)加入少量二氧化锰的作用是把亚铁离子氧化成正三价铁离子,写出该反应的离子方程式
(3)溶矿反应完成后,调pH≈7,可完全沉淀的离子是
(4)加入少量BaS溶液除去Ni2+,生成的沉淀有
(5)煅烧窑中,生成LiMn2O4反应的化学方程式是
您最近半年使用:0次
名校
解题方法
6 . 从某冶锌工厂的工业废料[除ZnO和少量Fe2O3外,还含有铟(In)、铋(Bi)、锗(Ge)的氧化物]中回收几种金属的单质或化合物的工业流程如图:

已知:该工艺条件下,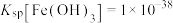 ,
,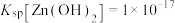 。
。
请回答下列问题:
(1)下列措施更有利于完成“酸浸l”目的,提高“酸浸l”浸取率的是___________ (填选项字母)。
a.适当升高温度 b.酸浸过程中不断搅拌
c.将硫酸浓度增大到70% d.加大废料的用量
(2)“酸浸2”时铋的氧化物( )发生反应的离子方程式为
)发生反应的离子方程式为___________ 。
(3)“沉锗”的反应原理为 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是___________ 。
(4)①氧化锌有多种晶体结构,其中一种晶胞结构与六方硫化锌的晶胞结构相同,其晶胞如图所示。 位于
位于 构成的
构成的___________ (填“四面体空隙”“六面体空隙”或“八面体空隙”)中,氧化锌的熔点高于硫化锌,原因是___________ 。

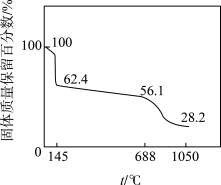
②加热 固体,固体质量保留百分数与温度的关系如图所示。温度从681℃升高到1050℃时,分解生成的产物中,有两种为气体(只有一种是氧化物),该反应的化学方程式为
固体,固体质量保留百分数与温度的关系如图所示。温度从681℃升高到1050℃时,分解生成的产物中,有两种为气体(只有一种是氧化物),该反应的化学方程式为___________ 。

已知:该工艺条件下,
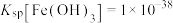 ,
,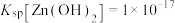 。
。请回答下列问题:
(1)下列措施更有利于完成“酸浸l”目的,提高“酸浸l”浸取率的是
a.适当升高温度 b.酸浸过程中不断搅拌
c.将硫酸浓度增大到70% d.加大废料的用量
(2)“酸浸2”时铋的氧化物(
 )发生反应的离子方程式为
)发生反应的离子方程式为(3)“沉锗”的反应原理为
 ,该操作中需调节pH为2.5,不能过高或过低,原因是
,该操作中需调节pH为2.5,不能过高或过低,原因是(4)①氧化锌有多种晶体结构,其中一种晶胞结构与六方硫化锌的晶胞结构相同,其晶胞如图所示。
 位于
位于 构成的
构成的
②加热
 固体,固体质量保留百分数与温度的关系如图所示。温度从681℃升高到1050℃时,分解生成的产物中,有两种为气体(只有一种是氧化物),该反应的化学方程式为
固体,固体质量保留百分数与温度的关系如图所示。温度从681℃升高到1050℃时,分解生成的产物中,有两种为气体(只有一种是氧化物),该反应的化学方程式为
您最近半年使用:0次
名校
解题方法
7 . 以软锰矿(主要成分为 ,还含有少量的
,还含有少量的 、FeO、
、FeO、 和
和 )为原料制备马日夫盐[
)为原料制备马日夫盐[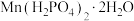 (磷酸二氢锰)]的主要流程如下:
(磷酸二氢锰)]的主要流程如下:
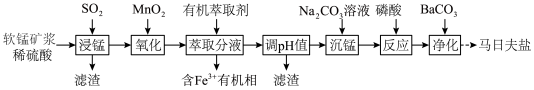
(1) “氧化”时反应的离子方程式
“氧化”时反应的离子方程式___________ 。
(2)如何检验“沉锰”已完成___________ 。
(3)加入 除
除 ,需控制温度在70~80℃,应采取的加热方式为
,需控制温度在70~80℃,应采取的加热方式为___________ 。
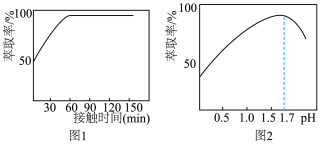
(4)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1和图2所示,则应选择的接触时间为___________ ; ,铁离子的萃取率急剧下降的原因可能为
,铁离子的萃取率急剧下降的原因可能为___________ 。
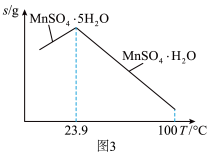
(5)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备 的实验方案:边搅拌边先向溶液中滴加
的实验方案:边搅拌边先向溶液中滴加___________ ,再向滤液中加入___________ 粉末调节溶液的pH___________ ,过滤、洗涤,将滤液与洗涤液合并;控制温度在80~90℃蒸发结晶,趁热过滤,得到 ,用
,用___________ 的蒸馏水洗涤2~3次,放在___________ 中低温干燥。
(实验中须使用的试剂:双氧水、 粉末、80~90℃的蒸馏水;除常用仪器外须使用的仪器:真空干燥箱)[已知该溶液中
粉末、80~90℃的蒸馏水;除常用仪器外须使用的仪器:真空干燥箱)[已知该溶液中 时
时 开始沉淀:
开始沉淀: 时
时 、
、 沉淀完全;
沉淀完全; 时
时 沉淀完全]。
沉淀完全]。
 ,还含有少量的
,还含有少量的 、FeO、
、FeO、 和
和 )为原料制备马日夫盐[
)为原料制备马日夫盐[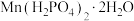 (磷酸二氢锰)]的主要流程如下:
(磷酸二氢锰)]的主要流程如下:
(1)
 “氧化”时反应的离子方程式
“氧化”时反应的离子方程式(2)如何检验“沉锰”已完成
(3)加入
 除
除 ,需控制温度在70~80℃,应采取的加热方式为
,需控制温度在70~80℃,应采取的加热方式为(4)铁离子的萃取率与接触时间和溶液的pH之间的关系如图1和图2所示,则应选择的接触时间为
 ,铁离子的萃取率急剧下降的原因可能为
,铁离子的萃取率急剧下降的原因可能为
(5)结合图3的溶解度曲线,请补充完整由浸锰得到的溶液制备
 的实验方案:边搅拌边先向溶液中滴加
的实验方案:边搅拌边先向溶液中滴加 ,用
,用
(实验中须使用的试剂:双氧水、
 粉末、80~90℃的蒸馏水;除常用仪器外须使用的仪器:真空干燥箱)[已知该溶液中
粉末、80~90℃的蒸馏水;除常用仪器外须使用的仪器:真空干燥箱)[已知该溶液中 时
时 开始沉淀:
开始沉淀: 时
时 、
、 沉淀完全;
沉淀完全; 时
时 沉淀完全]。
沉淀完全]。
您最近半年使用:0次
名校
解题方法
8 . I.一种由菱镁矿(主要成分 、还含少量
、还含少量 及
及 )制备高纯氧化镁的工艺如下:
)制备高纯氧化镁的工艺如下:
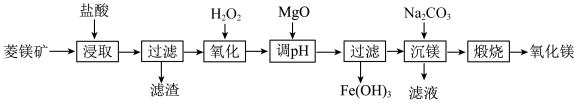
(1)“浸取”时加入盐酸需过量,原因是___________ 和___________ 。
(2)“调pH”时控制溶液的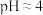 。“调pH”时发生反应的离子方程式为
。“调pH”时发生反应的离子方程式为___________ 。
(3)“沉镁”时,溶液中有 和
和 析出。若此时溶液的
析出。若此时溶液的 ,则“沉镁”所得溶液中
,则“沉镁”所得溶液中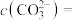
_______  。(已知
。(已知 ,
,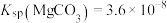 )
)
Ⅱ.
(4)一种以 溶液为原料制取氧化铁黄(FeOOH)的路线如下:
溶液为原料制取氧化铁黄(FeOOH)的路线如下:
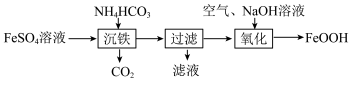
①“沉铁”时有 沉淀生成,该反应的化学方程式为
沉淀生成,该反应的化学方程式为___________ 。
②“氧化”反应的离子方程式为___________ 。
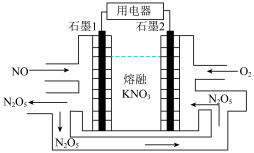
(5)一种以NO、 和熔融
和熔融 制成的燃料电池,其工作原理如图所示。该电池放电时的正极反应方程式为:
制成的燃料电池,其工作原理如图所示。该电池放电时的正极反应方程式为:___________ 。
 、还含少量
、还含少量 及
及 )制备高纯氧化镁的工艺如下:
)制备高纯氧化镁的工艺如下:
(1)“浸取”时加入盐酸需过量,原因是
(2)“调pH”时控制溶液的
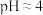 。“调pH”时发生反应的离子方程式为
。“调pH”时发生反应的离子方程式为(3)“沉镁”时,溶液中有
 和
和 析出。若此时溶液的
析出。若此时溶液的 ,则“沉镁”所得溶液中
,则“沉镁”所得溶液中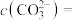
 。(已知
。(已知 ,
,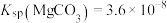 )
)Ⅱ.
(4)一种以
 溶液为原料制取氧化铁黄(FeOOH)的路线如下:
溶液为原料制取氧化铁黄(FeOOH)的路线如下:
①“沉铁”时有
 沉淀生成,该反应的化学方程式为
沉淀生成,该反应的化学方程式为②“氧化”反应的离子方程式为
(5)一种以NO、
 和熔融
和熔融 制成的燃料电池,其工作原理如图所示。该电池放电时的正极反应方程式为:
制成的燃料电池,其工作原理如图所示。该电池放电时的正极反应方程式为:
您最近半年使用:0次
名校
9 . 硫铁矿(含 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
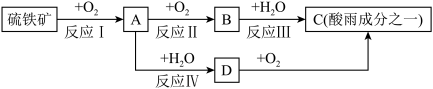
回答下列问题:
(1)硫铁矿 中硫元素化合价为
中硫元素化合价为_______ 。
(2)为了确定A中S元素的化合价,将其通入酸性高锰酸钾溶液中,发现溶液褪色,请写出该过程的离子方程式_______ 。
(3)已知反应Ⅲ是放热反应,该反应也是工业制硫酸的主要步骤之一,但在实际工业生产中常用98.3%的浓硫酸代替水来吸收B气体,其目的是_______ 。
(4)利用氧化亚铁硫杆菌 对硫铁矿进行催化脱硫的过程如下图所示:
对硫铁矿进行催化脱硫的过程如下图所示:
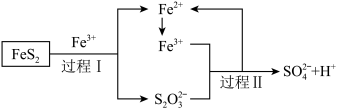
已知催化脱硫过程的总反应为: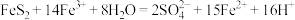
①则过程Ⅱ反应的离子方程式为_______ 。
②脱硫过程中产生的 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是_______ (用离子方程式表示)。
③该催化过程中,要控制反应温度不能过高,原因是_______ 。
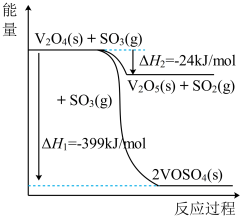
(5)接触法制硫酸生产中的关键工序是 的催化氧化:
的催化氧化: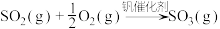
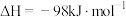 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,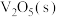 与
与 反应生成
反应生成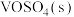 和
和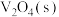 的热化学方程式为:
的热化学方程式为:_______ 。
 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
回答下列问题:
(1)硫铁矿
 中硫元素化合价为
中硫元素化合价为(2)为了确定A中S元素的化合价,将其通入酸性高锰酸钾溶液中,发现溶液褪色,请写出该过程的离子方程式
(3)已知反应Ⅲ是放热反应,该反应也是工业制硫酸的主要步骤之一,但在实际工业生产中常用98.3%的浓硫酸代替水来吸收B气体,其目的是
(4)利用氧化亚铁硫杆菌
 对硫铁矿进行催化脱硫的过程如下图所示:
对硫铁矿进行催化脱硫的过程如下图所示:
已知催化脱硫过程的总反应为:
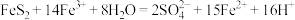
①则过程Ⅱ反应的离子方程式为
②脱硫过程中产生的
 在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是
在酸性溶液中会形成黄色沉淀和一种能使品红溶液褪色的气体,其原因可能是③该催化过程中,要控制反应温度不能过高,原因是
(5)接触法制硫酸生产中的关键工序是
 的催化氧化:
的催化氧化: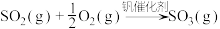
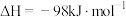 。钒催化剂参与反应的能量变化如图所示,
。钒催化剂参与反应的能量变化如图所示,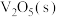 与
与 反应生成
反应生成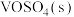 和
和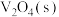 的热化学方程式为:
的热化学方程式为:
您最近半年使用:0次
解题方法
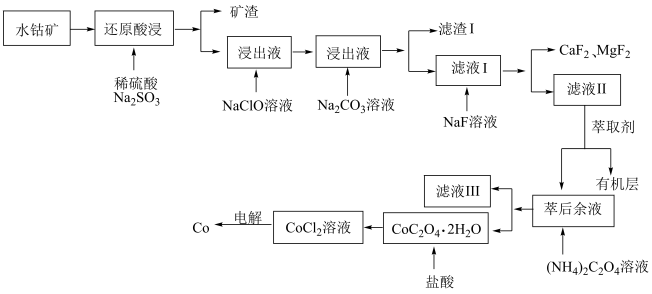
10 . 钴是生产多种合金和钴盐的重要原料,水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:
已知:①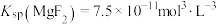 ;
;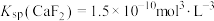
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
请回答下列问题:
(1)CoOOH中Co的化合价为_____ , 溶液的作用是
溶液的作用是______ ,请写出“还原酸浸”中发生的主要氧化还原反应的化学方程式:______ 。
(2)浸出过程中加入 溶液调pH的范围是
溶液调pH的范围是______ ≤pH<______
(3)当加入过量NaF后,所得滤液Ⅱ中 与
与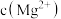 之比为
之比为______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是______ ,其使用的最佳pH范围是______ (填字母代号)。
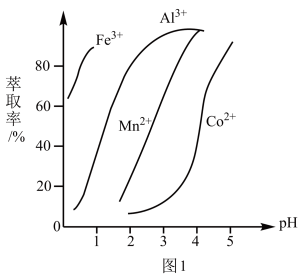
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
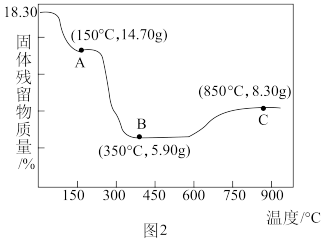
(5)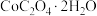 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______ 。

已知:①
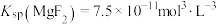 ;
;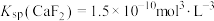
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)CoOOH中Co的化合价为
 溶液的作用是
溶液的作用是(2)浸出过程中加入
 溶液调pH的范围是
溶液调pH的范围是(3)当加入过量NaF后,所得滤液Ⅱ中
 与
与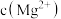 之比为
之比为(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是

a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)
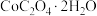 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
您最近半年使用:0次
2023-12-05更新
|
106次组卷
|
2卷引用:黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题








