解题方法
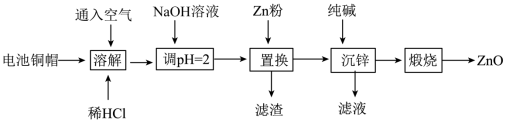
1 . 实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的实验流程如下:___________ 。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是___________ 。
(3)用NaOH溶液调节pH=2的目的是___________ 。
(4)滤渣中的主要物质是___________ (填化学式)。
(5)“沉锌”时生成碱式碳酸锌[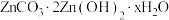 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。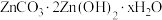 中x的值为
中x的值为___________ (写出计算过程)。
(2)“溶解”可适当升高温度以加快反应速率,但温度不宜过高。温度不宜过高的原因是
(3)用NaOH溶液调节pH=2的目的是
(4)滤渣中的主要物质是
(5)“沉锌”时生成碱式碳酸锌[
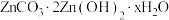 ],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知:
],碱式碳酸锌在空气中加热可转化为ZnO,过程中固体质量随温度的变化关系如下图所示。已知: 加热至125℃、
加热至125℃、 加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与
加热至350℃均分解成ZnO,该碱式碳酸锌失去结晶水的温度与 的分解温度接近。
的分解温度接近。
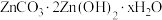 中x的值为
中x的值为
您最近半年使用:0次
名校
解题方法
2 . 用镍铂合金废料(主要成分为 ,含少量
,含少量 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图: 的原子序数为78,推测其在元素周期表中的位置
的原子序数为78,推测其在元素周期表中的位置___________ 。
(2)含 滤渣(除
滤渣(除 外)的成分为
外)的成分为___________ 。
(3)用王水浸取“含 滤渣”可回收
滤渣”可回收 ,浸取时有
,浸取时有 和
和 生成,写出该反应的化学方程式
生成,写出该反应的化学方程式___________ 。
(4)在常温下,若酸浸后溶液中各离子浓度均为 且“滤渣1”为
且“滤渣1”为 ,则“除钴”步骤需要控制溶液的
,则“除钴”步骤需要控制溶液的 范围是
范围是___________ 。已知: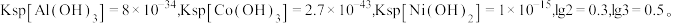
(5)加 调
调 的目的是
的目的是___________ 。
(6)“控温氧化”时控制其他条件一定, 的产率与温度和时间的关系如图。
的产率与温度和时间的关系如图。___________ 。
② 、
、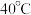 时反应后所得滤液主要为
时反应后所得滤液主要为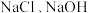 和
和 时反应后所得滤液主要为
时反应后所得滤液主要为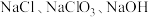 和
和 。反应相同时间,
。反应相同时间,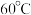 时
时 的产率低于
的产率低于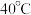 时,原因可能为
时,原因可能为___________ 。
(7) 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取
的纯度,进行如下实验:称取 样品,加入足量硫酸后,再加入
样品,加入足量硫酸后,再加入 标准溶液充分反应,加水定容至
标准溶液充分反应,加水定容至 取出
取出 ,用
,用 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液
标准溶液 。(
。( 被
被 还原为
还原为 ,不考虑
,不考虑 与
与 的反应),计算
的反应),计算 的质量分数
的质量分数___________ 。
 ,含少量
,含少量 )回收镍和铂,其工艺流程如图:
)回收镍和铂,其工艺流程如图: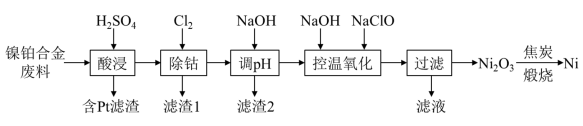
 的原子序数为78,推测其在元素周期表中的位置
的原子序数为78,推测其在元素周期表中的位置(2)含
 滤渣(除
滤渣(除 外)的成分为
外)的成分为(3)用王水浸取“含
 滤渣”可回收
滤渣”可回收 ,浸取时有
,浸取时有 和
和 生成,写出该反应的化学方程式
生成,写出该反应的化学方程式(4)在常温下,若酸浸后溶液中各离子浓度均为
 且“滤渣1”为
且“滤渣1”为 ,则“除钴”步骤需要控制溶液的
,则“除钴”步骤需要控制溶液的 范围是
范围是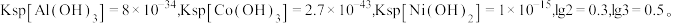
(5)加
 调
调 的目的是
的目的是(6)“控温氧化”时控制其他条件一定,
 的产率与温度和时间的关系如图。
的产率与温度和时间的关系如图。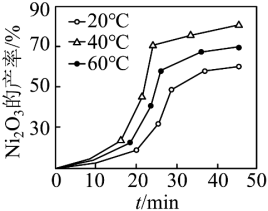
②
 、
、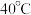 时反应后所得滤液主要为
时反应后所得滤液主要为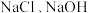 和
和 时反应后所得滤液主要为
时反应后所得滤液主要为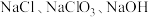 和
和 。反应相同时间,
。反应相同时间,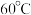 时
时 的产率低于
的产率低于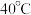 时,原因可能为
时,原因可能为(7)
 产品中可能含少量
产品中可能含少量 ,为测定
,为测定 的纯度,进行如下实验:称取
的纯度,进行如下实验:称取 样品,加入足量硫酸后,再加入
样品,加入足量硫酸后,再加入 标准溶液充分反应,加水定容至
标准溶液充分反应,加水定容至 取出
取出 ,用
,用 标准溶液滴定,到达滴定终点时消耗
标准溶液滴定,到达滴定终点时消耗 标准溶液
标准溶液 。(
。( 被
被 还原为
还原为 ,不考虑
,不考虑 与
与 的反应),计算
的反应),计算 的质量分数
的质量分数
您最近半年使用:0次
解题方法
3 . 钛酸钡( )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: 如下表所示。
如下表所示。
注: 。
。
回答下列问题:
(1)浸渣的主要成分是_____ (填化学式)。
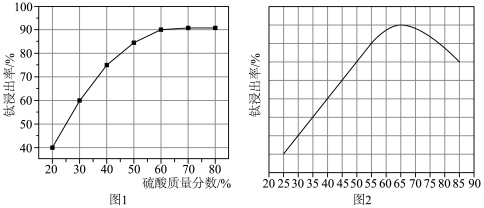
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。_____ 。图2中温度高于65℃,钛浸出率降低的原因可能是_____ 。
(3)“还原”时,主要反应的离子方程式为_____ ,检验“还原”后溶液中是否含 的试剂是
的试剂是_____ (填化学式)。
(4)“沉钛”中,先加入过量 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生_____ (填化学式)杂质,影响产率。“调 ”范围为
”范围为_____ 。
(5)“氧化焙烧”发生反应的化学方程式为_____ 。工业上,还可以直接将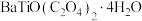 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是_____ 。
 )可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是
)可以作为防火涂料的添加剂,可提高涂层的防火性能和抗化学腐蚀性。以钛渣(主要成分是 ,含少量
,含少量 、
、 、
、 等)为原料制备钛酸钡的流程如下:
等)为原料制备钛酸钡的流程如下: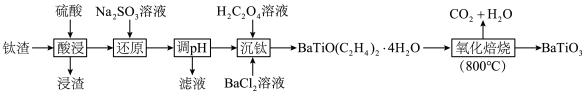
 如下表所示。
如下表所示。| 金属离子 |  |  |  |
开始沉淀/ | 1.5 | 6.3 | 0.5 |
完全沉淀/ | 2.8 | 8.3 | 2.5 |
 。
。回答下列问题:
(1)浸渣的主要成分是
(2)“酸浸”中,其他条件相同,1h内钛浸出率与硫酸的质量分数、温度关系如图1所示。
(3)“还原”时,主要反应的离子方程式为
 的试剂是
的试剂是(4)“沉钛”中,先加入过量
 溶液,后加入适量
溶液,后加入适量 溶液,如果加试剂顺序颠倒,会产生
溶液,如果加试剂顺序颠倒,会产生 ”范围为
”范围为(5)“氧化焙烧”发生反应的化学方程式为
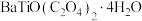 在1500℃、无氧环境下反应24h制备
在1500℃、无氧环境下反应24h制备 ,该方法的缺点是
,该方法的缺点是
您最近半年使用:0次
解题方法
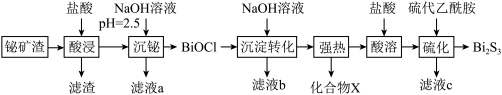
4 . 硫化铋(Bi2S3)广泛应用于太阳能电池、光电二极管及红外光谱学等。以铋矿渣(含Bi2O3、Fe2O3、CuO、Ag2O、Al2O3等)为原料制备Bi2S3的一种工艺流程如下。
②该工艺条件下,部分金属离子形成氢氧化物沉淀的pH如下表:
③常温下,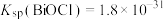 、
、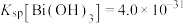 。
。
请回答下列问题:
(1)提高“酸浸”反应速率的措施是___________ (任答1条);“酸浸”中,形成“滤渣”的主要反应的离子方程式是___________ 。
(2)“滤液a”中主要的金属阳离有Fe3+、Cu2+___________ 。
(3)“沉铋”后所得BiOCl固体中含 杂质,设计实验去除BiOCl固体中含有的
杂质,设计实验去除BiOCl固体中含有的 杂质:
杂质:___________ 。
(4)“酸溶”时需加入过量的盐酸,盐酸过量的目的是___________ 、___________ 。
(5)已知常温时,BiOCl在水溶液中存在平衡: ,该反应的平衡常数为K,达到平衡时测得溶液pH=13,
,该反应的平衡常数为K,达到平衡时测得溶液pH=13,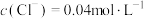 ,则K=
,则K=___________ 。
(6)化合物X的VSEPR模型是___________ 。
(7)已知 (硫代乙酰胺)
(硫代乙酰胺)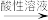
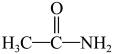 (乙酰胺)+H2S,则“硫化”的离子方程式为
(乙酰胺)+H2S,则“硫化”的离子方程式为___________ 。
②该工艺条件下,部分金属离子形成氢氧化物沉淀的pH如下表:
| 离子 | Fe3+ | Al3+ | Cu2+ |
| 开始沉淀时的pH | 1.5 | 3.6 | 4.5 |
| 沉淀完全时的pH | 3.2 | 4.7 | 6.7 |
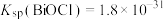 、
、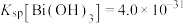 。
。请回答下列问题:
(1)提高“酸浸”反应速率的措施是
(2)“滤液a”中主要的金属阳离有Fe3+、Cu2+
(3)“沉铋”后所得BiOCl固体中含
 杂质,设计实验去除BiOCl固体中含有的
杂质,设计实验去除BiOCl固体中含有的 杂质:
杂质:(4)“酸溶”时需加入过量的盐酸,盐酸过量的目的是
(5)已知常温时,BiOCl在水溶液中存在平衡:
 ,该反应的平衡常数为K,达到平衡时测得溶液pH=13,
,该反应的平衡常数为K,达到平衡时测得溶液pH=13,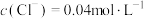 ,则K=
,则K=(6)化合物X的VSEPR模型是
(7)已知
 (硫代乙酰胺)
(硫代乙酰胺)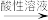
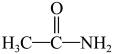 (乙酰胺)+H2S,则“硫化”的离子方程式为
(乙酰胺)+H2S,则“硫化”的离子方程式为
您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
5 . 废旧铅蓄电池的铅膏中主要含有 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一定条件下,一些金属氢氧化物沉淀时的 如下表:
如下表:
回答下列问题:
(1)在“脱硫”中 转化反应的离子方程式为
转化反应的离子方程式为________ ,用沉淀溶解平衡原理解释选择 的原因
的原因________ 。
(2)在“脱硫”中,加入 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是________ 。
(3)在“酸浸”中,除加入醋酸( ),还要加入
),还要加入 。
。
(ⅰ)能被 氧化的离子是
氧化的离子是________ ;
(ⅱ) 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为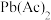 ,其化学方程式为
,其化学方程式为________ ;
(ⅲ) 也能使
也能使 转化为
转化为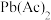 ,
, 的作用是
的作用是________ 。
 、
、 、
、 和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。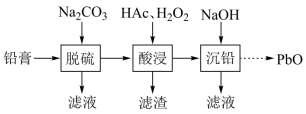
| 难溶电解质 |  |  |  |  |
 | 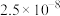 | 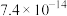 | 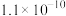 |  |
 如下表:
如下表:| 金属氢氧化物 |  |  |  | 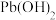 |
| 开始沉淀的pH | 2.3 | 6.8 | 3.5 | 7.2 |
| 完全沉淀的pH | 3.2 | 8.3 | 4.6 | 9.1 |
(1)在“脱硫”中
 转化反应的离子方程式为
转化反应的离子方程式为 的原因
的原因(2)在“脱硫”中,加入
 不能使铅膏中
不能使铅膏中 完全转化,原因是
完全转化,原因是(3)在“酸浸”中,除加入醋酸(
 ),还要加入
),还要加入 。
。(ⅰ)能被
 氧化的离子是
氧化的离子是(ⅱ)
 促进了金属Pb在醋酸中转化为
促进了金属Pb在醋酸中转化为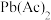 ,其化学方程式为
,其化学方程式为(ⅲ)
 也能使
也能使 转化为
转化为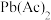 ,
, 的作用是
的作用是
您最近半年使用:0次
解题方法
6 . 氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色等。工业上常用辉铋矿(主要成分是 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。 在
在 时开始水解,
时开始水解,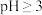 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;
②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为___________ 。
(2)“浸渣”的主要成分是S和___________ ,“浸取”时生成S的离子方程式为___________ 。
(3)“充分搅拌”时加入盐酸羟胺的目的是___________ 。
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为___________ ,发生反应的化学方程式为___________ 。
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是___________ 。
(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,还含有少量
,还含有少量 、铁的氧化物等杂质)为原料制备氯氧化铋。
、铁的氧化物等杂质)为原料制备氯氧化铋。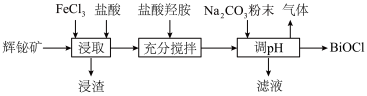
 在
在 时开始水解,
时开始水解,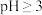 时几乎完全水解为白色的BiOCl沉淀;
时几乎完全水解为白色的BiOCl沉淀;②该工艺下,有关金属离子开始沉淀和沉淀完全的pH见下表。
| 金属离子 |  |  |
| 开始沉淀的pH | 1.9 | 7.2 |
| 沉淀完全的pH | 2.9 | 8.2 |
(1)铋与氮同主族,且位于元素周期表的第六周期,基态Bi的价电子排布式为
(2)“浸渣”的主要成分是S和
(3)“充分搅拌”时加入盐酸羟胺的目的是
(4)加入碳酸钠粉末制取BiOCl时,溶液pH值需控制的合理范围为
(5)氯氧化铋(BiOCl)可用作钾离子电池(有机物作离子导体)的负极材料,充电时嵌入
 ,BiOCl被还原为Bi,则阴极的电极反应式是
,BiOCl被还原为Bi,则阴极的电极反应式是(6)铋的一种氧化物的立方晶胞结构如图所示,已知最近的两个铋离子之间的距离为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。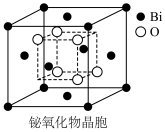
您最近半年使用:0次
2024-04-18更新
|
311次组卷
|
3卷引用:广西壮族自治区柳州市2024届高三第三次模拟考试化学试题
广西壮族自治区柳州市2024届高三第三次模拟考试化学试题广西柳州市2024届高三下学期第三次模拟考试(三模)化学试题(已下线)题型10 工艺流程题(25题)-2024年高考化学常考点必杀300题(新高考通用)
解题方法
7 . 某制酸工厂产生的废酸液主要成分为HF、 、
、 、
、 、
、 ,一种处理工艺如下:
,一种处理工艺如下: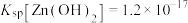
回答下列问题:
(1)基态As原子的价层电子排布图为__________________ ,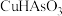 中As的化合价为
中As的化合价为_________ 。
(2)原废水中含有的 浓度为52.0
浓度为52.0 ,则
,则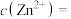
_____  ,常温下,有B离子的去除量、“调pH”为6.0后,
,常温下,有B离子的去除量、“调pH”为6.0后, 的去除率为
的去除率为_______ 。(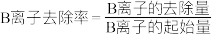 )
)
(3)强碱(AOH)的化学式为_____________ 。
(4)写出“还原”过程中 发生反应的化学方程式
发生反应的化学方程式_______________ 。
(5)产品结构分析。晶体W的晶胞结构如图所示:__________ 。
②W的化学式为_____________ 。
(6)产品纯度分析。称取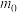 g
g  样品,用碱溶解,加入淀粉作指示剂,用浓度为
样品,用碱溶解,加入淀粉作指示剂,用浓度为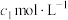 的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为
的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为 mL,则制得的产品纯度为
mL,则制得的产品纯度为___________ 。(用含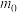 、
、 、
、 的代数式表示)
的代数式表示)
 、
、 、
、 、
、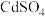 ,一种处理工艺如下:
,一种处理工艺如下: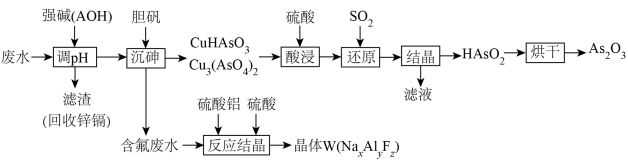
回答下列问题:
(1)基态As原子的价层电子排布图为
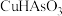 中As的化合价为
中As的化合价为(2)原废水中含有的
 浓度为52.0
浓度为52.0 ,则
,则
 ,常温下,有B离子的去除量、“调pH”为6.0后,
,常温下,有B离子的去除量、“调pH”为6.0后, 的去除率为
的去除率为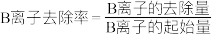 )
)(3)强碱(AOH)的化学式为
(4)写出“还原”过程中
 发生反应的化学方程式
发生反应的化学方程式(5)产品结构分析。晶体W的晶胞结构如图所示:

②W的化学式为
(6)产品纯度分析。称取
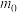 g
g  样品,用碱溶解,加入淀粉作指示剂,用浓度为
样品,用碱溶解,加入淀粉作指示剂,用浓度为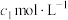 的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为
的碘标准溶液滴定As(Ⅲ)至As(Ⅴ),消耗体积为 mL,则制得的产品纯度为
mL,则制得的产品纯度为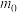 、
、 、
、 的代数式表示)
的代数式表示)
您最近半年使用:0次
名校
解题方法
8 . 以软锰矿(主要含 ,还含有
,还含有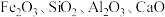 和
和 等)为原料经过下列过程可以制得
等)为原料经过下列过程可以制得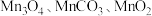 等。
等。
I.酸浸、还原:
(1)向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有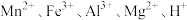 和
和 。写出酸浸、还原过程中
。写出酸浸、还原过程中 发生反应的离子方程式:
发生反应的离子方程式:____________________ 。 的外围电子轨道表示式为:
的外围电子轨道表示式为:__________ , 的空间构型为
的空间构型为__________ 。
Ⅱ.除杂:向酸浸、还原所得滤液中加入 固体,调节溶液的
固体,调节溶液的 ,过滤。向已经除去
,过滤。向已经除去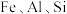 的
的 溶液(
溶液( 约为5)中加入
约为5)中加入 溶液,溶液中的
溶液,溶液中的 形成氟化物沉淀。
形成氟化物沉淀。
Ⅲ.沉锰:向调 后所得滤液中加入一定量的氨水,可以得到
后所得滤液中加入一定量的氨水,可以得到 沉淀。
沉淀。 后,溶液温度越高,锰离子的沉淀率越低的原因是
后,溶液温度越高,锰离子的沉淀率越低的原因是____________________ 。
②沉锰过程中溶液中存在平衡: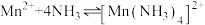 ,
, 中含有的
中含有的 键数为
键数为__________ 。
Ⅳ.氧化:向沉锰所得 中加入
中加入 溶液,可以得到
溶液,可以得到 。
。
Ⅴ.制备。
(3)在搅拌下 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体,该过程发生的离子方程式为
固体,该过程发生的离子方程式为____________________ 。
Ⅵ.制备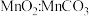 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备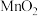 。
。
(4) 溶液中加入
溶液中加入 后立即产生大量气泡,经检测反应过程中有
后立即产生大量气泡,经检测反应过程中有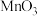 生成,反应前后
生成,反应前后 的质量、化学性质保持不变。该过程用化学方程式可描述为
的质量、化学性质保持不变。该过程用化学方程式可描述为____________________ 。
 ,还含有
,还含有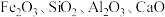 和
和 等)为原料经过下列过程可以制得
等)为原料经过下列过程可以制得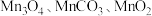 等。
等。I.酸浸、还原:
(1)向软锰矿中加入硫酸、同时加入铁屑,充分反应后,过滤,所得溶液中主要含有
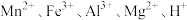 和
和 。写出酸浸、还原过程中
。写出酸浸、还原过程中 发生反应的离子方程式:
发生反应的离子方程式: 的外围电子轨道表示式为:
的外围电子轨道表示式为: 的空间构型为
的空间构型为Ⅱ.除杂:向酸浸、还原所得滤液中加入
 固体,调节溶液的
固体,调节溶液的 ,过滤。向已经除去
,过滤。向已经除去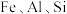 的
的 溶液(
溶液( 约为5)中加入
约为5)中加入 溶液,溶液中的
溶液,溶液中的 形成氟化物沉淀。
形成氟化物沉淀。Ⅲ.沉锰:向调
 后所得滤液中加入一定量的氨水,可以得到
后所得滤液中加入一定量的氨水,可以得到 沉淀。
沉淀。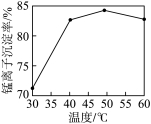
 后,溶液温度越高,锰离子的沉淀率越低的原因是
后,溶液温度越高,锰离子的沉淀率越低的原因是②沉锰过程中溶液中存在平衡:
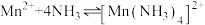 ,
, 中含有的
中含有的 键数为
键数为Ⅳ.氧化:向沉锰所得
 中加入
中加入 溶液,可以得到
溶液,可以得到 。
。Ⅴ.制备。
(3)在搅拌下
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体,该过程发生的离子方程式为
固体,该过程发生的离子方程式为Ⅵ.制备
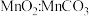 经热解、酸浸等步骤可制备
经热解、酸浸等步骤可制备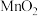 。
。(4)
 溶液中加入
溶液中加入 后立即产生大量气泡,经检测反应过程中有
后立即产生大量气泡,经检测反应过程中有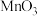 生成,反应前后
生成,反应前后 的质量、化学性质保持不变。该过程用化学方程式可描述为
的质量、化学性质保持不变。该过程用化学方程式可描述为
您最近半年使用:0次
名校
解题方法
9 . 氮是生物体的重要组成元素同时也会引发环境污染,研究氮的转化对生产、生活有重要价值。
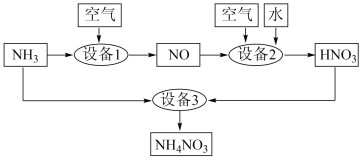
I.某工厂用氨制硝酸和铵盐的流程如图所示。__________________ 。
(2)同温同压下,理论上设备1与设备2中消耗空气的体积比为_________ 。
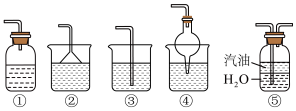
(3)为防止环境污染,以下装置(除⑤标明外,其余盛放的液体均为水)可用于吸收多余氨气的是_______ (填序号)。________________ 。
(5)“氧化池”中溶液pH对NaClO去除能力的影响如图所示。_________________ 。“氧化池”中NH3·H2O与NaClO发生反应的的离子方程式为__________________ 。
(6)“硝化池”是在微生物硝化菌(亚硝酸菌和硝酸菌)作用下实现 →
→ →
→ 的转化,根据下图判断使用亚硝酸菌的最佳条件为
的转化,根据下图判断使用亚硝酸菌的最佳条件为_______________ 。 共同作用转化为CO2,N2而排放,其中 CH3OH的作用为
共同作用转化为CO2,N2而排放,其中 CH3OH的作用为_______ (填“氧化剂”或“还原剂”)理论上反应生成的CO2与N2的物质的量之比为_________ 。
I.某工厂用氨制硝酸和铵盐的流程如图所示。
(2)同温同压下,理论上设备1与设备2中消耗空气的体积比为
(3)为防止环境污染,以下装置(除⑤标明外,其余盛放的液体均为水)可用于吸收多余氨气的是
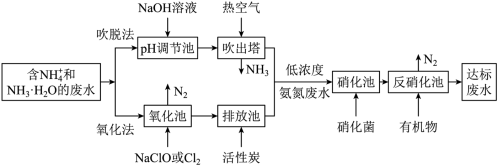
(5)“氧化池”中溶液pH对NaClO去除能力的影响如图所示。
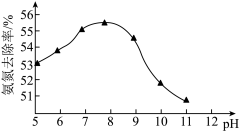
(6)“硝化池”是在微生物硝化菌(亚硝酸菌和硝酸菌)作用下实现
 →
→ →
→ 的转化,根据下图判断使用亚硝酸菌的最佳条件为
的转化,根据下图判断使用亚硝酸菌的最佳条件为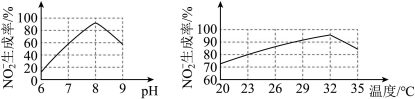
 共同作用转化为CO2,N2而排放,其中 CH3OH的作用为
共同作用转化为CO2,N2而排放,其中 CH3OH的作用为
您最近半年使用:0次
解题方法
10 . 一种高硫锰矿的主要成分 ,含有
,含有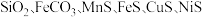 等杂质,其中
等杂质,其中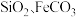 含量较大。以该高硫锰矿为原料制备硫酸锰,流程示意图如图所示。
含量较大。以该高硫锰矿为原料制备硫酸锰,流程示意图如图所示。
②金属离子的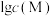 与溶液
与溶液 的关系如图所示。
的关系如图所示。_______ 。
(2)若未经脱硫直接酸浸,会产生的污染物是_______ 。
(3)酸浸时主要含锰组分发生反应的离子方程式为_______ ;加入 的作用是
的作用是_______ (用离子方程式表示)。
(4)调溶液 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是_______ 。
(5)由图像可知,从“操作”所得溶液中得到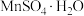 晶体需进行的操作是
晶体需进行的操作是_______ 、洗涤、干燥。
ⅰ.称取 晶体,加水溶解,将滤液定容于
晶体,加水溶解,将滤液定容于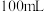 容量瓶中。
容量瓶中。
ⅱ.取 溶液于锥形瓶中,加少量催化剂和过量
溶液于锥形瓶中,加少量催化剂和过量 溶液,加热、充分反应,产生
溶液,加热、充分反应,产生 和
和 ,煮沸溶液使过量的
,煮沸溶液使过量的 分解。
分解。
ⅲ.加入指示剂,用 溶液滴定。滴定至终点时消耗
溶液滴定。滴定至终点时消耗 溶液的体积为
溶液的体积为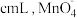 重新变成
重新变成 。废渣中锰元素的质量分数为
。废渣中锰元素的质量分数为_______ 。
 ,含有
,含有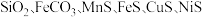 等杂质,其中
等杂质,其中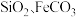 含量较大。以该高硫锰矿为原料制备硫酸锰,流程示意图如图所示。
含量较大。以该高硫锰矿为原料制备硫酸锰,流程示意图如图所示。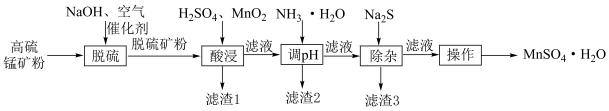
| 金属硫化物 |  |  |  |  |
 |  | 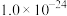 | 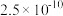 |  |
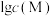 与溶液
与溶液 的关系如图所示。
的关系如图所示。
(2)若未经脱硫直接酸浸,会产生的污染物是
(3)酸浸时主要含锰组分发生反应的离子方程式为
 的作用是
的作用是(4)调溶液
 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是(5)由图像可知,从“操作”所得溶液中得到
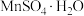 晶体需进行的操作是
晶体需进行的操作是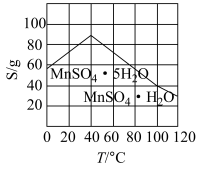
ⅰ.称取
 晶体,加水溶解,将滤液定容于
晶体,加水溶解,将滤液定容于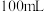 容量瓶中。
容量瓶中。ⅱ.取
 溶液于锥形瓶中,加少量催化剂和过量
溶液于锥形瓶中,加少量催化剂和过量 溶液,加热、充分反应,产生
溶液,加热、充分反应,产生 和
和 ,煮沸溶液使过量的
,煮沸溶液使过量的 分解。
分解。ⅲ.加入指示剂,用
 溶液滴定。滴定至终点时消耗
溶液滴定。滴定至终点时消耗 溶液的体积为
溶液的体积为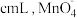 重新变成
重新变成 。废渣中锰元素的质量分数为
。废渣中锰元素的质量分数为
您最近半年使用:0次



