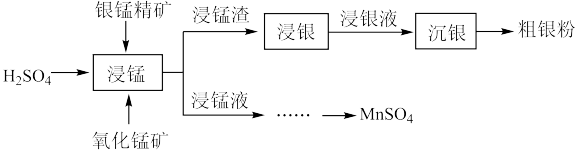
1 . 以银锰精矿(主要含 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:I.酸性条件下, 的氧化性强于
的氧化性强于 ;Ⅱ.
;Ⅱ. 。
。
(1)“浸锰”过程中, 溶液可浸出矿石中的锰元素,同时去除
溶液可浸出矿石中的锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。
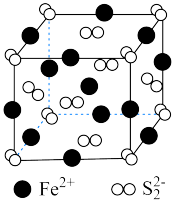
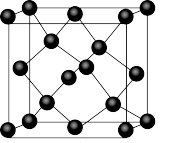
① 晶胞如图所示,阴、阳离子的个数比为
晶胞如图所示,阴、阳离子的个数比为___________ 。
②锰元素浸出时,发生反应: ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
___________ 。
③去除 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为___________ 。
(2)“浸银”过程中,使用过量 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为
形式浸出,反应为 。结合平衡移动原理,分析浸出剂中
。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为___________ 。
(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是___________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是___________ 。

 、MnS、
、MnS、 )和氧化锰矿(主要含
)和氧化锰矿(主要含 )为原料联合提取银和锰的一种流程示意图如下:
)为原料联合提取银和锰的一种流程示意图如下:
已知:I.酸性条件下,
 的氧化性强于
的氧化性强于 ;Ⅱ.
;Ⅱ. 。
。(1)“浸锰”过程中,
 溶液可浸出矿石中的锰元素,同时去除
溶液可浸出矿石中的锰元素,同时去除 ,有利于后续银的浸出,使矿石中的银以
,有利于后续银的浸出,使矿石中的银以 的形式残留于浸锰渣中。
的形式残留于浸锰渣中。①
 晶胞如图所示,阴、阳离子的个数比为
晶胞如图所示,阴、阳离子的个数比为
②锰元素浸出时,发生反应:
 ,其平衡常数K与
,其平衡常数K与 、
、 、
、 的代数关系式为
的代数关系式为
③去除
 时,
时, 与
与 转化为铁盐和硫酸盐,则发生反应的离子方程式为
转化为铁盐和硫酸盐,则发生反应的离子方程式为(2)“浸银”过程中,使用过量
 、HCl和
、HCl和 混合液作为浸出剂,将
混合液作为浸出剂,将 中的银以
中的银以 形式浸出,反应为
形式浸出,反应为 。结合平衡移动原理,分析浸出剂中
。结合平衡移动原理,分析浸出剂中 和
和 的作用为
的作用为(3)“沉银”过程中,需要加入过量的铁粉。
①使用过量的铁粉的作用是
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。amin后,Ag的沉淀率逐渐减小的原因是

您最近半年使用:0次
名校
解题方法
2 . 商务部、海关总署在官网发布公告称,决定对镓、锗相关物项实施出口管制。锗,天然的优良半导体,在光纤通信、红外光学、太阳能电池、核物理探测等领域应用颇多。工业上利用锗锌矿(主要成分为GeO2和ZnS,还含少量Fe2O3 )来制备高纯度锗的流程如图。
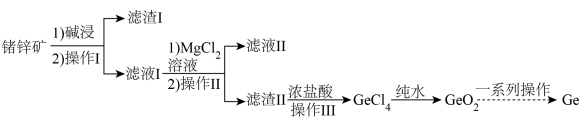
已知:①GeCl4的熔点为-49.5℃ ,沸点为84℃,其在水中或酸的稀溶液中易水解。
②GeO2可溶于强碱溶液,生成锗酸盐。
(1)在元素周期表中,Ge、As、Se位于同一周期,则基态原子的第一电离能由大到小的顺序是________ 。
(2)硅和锗与氯元素都能形成氯化物RCL(R代表Si和Ge),从原子结构角度解释原因:___ 。
(3)“滤渣II”中除含有MgGeO3外,还含有少量____________ (填化学式)。
(4)GeCl4中加水反应的离子方程式是______________ 。
(5)固态GeCl4为_______ 晶体,“操作III”分离获得GeCl4所使用的装置为________ (填标号)。
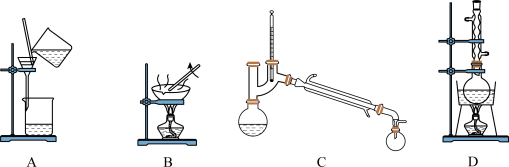
根据选择,提出改进的方法:_________ (若不需要改进,此空填“不需要")。
(6)Ge单晶的晶胞结构类似于金刚石,如图。已知Ge单晶的晶胞边长为a pm,设NA为阿伏加德罗常数的值,Ge单晶的密度为______ g·cm-3。

已知:①GeCl4的熔点为-49.5℃ ,沸点为84℃,其在水中或酸的稀溶液中易水解。
②GeO2可溶于强碱溶液,生成锗酸盐。
(1)在元素周期表中,Ge、As、Se位于同一周期,则基态原子的第一电离能由大到小的顺序是
(2)硅和锗与氯元素都能形成氯化物RCL(R代表Si和Ge),从原子结构角度解释原因:
(3)“滤渣II”中除含有MgGeO3外,还含有少量
(4)GeCl4中加水反应的离子方程式是
(5)固态GeCl4为

根据选择,提出改进的方法:
(6)Ge单晶的晶胞结构类似于金刚石,如图。已知Ge单晶的晶胞边长为a pm,设NA为阿伏加德罗常数的值,Ge单晶的密度为

您最近半年使用:0次
名校
解题方法
3 . 某钾盐X由四种元素组成,某小组按如下流程进行实验。请回答:
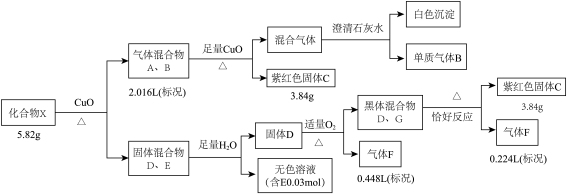
已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是___________ ,C的化学式是___________ 。
(2)写出固体混合物D、G共热所发生的化学反应方程式___________ 。
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入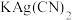 溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)
溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)___________ 。
(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子___________ 。

已知:相同条件下,A、B为中学常见气体且密度相同。D、E均为二元化合物,气体F能使品红溶液褪色且通入无色溶液E中,有淡黄色沉淀生成。
(1)气体B的电子式是
(2)写出固体混合物D、G共热所发生的化学反应方程式
(3)无色溶液E中滴加盐酸观察到气泡。收集少量气体通入
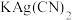 溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)
溶液,观察到黑色沉淀生成。写出生成沉淀的离子反应方程式(发生非氧化还原反应)(4)将G溶于氨水得到一无色溶液,设计实验检验无色溶液中主要离子
您最近半年使用:0次
2023-04-14更新
|
773次组卷
|
3卷引用:浙江省绍兴市2023届高三二模考试化学试题
名校
解题方法
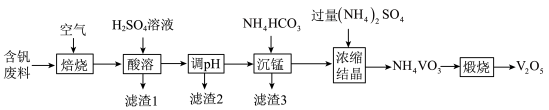
4 . 水系锌离子电池, 为正极、Zn箔为负极、
为正极、Zn箔为负极、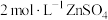 溶液作电解质溶液。实验室以含矾废料(含
溶液作电解质溶液。实验室以含矾废料(含 、CuO、MnO、
、CuO、MnO、 、
、 、有机物等)为原料制备
、有机物等)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:25℃时,相关难溶电解质的溶度积常数如下表所示:
回答下列问题:
(1)“焙烧”的目的为_____________________________ 。
(2)“酸溶”后,若溶液中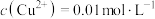 ,
, 开始沉淀和完全沉淀时溶液的pH分别为
开始沉淀和完全沉淀时溶液的pH分别为__________ 、__________ (溶液中离子浓度 ,认为该离子沉淀完全;
,认为该离子沉淀完全;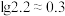 )。
)。
(3)某学习小组为探究 在溶液中存在着微弱的电离平衡
在溶液中存在着微弱的电离平衡 ,进行下面的实验。
,进行下面的实验。
①向 溶液中逐滴加入氨水至过量,反应的现象为
溶液中逐滴加入氨水至过量,反应的现象为__________ 。
②将①得到的溶液均分在两支试管中,第一支试管中,滴加适量的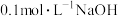 溶液,无现象;第二支试管中,滴加
溶液,无现象;第二支试管中,滴加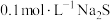 溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是
溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是__________ 。
③在②的第二支试管中,继续滴加足量的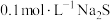 溶液,并过滤,得到无色滤液,说明的问题及解释是
溶液,并过滤,得到无色滤液,说明的问题及解释是______________________________ 。
(4)写出“沉锰”反应的离子方程式:____________________ 。
(5)水系锌离子电池工作时出现容量衰减,是由于 作为
作为 电池正极,材料通过的
电池正极,材料通过的 和质子共嵌入实现的,已知
和质子共嵌入实现的,已知 的嵌入生成了
的嵌入生成了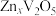 ,用电极反应式表示为
,用电极反应式表示为__________ 。
 为正极、Zn箔为负极、
为正极、Zn箔为负极、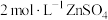 溶液作电解质溶液。实验室以含矾废料(含
溶液作电解质溶液。实验室以含矾废料(含 、CuO、MnO、
、CuO、MnO、 、
、 、有机物等)为原料制备
、有机物等)为原料制备 的一种流程如图所示:
的一种流程如图所示:
已知:25℃时,相关难溶电解质的溶度积常数如下表所示:
| 难溶电解质 |  |  |  | CuS |
 | 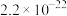 | 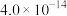 |  |  |
(1)“焙烧”的目的为
(2)“酸溶”后,若溶液中
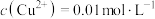 ,
, 开始沉淀和完全沉淀时溶液的pH分别为
开始沉淀和完全沉淀时溶液的pH分别为 ,认为该离子沉淀完全;
,认为该离子沉淀完全;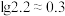 )。
)。(3)某学习小组为探究
 在溶液中存在着微弱的电离平衡
在溶液中存在着微弱的电离平衡 ,进行下面的实验。
,进行下面的实验。①向
 溶液中逐滴加入氨水至过量,反应的现象为
溶液中逐滴加入氨水至过量,反应的现象为②将①得到的溶液均分在两支试管中,第一支试管中,滴加适量的
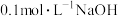 溶液,无现象;第二支试管中,滴加
溶液,无现象;第二支试管中,滴加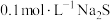 溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是
溶液,有黑色的沉淀生成。分析这两种实验现象,得出的结论是③在②的第二支试管中,继续滴加足量的
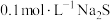 溶液,并过滤,得到无色滤液,说明的问题及解释是
溶液,并过滤,得到无色滤液,说明的问题及解释是(4)写出“沉锰”反应的离子方程式:
(5)水系锌离子电池工作时出现容量衰减,是由于
 作为
作为 电池正极,材料通过的
电池正极,材料通过的 和质子共嵌入实现的,已知
和质子共嵌入实现的,已知 的嵌入生成了
的嵌入生成了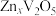 ,用电极反应式表示为
,用电极反应式表示为
您最近半年使用:0次
名校
解题方法
5 . 某工厂采用联合焙烧法以辉铋矿(主要成分为Bi2S3,含有FeS2、SiO2杂质)与软锰矿(主要成分为MnO2)为原料制备BiOCl和MnSO4,工艺流程如下:
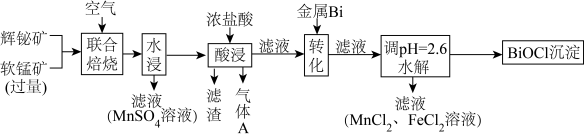
已知:①焙烧时过量的MnO2分解为Mn2O3,Bi2S3、FeS2转变为Bi2O3、Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③常温下,相关金属离子形成氢氧化物的pH范围如下:
回答下列问题:
(1)写出“联合焙烧”时MnO2和Bi2S3反应生成MnSO4的化学方程式:_______ 。
(2)Bi2S3在空气中单独焙烧生成Bi2O3,同时产生一种气体产物,若用过量的NaOH溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时Mn2O3转化为MnCl2,则生成的气体A为_______ (填化学式)。
(4)“转化”时加入金属Bi的目的是_______ (用离子方程式表示)。
(5)若沉淀完全时溶液中的金属离子浓度为10−5 mol⋅L−1,则由表中数据计算可得:Ksp[Fe(OH)3]=_______ 。
(6)水解生成BiOCl的离子方程式为_______ 。
(7)若取10 kg铋含量为79.42%的辉铋矿,经过上述流程(铋元素在整个流程中损失率为5%),某同学经计算可制得BiOCl固体的质量约为9.40 kg,该同学的计算结果_______ (填“正确”或“不正确”),理由是_______ 。

已知:①焙烧时过量的MnO2分解为Mn2O3,Bi2S3、FeS2转变为Bi2O3、Fe2O3;
②金属活动性:Fe>(H)>Bi>Cu;
③常温下,相关金属离子形成氢氧化物的pH范围如下:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe2+ | 6.3 | 8.3 |
| Fe³+ | 1.6 | 3.1 |
| Mn2+ | 8.1 | 10.1 |
回答下列问题:
(1)写出“联合焙烧”时MnO2和Bi2S3反应生成MnSO4的化学方程式:
(2)Bi2S3在空气中单独焙烧生成Bi2O3,同时产生一种气体产物,若用过量的NaOH溶液吸收该气体,则所得溶液的溶质为
(3)“酸浸”时Mn2O3转化为MnCl2,则生成的气体A为
(4)“转化”时加入金属Bi的目的是
(5)若沉淀完全时溶液中的金属离子浓度为10−5 mol⋅L−1,则由表中数据计算可得:Ksp[Fe(OH)3]=
(6)水解生成BiOCl的离子方程式为
(7)若取10 kg铋含量为79.42%的辉铋矿,经过上述流程(铋元素在整个流程中损失率为5%),某同学经计算可制得BiOCl固体的质量约为9.40 kg,该同学的计算结果
您最近半年使用:0次
2023-01-04更新
|
456次组卷
|
2卷引用:河北省部分中学2022-2023学年高二上学期12月联考化学试题
名校
6 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了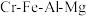 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:

回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为___________ 。
(2)滤渣I的主要成分是___________ (填化学式)。
(3)工序③中发生反应的离子方程式为___________ 。
(4)热解工序产生的混合气体最适宜返回工序___________ (填“①”或“②”或“③”或“④”)参与内循环。
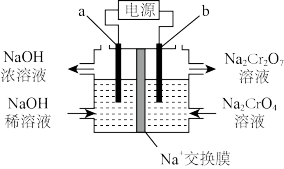
(5)工序③也可以利用电解法制 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的___________ 极相连,制备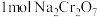 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重___________ g。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的 为
为___________ 。(通常认为溶液中离子浓度等于 为恰好沉淀完全;已知
为恰好沉淀完全;已知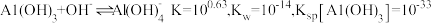 )
)
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)高温连续氧化工序中主要反应的化学方程式为
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)热解工序产生的混合气体最适宜返回工序
(5)工序③也可以利用电解法制
 ,工作原理如下图所示(a,b电极均为石墨):b与电源的
,工作原理如下图所示(a,b电极均为石墨):b与电源的 时,理论上左侧溶液总质量增重
时,理论上左侧溶液总质量增重
(6)工序④溶液中的铝元素恰好完全转化为沉淀的
 为
为 为恰好沉淀完全;已知
为恰好沉淀完全;已知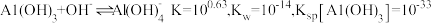 )
)
您最近半年使用:0次
解题方法
7 . 铀(U)可用作核燃料。核废料中+6价的铀[U(VI)]可以通过以下两种方法处理。
(1)电化学还原法。U(VI)还原为U(IV)的电化学装置如图所示。

阴极上发生反应:UO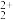 +4H++2e-=U4++2H2O、
+4H++2e-=U4++2H2O、 +3H++2e-=HNO2+H2O
+3H++2e-=HNO2+H2O
阴极区溶液中发生反应:2HNO2+U4+=UO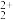 +2NO↑+2H+、2HNO2+
+2NO↑+2H+、2HNO2+ =N2O↑+N2↑+3H2O+H+
=N2O↑+N2↑+3H2O+H+
①反应2HNO2+ =N2O↑+N2↑+3H2O+H+中,每生成0.1mol N2转移电子
=N2O↑+N2↑+3H2O+H+中,每生成0.1mol N2转移电子_______ mol。
②阴极区溶液中加入N2H5NO3的目的是_______ 。
③以恒定电流进行电解,测得阴极区溶液中部分离子的物质的量浓度随时间变化如图所示。
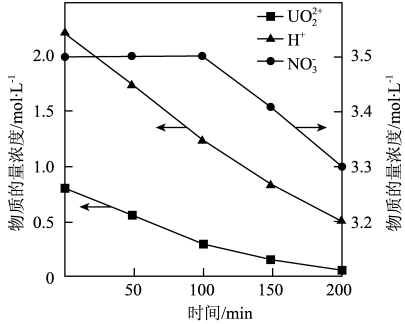
i.0~100min,电路中每转移1mol e-,阴极区H+减少_______ mol。
ii.100~200min,c(H+)下降速率低于100min前,原因是_______ 。
(2)吸附-沉淀法。氟磷灰石[Ca10(PO4)6F2]可吸附溶液中的U(VI)并形成Ca(UO2)2(PO4)2沉淀。
①900℃条件下,煅烧CaF2、Ca(OH)2和Ca2P2O7混合物,可制得吸附剂氟磷灰石。该反应的化学方程式为_______ 。
②U(VI)的微粒越小,氟磷灰石吸附-沉淀的效果越好。溶液的pH会影响氟磷灰石表面所带电荷。pH=2.5氟磷灰石表面不带电,pH<2.5氟磷灰石表面带正电,pH>2.5氟磷灰石表面带负电。U(VI)在不同pH的酸性溶液中的主要物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)如图甲所示。不同pH溶液中,吸附达到平衡时单位质量氟磷灰石吸附U(VI)的质量如图乙所示。
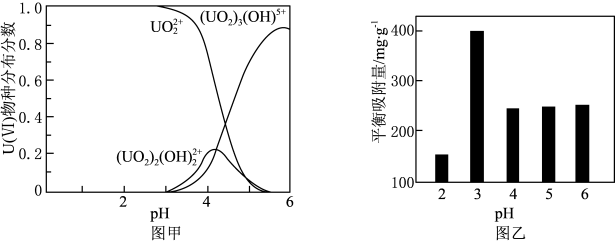
pH=3时氟磷灰石的平衡吸附量高于pH=2和pH=4时的平衡吸附量,原因分别是_______ 。
(1)电化学还原法。U(VI)还原为U(IV)的电化学装置如图所示。

阴极上发生反应:UO
 +4H++2e-=U4++2H2O、
+4H++2e-=U4++2H2O、 +3H++2e-=HNO2+H2O
+3H++2e-=HNO2+H2O阴极区溶液中发生反应:2HNO2+U4+=UO
 +2NO↑+2H+、2HNO2+
+2NO↑+2H+、2HNO2+ =N2O↑+N2↑+3H2O+H+
=N2O↑+N2↑+3H2O+H+①反应2HNO2+
 =N2O↑+N2↑+3H2O+H+中,每生成0.1mol N2转移电子
=N2O↑+N2↑+3H2O+H+中,每生成0.1mol N2转移电子②阴极区溶液中加入N2H5NO3的目的是
③以恒定电流进行电解,测得阴极区溶液中部分离子的物质的量浓度随时间变化如图所示。

i.0~100min,电路中每转移1mol e-,阴极区H+减少
ii.100~200min,c(H+)下降速率低于100min前,原因是
(2)吸附-沉淀法。氟磷灰石[Ca10(PO4)6F2]可吸附溶液中的U(VI)并形成Ca(UO2)2(PO4)2沉淀。
①900℃条件下,煅烧CaF2、Ca(OH)2和Ca2P2O7混合物,可制得吸附剂氟磷灰石。该反应的化学方程式为
②U(VI)的微粒越小,氟磷灰石吸附-沉淀的效果越好。溶液的pH会影响氟磷灰石表面所带电荷。pH=2.5氟磷灰石表面不带电,pH<2.5氟磷灰石表面带正电,pH>2.5氟磷灰石表面带负电。U(VI)在不同pH的酸性溶液中的主要物种分布分数(平衡时某物种的浓度占各物种浓度之和的分数)如图甲所示。不同pH溶液中,吸附达到平衡时单位质量氟磷灰石吸附U(VI)的质量如图乙所示。

pH=3时氟磷灰石的平衡吸附量高于pH=2和pH=4时的平衡吸附量,原因分别是
您最近半年使用:0次
2022-05-07更新
|
1208次组卷
|
2卷引用:江苏省南通泰州等七市2022届高三第三次调研测试化学试题
21-22高三上·江苏南通·期末
名校
解题方法
8 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
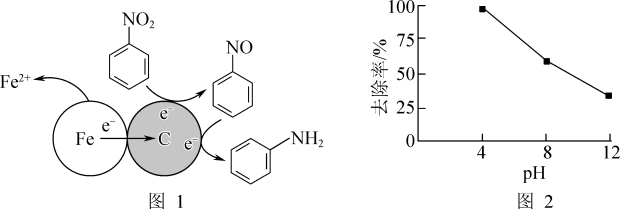
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(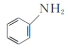 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
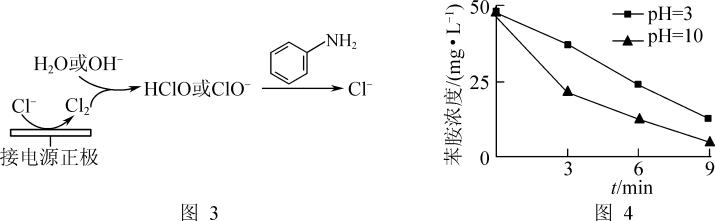
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近半年使用:0次
解题方法
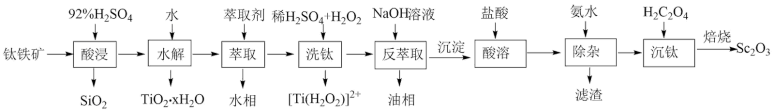
9 . 钪( )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为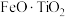 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至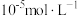 时可认为沉淀完全
时可认为沉淀完全
②室温下,溶液中离子沉淀完全的 如下表所示:
如下表所示:
③ ,
,
回答下列问题:
(1)“酸浸”后 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是___________ 。
(2)“萃取”时,使用 煤油作为萃取剂,一定条件下萃取率
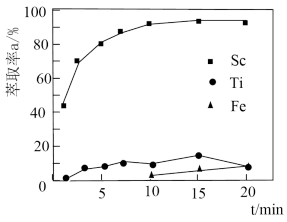
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为___________  。
。
(3)“洗钛”所得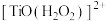 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是___________ 。(写出两点)
(4)“酸溶”后滤液中存在的阳离子 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是___________ 。
(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为___________ 。
 )是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为
)是地壳中含量极少的稀土元素,在照明、合金和催化剂等领域有重要应用。钛铁矿的主要成分为 (可表示为
(可表示为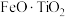 ),还含有少量
),还含有少量 等氧化物,从钛铁矿中提取
等氧化物,从钛铁矿中提取 的流程如下:
的流程如下:
已知:①当离子浓度减小至
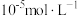 时可认为沉淀完全
时可认为沉淀完全②室温下,溶液中离子沉淀完全的
 如下表所示:
如下表所示:| 离子 |  |  |  |
沉淀完全的 | 3.2 | 9.0 | 1.05 |
 ,
,回答下列问题:
(1)“酸浸”后
 元素转化为
元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(2)“萃取”时,使用
 煤油作为萃取剂,一定条件下萃取率
煤油作为萃取剂,一定条件下萃取率 受振荡时间的影响如图,萃取时选择最佳的振荡时间为
受振荡时间的影响如图,萃取时选择最佳的振荡时间为 。
。
(3)“洗钛”所得
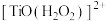 为橘黄色的稳定离子,
为橘黄色的稳定离子, 的作用是
的作用是(4)“酸溶”后滤液中存在的阳离子
 浓度均小于
浓度均小于 “除杂”过程中应控制的
“除杂”过程中应控制的 范围是
范围是(5)“沉钪”后得到五水草酸钪,焙烧生成四种氧化物。其反应的化学方程式为
您最近半年使用:0次
解题方法
10 . 以软锰矿粉(主要含有MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制备高纯MnO2的流程如下图所示:
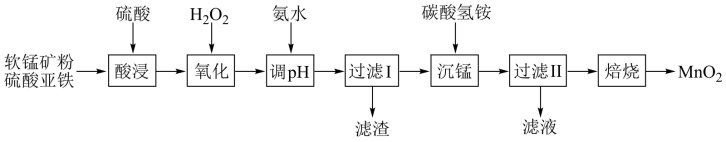
已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
(1)“酸浸”实验中,锰的浸出率结果如下图所示。由图可知,软锰矿粉酸浸的适宜条件是___________ 。

(2)酸浸后,锰主要以Mn2+的形式存在,写出相应的离子方程式___________  。
。
(3)若氧化后c(Al3+)=0.02 mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?___________ (列式计算);想要达到实验目的,加入氨水应调节pH的范围为___________ 。
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”,“过滤II”所得滤渣为MnCO3。
①“沉锰”过程中放出CO2,反应的离子方程式为___________ 。
②“沉锰”过程中沉锰速率与温度的关系如图所示。
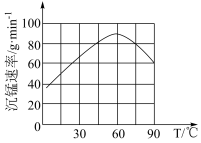
当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是___________ 。
(5)写出焙烧过程的化学方程式___________ 。

已知:①常温下,Ksp[Fe(OH)3]=8.0×10-38,Ksp[Al(OH)3]=4.0×10-34。
②常温下,氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.6、3.4;Mn2+开始沉淀的pH为8.1。
③常温下,当溶液中金属离子的物质的量浓度小于或等于1×10-5 mol·L-1时,可视为该金属离子已被沉淀完全。
(1)“酸浸”实验中,锰的浸出率结果如下图所示。由图可知,软锰矿粉酸浸的适宜条件是

(2)酸浸后,锰主要以Mn2+的形式存在,写出相应的离子方程式
 。
。(3)若氧化后c(Al3+)=0.02 mol/L,加入氨水(设溶液体积增加1倍),使Fe3+完全沉淀,此时是否有Al(OH)3沉淀生成?
(4)加入碳酸氢铵产生沉淀的过程称为“沉锰”,“过滤II”所得滤渣为MnCO3。
①“沉锰”过程中放出CO2,反应的离子方程式为
②“沉锰”过程中沉锰速率与温度的关系如图所示。

当温度高于60℃时,沉锰速率随着温度升高而减慢的原因是
(5)写出焙烧过程的化学方程式
您最近半年使用:0次



