名校
解题方法
1 . 茫茫大海是化学元素溴的“故乡”,海水中溴的含量约为67 mg/L。从海水中提取溴的工业流程如下:
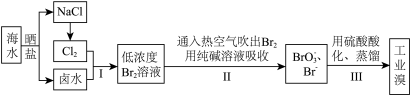
(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是_______ 。
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的______(填字母)。
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是________ , 还原剂是_______ ,然后用氯气氧化上述反应的产物后蒸馏,写出氯气氧化HBr的离子方程式:____________ 。

(1)步骤I中已获得了游离态的溴,步骤II中又将之转变成化合态的溴,其目的是
(2)步骤II中通入热空气或水蒸气吹出Br2,利用了溴的______(填字母)。
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(3)上述流程中吹出的溴蒸气也可先用SO2水溶液吸收,反应生成HBr和H2SO4,该反应中的氧化剂是
您最近半年使用:0次
名校
解题方法
2 . 在硫酸工业生产中,为了有利于 的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法
的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法不正确 的是

 的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法
的转化,且能充分利用热能,采用了中间有热交换器的接触室(见图)。下列说法
| A.a、b两处的混合气体成分含量相同,温度不同 |
| B.c、d两处的混合气体成分含量相同,温度不同 |
C.由题目可知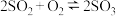 为放热反应 为放热反应 |
D.将混合气体进行两次催化氧化的目的是提高 的转化率 的转化率 |
您最近半年使用:0次
解题方法
3 . CuO 粉末与H2在加热条件下会发生反应。下列说法错误的是
| A.该反应说明H2具有还原性 | B.反应过程可观察到固体粉末由黑色变成红色 |
C.发生的反应为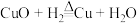 | D.反应所需H2 可由 Cu 与稀H2SO4反应制得 |
您最近半年使用:0次
2022-09-15更新
|
165次组卷
|
2卷引用:甘肃省武威第七中学2022-2023学年高一上学期质量检测(分班考)化学试题
解题方法
4 . 磷酸铁 常用作电极材料,以硫铁矿(主要成分是
常用作电极材料,以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 )为原料制备磷酸铁的流程如下:
)为原料制备磷酸铁的流程如下:

已知:a.该工艺条件下,几种金属离子沉淀的pH如下表所示:
b. 难溶于水。
难溶于水。
(1)焙烧过程中为提高化学反应速率,可采取的措施是_______ (至少写一条)。
(2)用 还原
还原 的离子方程式为
的离子方程式为_______ 。
(3)用 调节pH的范围是
调节pH的范围是_______ ,以达到除铝的目的。
(4)除铝后加过量 溶液的目的是
溶液的目的是_______ 。
 常用作电极材料,以硫铁矿(主要成分是
常用作电极材料,以硫铁矿(主要成分是 ,含少量
,含少量 、
、 和
和 )为原料制备磷酸铁的流程如下:
)为原料制备磷酸铁的流程如下:
已知:a.该工艺条件下,几种金属离子沉淀的pH如下表所示:
| 金属氢氧化物 |  |  |  |
| 开始沉淀pH | 2.3 | 7.5 | 4.0 |
| 完全沉淀pH | 4.1 | 9.7 | 5.2 |
b.
 难溶于水。
难溶于水。(1)焙烧过程中为提高化学反应速率,可采取的措施是
(2)用
 还原
还原 的离子方程式为
的离子方程式为(3)用
 调节pH的范围是
调节pH的范围是(4)除铝后加过量
 溶液的目的是
溶液的目的是
您最近半年使用:0次
解题方法
5 . 氮及其化合物的转化关系如图所示:
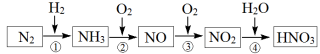
(1)①~④各步转化中,属于氮的固定的是_______ (填序号);氨气分子的结构式:_______
(2)写出工业上制备氨气的化学方程式:_______
(3)工业制硝酸时尾气中含有NO、NO2,常用氢氧化钠溶液吸收处理
①氢氧化钠溶液吸收尾气时发生的反应有: ,
,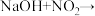
____ 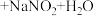 (填化学式,不需要配平方程式)
(填化学式,不需要配平方程式)
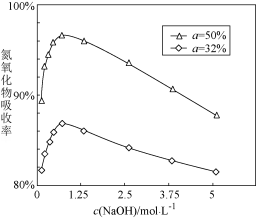
②用不同浓度的氢氧化钠溶液吸收NO2含量不同的尾气,氮氧化物吸收率随氢氧化钠溶液浓度变化如图( 表示尾气里NO、NO2里NO2的含量)。当
表示尾气里NO、NO2里NO2的含量)。当 小于50%时,加入
小于50%时,加入 能提高氮氧化物的吸收率,原因是
能提高氮氧化物的吸收率,原因是_______
③不用水吸收处理NO2的原因是_______

(1)①~④各步转化中,属于氮的固定的是
(2)写出工业上制备氨气的化学方程式:
(3)工业制硝酸时尾气中含有NO、NO2,常用氢氧化钠溶液吸收处理
①氢氧化钠溶液吸收尾气时发生的反应有:
 ,
,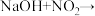
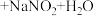 (填化学式,不需要配平方程式)
(填化学式,不需要配平方程式)②用不同浓度的氢氧化钠溶液吸收NO2含量不同的尾气,氮氧化物吸收率随氢氧化钠溶液浓度变化如图(
 表示尾气里NO、NO2里NO2的含量)。当
表示尾气里NO、NO2里NO2的含量)。当 小于50%时,加入
小于50%时,加入 能提高氮氧化物的吸收率,原因是
能提高氮氧化物的吸收率,原因是③不用水吸收处理NO2的原因是

您最近半年使用:0次
名校
解题方法
6 .  、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和 产品的流程图如下(Ce为铈元素):
产品的流程图如下(Ce为铈元素):

(1)含硫各微粒( 、
、 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。
与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。
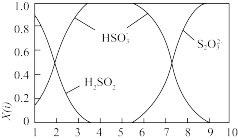
①下列说法正确的是_______ (填字母序号)。
a.pH=8时,溶液中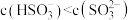
b.pH=7时,溶液中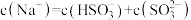
c.为获得尽可能纯的 ,可将溶液的pH控制在4~5左右
,可将溶液的pH控制在4~5左右
②已知 溶液显酸性,用化学平衡原理解释并写出相应的离子反应方程式:
溶液显酸性,用化学平衡原理解释并写出相应的离子反应方程式:_______ 。
(2)装置Ⅱ中,酸性条件下,NO被 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 的离子方程式
的离子方程式_______ 。
(3)装置Ⅲ的作用之一是再生 ,其原理如图所示。
,其原理如图所示。
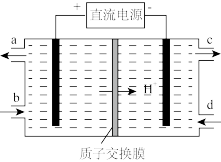
①生成 的电极反应式为
的电极反应式为_______ 。
②生成 从电解槽的
从电解槽的_______ (填字母序号)口流出。
 、NO是大气污染物。吸收
、NO是大气污染物。吸收 和NO,获得
和NO,获得 和
和 产品的流程图如下(Ce为铈元素):
产品的流程图如下(Ce为铈元素):
(1)含硫各微粒(
 、
、 和
和 )存在于
)存在于 与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。
与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如下图所示。
①下列说法正确的是
a.pH=8时,溶液中
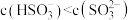
b.pH=7时,溶液中
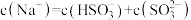
c.为获得尽可能纯的
 ,可将溶液的pH控制在4~5左右
,可将溶液的pH控制在4~5左右②已知
 溶液显酸性,用化学平衡原理解释并写出相应的离子反应方程式:
溶液显酸性,用化学平衡原理解释并写出相应的离子反应方程式:(2)装置Ⅱ中,酸性条件下,NO被
 氧化的产物主要是
氧化的产物主要是 、
、 ,写出生成
,写出生成 的离子方程式
的离子方程式(3)装置Ⅲ的作用之一是再生
 ,其原理如图所示。
,其原理如图所示。
①生成
 的电极反应式为
的电极反应式为②生成
 从电解槽的
从电解槽的
您最近半年使用:0次
名校
解题方法
7 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
Ⅰ. 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

(1)生成 的化学方程式是
的化学方程式是_______ 。
(2) 的电离方程式是
的电离方程式是_______ 。
(3)样液中加入 后产生氧气,说明
后产生氧气,说明 与水反应的过程中还生成了
与水反应的过程中还生成了_______ (化学式)。
(4)用该方法制备的 中含有碳酸钠。生成白色沉淀的离子方程式是
中含有碳酸钠。生成白色沉淀的离子方程式是_______ 。
(5)若bg 样品可消耗
样品可消耗 的
的 溶液amL,则该样品的纯度为
溶液amL,则该样品的纯度为_______ 。
Ⅱ.工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如下;
,能溶于水)的工艺流程如下;
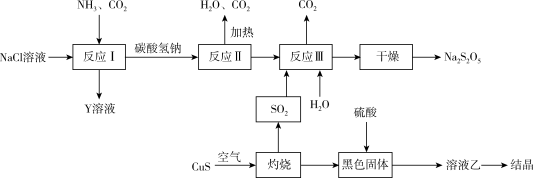
(6)反应Ⅱ的化学方程式是_______ 。
(7)关于上述流程,下列说法不正确的是_______(填字母)。
(8)Y溶液中含有阳离子有 、
、 和离子X。检验离子X的方法是
和离子X。检验离子X的方法是_______ 。
(9)反应Ⅲ包含多步反应:
第一步:……
第二步: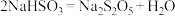
为了减少产品 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为_______ 。
(10)已知 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为_______ 。
(11)灼烧的化学方程式为_______ 。
Ⅰ.
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
(1)生成
 的化学方程式是
的化学方程式是(2)
 的电离方程式是
的电离方程式是(3)样液中加入
 后产生氧气,说明
后产生氧气,说明 与水反应的过程中还生成了
与水反应的过程中还生成了(4)用该方法制备的
 中含有碳酸钠。生成白色沉淀的离子方程式是
中含有碳酸钠。生成白色沉淀的离子方程式是(5)若bg
 样品可消耗
样品可消耗 的
的 溶液amL,则该样品的纯度为
溶液amL,则该样品的纯度为Ⅱ.工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如下;
,能溶于水)的工艺流程如下;
(6)反应Ⅱ的化学方程式是
(7)关于上述流程,下列说法不正确的是_______(填字母)。
A.氨气溶于水使溶液呈碱性的原因是: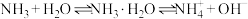 |
| B.反应Ⅰ是置换反应 |
C.该流程中, 可以循环使用 可以循环使用 |
| D.溶液乙的结晶产物是硫酸铜晶体 |
 、
、 和离子X。检验离子X的方法是
和离子X。检验离子X的方法是(9)反应Ⅲ包含多步反应:
第一步:……
第二步:
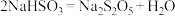
为了减少产品
 中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为
中的杂质含量,理论上需控制第一步反应中气体反应物与固体反应物的物质的量之比为(10)已知
 与稀硫酸反应生成
与稀硫酸反应生成 ,其离子方程式为
,其离子方程式为(11)灼烧的化学方程式为
您最近半年使用:0次
名校
解题方法
8 . 海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如图 :
:
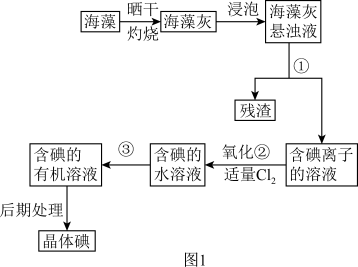
(1)指出提取碘的过程中有关的实验操作名称:③_______ ;
(2)提取碘的过程中,可供选择的有关试剂是_______ 。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是_______ 。
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图 所示实验装置中的错误有
所示实验装置中的错误有_______ 处。
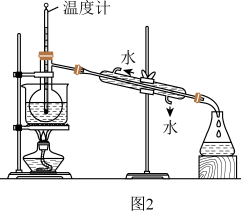
(5)进行上述蒸馏操作时,使用水浴的原因是_______ 。
 :
:
(1)指出提取碘的过程中有关的实验操作名称:③
(2)提取碘的过程中,可供选择的有关试剂是
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室准备了烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器是
(4)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出如图
 所示实验装置中的错误有
所示实验装置中的错误有
(5)进行上述蒸馏操作时,使用水浴的原因是
您最近半年使用:0次
名校
解题方法
9 . 粉煤灰的综合利用既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)中铝、铁元素的分离工艺流程如图:

(1)①“酸浸”时,Al2O3发生反应的离子方程式为______ 。
②当硫酸质量分数大于50%时,金属氧化物浸出率明显下降。其原因是______ 。
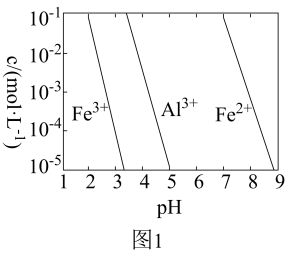
(2)有关金属离子以氢氧化物形式沉淀时离子浓度随pH变化如图1所示。若浸出液不经还原直接与氨水混合,则铝、铁元素分离效果较差,其原因是______ 。
(3)沉铝后所得FeSO4用EDTA络合后可用于烟气中NO的吸收,其原理为[Fe(EDTA)]2++2NO [Fe(EDTA)(NO)2]2+。EDTA络合吸收结合生物转化去除NO的装置如图2所示,生物反应器中发生反应的离子方程式为
[Fe(EDTA)(NO)2]2+。EDTA络合吸收结合生物转化去除NO的装置如图2所示,生物反应器中发生反应的离子方程式为______ 。

(4)Al(OH)3经过一系列反应可获得粗铝(含少量Fe与Si杂质),利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图3所示)。
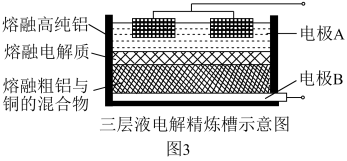
①该装置工作时,电极A作______ 极;阳极的电极反应式为______ 。
②熔融粗铝时,加入铜的作用是______ 。

(1)①“酸浸”时,Al2O3发生反应的离子方程式为
②当硫酸质量分数大于50%时,金属氧化物浸出率明显下降。其原因是
(2)有关金属离子以氢氧化物形式沉淀时离子浓度随pH变化如图1所示。若浸出液不经还原直接与氨水混合,则铝、铁元素分离效果较差,其原因是

(3)沉铝后所得FeSO4用EDTA络合后可用于烟气中NO的吸收,其原理为[Fe(EDTA)]2++2NO
 [Fe(EDTA)(NO)2]2+。EDTA络合吸收结合生物转化去除NO的装置如图2所示,生物反应器中发生反应的离子方程式为
[Fe(EDTA)(NO)2]2+。EDTA络合吸收结合生物转化去除NO的装置如图2所示,生物反应器中发生反应的离子方程式为
(4)Al(OH)3经过一系列反应可获得粗铝(含少量Fe与Si杂质),利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图3所示)。

①该装置工作时,电极A作
②熔融粗铝时,加入铜的作用是
您最近半年使用:0次
解题方法
10 . 一种用硫化铜精矿(含CuS、Cu2S及Fe2O3等)为原料制备CuCl的工艺流程如下:
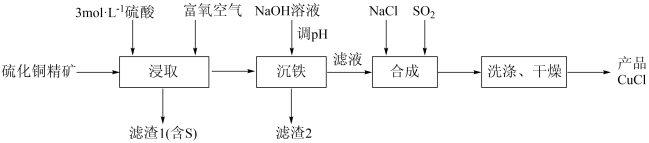
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
如下表所示:
回答下列问题:
(1)“浸取”时,按一定的液固比投料,并加入一定量的催化剂。
①被氧化的元素有___________ (填元素符号)。
② 被浸出的化学方程式为
被浸出的化学方程式为___________ 。
③当浸取时间一定时,不同温度下铜的浸出率与温度的关系如图所示。
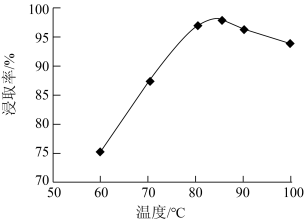
温度低于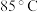 时,温度越高浸出率越大,其原因是
时,温度越高浸出率越大,其原因是___________ ;温度超过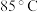 时,温度越高浸出率越小,其原因是
时,温度越高浸出率越小,其原因是___________ 。
(2)“沉铁”时,应将溶液的 范围调整为
范围调整为___________ 。
(3)“合成” 时,发生反应的离子方程式为
时,发生反应的离子方程式为___________ 。
(4)“洗涤”时,依次用 盐酸和乙醇洗,其中用乙醇洗的目的是
盐酸和乙醇洗,其中用乙醇洗的目的是___________ 。

该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的
 如下表所示:
如下表所示: | 金属离子 |  |  |
开始沉淀的 | 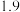 |  |
完全沉淀的 |  |  |
回答下列问题:
(1)“浸取”时,按一定的液固比投料,并加入一定量的催化剂。
①被氧化的元素有
②
 被浸出的化学方程式为
被浸出的化学方程式为③当浸取时间一定时,不同温度下铜的浸出率与温度的关系如图所示。

温度低于
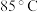 时,温度越高浸出率越大,其原因是
时,温度越高浸出率越大,其原因是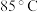 时,温度越高浸出率越小,其原因是
时,温度越高浸出率越小,其原因是(2)“沉铁”时,应将溶液的
 范围调整为
范围调整为(3)“合成”
 时,发生反应的离子方程式为
时,发生反应的离子方程式为(4)“洗涤”时,依次用
 盐酸和乙醇洗,其中用乙醇洗的目的是
盐酸和乙醇洗,其中用乙醇洗的目的是
您最近半年使用:0次



