解题方法
1 . 活性炭吸附法是工业上提碘的方法之一,其流程如下:
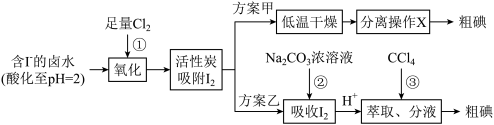
下列说法正确的是

下列说法正确的是
| A.反应①中氧化剂与还原剂物质的量之比为1:1 |
| B.分离操作X的名称是分液 |
| C.反应②是氧化还原反应 |
| D.加淀粉可检验分液后的水溶液中是否含有I- |
您最近一年使用:0次
名校
解题方法
2 . 轻质碳酸钙(CaCO3)是一种重要的化工产品,广泛应用于油漆、塑料、橡胶和造纸等工业。一种以低品位石灰石(含CaCO3、MnCO3、Fe2O3及A12O3)为原料生产高纯度轻质碳酸钙的循环工艺流程如图:
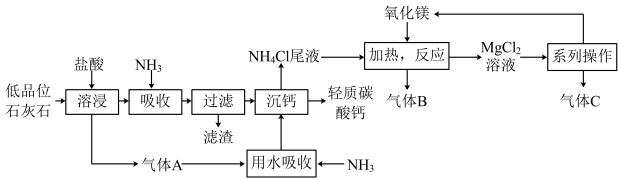
回答下列问题:
(1)气体A为:______ ,滤渣的主要成分是______ 。
(2)“沉钙”过程中发生的化学反应方程式为______ 。
(3)在NH4C1尾液中加入氧化镁并加热,发生反应的离子方程式为______ 。
(4)“系列操作”包含有:______ 。
(5)氧化镁可以在尾液处理中循环使用,______ 和_______ 可循环使用于石灰石制备轻质碳酸钙的过程中。
(6)轻质碳酸钙的工业生产还可以使用“石灰碳化法”:用高品位石灰石焙烧制得生石灰,生石灰消化制得氢氧化钙,再通入二氧化碳制得碳酸钙;本题工艺流程与“石灰碳化法,相比,优点是:______ ,______ 。

回答下列问题:
(1)气体A为:
(2)“沉钙”过程中发生的化学反应方程式为
(3)在NH4C1尾液中加入氧化镁并加热,发生反应的离子方程式为
(4)“系列操作”包含有:
(5)氧化镁可以在尾液处理中循环使用,
(6)轻质碳酸钙的工业生产还可以使用“石灰碳化法”:用高品位石灰石焙烧制得生石灰,生石灰消化制得氢氧化钙,再通入二氧化碳制得碳酸钙;本题工艺流程与“石灰碳化法,相比,优点是:
您最近一年使用:0次
2020-02-14更新
|
556次组卷
|
4卷引用:广东省珠海市2020届高三上学期期末考试化学试题
解题方法
3 . 亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程,下列说法错误的是( )


| A.本工艺电解饱和氯化钠溶液时,阳极主要产生氯气,阴极产生氢气 |
| B.吸收塔内的温度不宜过高 |
| C.气体Y具有还原性 |
D.吸收塔中发生的离子反应为:H2O2+2OH-+2ClO2=2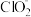 +O2+2H2O +O2+2H2O |
您最近一年使用:0次
解题方法
4 . 过渡金属的单质及化合物很多有催化性能,氯化铜、氯化亚铜经常用作有机合成催化剂。实验室中用氯气与粗铜(杂质只有Fe)反应,制备铜的氯化物的流程如下。
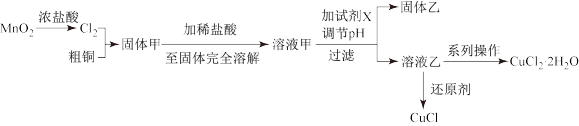
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。
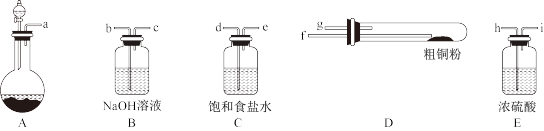
①按气流方向连接各仪器接口顺序是:a→_____ 、_____ →h、i→_____ 、_____ →_____ 。
②本套装置有两个仪器需要加热,加热的顺序为先_____ 后_____ 。
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是_____ ;
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_____ 。
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________ ,Fe3+完全沉淀时溶液的pH为________ 。(提示:lg2=0.3)
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、________ 、_______ 、洗涤、干燥。
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:____________ 。
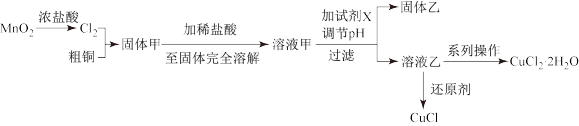
查阅资料:
氯化亚铜:白色微溶于水,在干燥空气中稳定,受潮则易变蓝到棕色,在热水中迅速水解生成氧化铜水合物而呈红色。
氯化铜:从水溶液中结晶时,在26~42℃得到二水物,在15℃以下得到四水物,在15~25.7℃得到三水物,在42℃以上得到一水物,在100℃得到无水物。
(1)现用如图所示的实验仪器及药品制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。

①按气流方向连接各仪器接口顺序是:a→
②本套装置有两个仪器需要加热,加热的顺序为先
(2)分析流程:
①固体甲需要加稀盐酸溶解,其理由是
②溶液甲可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)
a Cu(OH)2 b NH3·H2O c CuO d CuSO4
查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为
③完成溶液乙到纯净CuCl2·2H2O晶体的系列操作步骤为:加少量盐酸、蒸发浓缩、
(3)向溶液乙中加入适当的还原剂(如SO2、N2H4、SnCl2等),并微热得到CuCl沉淀,写出向乙溶液加入N2H4(氧化产物为无毒气体)的离子方程式:
您最近一年使用:0次
名校
解题方法
5 . 钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________ 。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________ 。

⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________ 。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________ 。

⑴钛铁矿在预处理时需要进行粉碎,其原因是
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是

⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是
⑷写出由滤液D生成FePO4的离子方程式
⑸由流程图可知FePO4制备LiFePO4的化学方程式是
您最近一年使用:0次
2020-02-04更新
|
286次组卷
|
3卷引用:2020届高考化学二轮复习大题精准训练 ——化学工艺流程题
解题方法
6 . SPC(2Na2CO3∙3H2O2)具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO4∙10H2O)、H2O2等为原料制备SPC的工艺流程如下:

回答下列问题:
⑴步骤Ⅰ中________  填“有”或“没有”
填“有”或“没有” 发生氧化还原反应。
发生氧化还原反应。
⑵步骤Ⅱ中会生成一种可以循环使用的物质,该物质的化学式为________ 。
⑶步骤Ⅲ中需要加热,发生反应的化学方程式为_________________________________ 。
⑷步骤Ⅴ中,合成时需选择温度为15℃,其目的是___________ 。
⑸SPC的保存方法是_____________________________ 。
⑹过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600g样品,置于250mL锥形瓶中,并用100mL 0.5 mol·L-1硫酸溶解完全,立即用0.02000mol·L-1 KMnO4标准溶液滴定,滴定至终点时溶液颜色为________ ,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24mL。该样品的活性氧含量为_______ %。

回答下列问题:
⑴步骤Ⅰ中
 填“有”或“没有”
填“有”或“没有” 发生氧化还原反应。
发生氧化还原反应。⑵步骤Ⅱ中会生成一种可以循环使用的物质,该物质的化学式为
⑶步骤Ⅲ中需要加热,发生反应的化学方程式为
⑷步骤Ⅴ中,合成时需选择温度为15℃,其目的是
⑸SPC的保存方法是
⑹过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600g样品,置于250mL锥形瓶中,并用100mL 0.5 mol·L-1硫酸溶解完全,立即用0.02000mol·L-1 KMnO4标准溶液滴定,滴定至终点时溶液颜色为
您最近一年使用:0次
解题方法
7 . 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示:
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
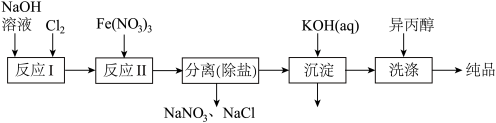
①洗涤粗品时选用异丙醇而不用水的理由是:________ 。
②反应II的离子方程式为___________ 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为_______ 它能净水的原因是_______ 。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:__________ 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠____ (填“大”或“小”)。
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比________
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:

①洗涤粗品时选用异丙醇而不用水的理由是:
②反应II的离子方程式为
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是:
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠
(3)干法制备K2FeO4的反应中氧化剂和还原剂的物质的量之比
您最近一年使用:0次
解题方法
8 . 某厂用闪锌矿制备锌及颜料 A(红棕色固体)的工艺流程如下图所示。(闪锌矿的主要成分为 ZnS,同时含有 10%的 FeS 及少量 CuS)

已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4不溶于水及硫酸。Fe(HSO3)2难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是_______________________________________________________ 。
(2)“滤液 1”中选用足量的 H2O2,理由是_____________________ 。假设“②调节 pH"前,滤液 1 中 c(Fe3+)=1mol・L-1,则 Fe3+完全沉淀时的 pH 至少为____________________ 。(离子浓度≤ 10-6mol·L-1规为完全除去)。
(3)“滤渣 3”的成分为__________________________________ (写化学式)。
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案_______________________________________________________ 。
(5)“气体 A”与“浸渣 1”反应的化学方程式为_______________________________________________________ 。

已知:①闪锌矿在焙烧时会生成副产物 ZnFeO4,ZnFeO4不溶于水及硫酸。Fe(HSO3)2难溶于水。②Ksp[Fe(OH)3]=1×10-39。
完成下列问题
(1)闪锌矿粉碎的目的是
(2)“滤液 1”中选用足量的 H2O2,理由是
(3)“滤渣 3”的成分为
(4)设计一种检验“颜料 A”中是否含有 Fe2+的实验方案
(5)“气体 A”与“浸渣 1”反应的化学方程式为
您最近一年使用:0次
2020-01-01更新
|
495次组卷
|
2卷引用:河南省郑州市2020届高三第一次模拟考试化学试题
名校
解题方法
9 . 炼铁厂以赤铁矿石、焦炭、石灰石、空气等为原料炼铁,主要反应过程如图所示:
请根据题图和所学知识判断,下列说法错误的是( )

请根据题图和所学知识判断,下列说法错误的是( )
| A.生铁属于混合物 |
| B.原料中焦炭的作用是提供能量和制取一氧化碳 |
| C.炼铁过程中所有元素的化合价均发生了改变 |
| D.工业炼铁的设备是高炉 |
您最近一年使用:0次
解题方法
10 . 磷化氢(PH3)是一种剧毒气体,是常用的高效熏蒸杀虫剂,也是一种电子工业原料.
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为______
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液______ 变化,可准确测定空气中微量的PH3;其中HgCl2溶于水,所得溶液几乎不导电,则HgCl2属于 ______ (填“共价”或“离子”)化合物.
(3)工业制备PH3的流程如图1所示:

图1
①亚磷酸属于______ 元酸;
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)=______ .
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为______ ;含有水蒸气时可加快PH3的氧化过程,用离子方程式表示原因: ______ .
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
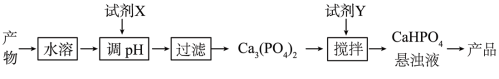
图2
①试剂X为______ (填化学式);
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH______ 7(填“>”、“=”或“<”),通过计算说明理由 ______ .
(1)在密闭粮仓放置的磷化铝(AIP)片剂,遇水蒸气放出PH3气体,化学方程式为
(2)利用反应PH3+3HgCl2=P(HgCl)3↓+3HCl,通过测定溶液
(3)工业制备PH3的流程如图1所示:

图1
①亚磷酸属于
②当反应I生成的n(NaH2PO2):n(Na2HPO3)=3:1时,参加反应的n(P4):n(NaOH)=
(4)用漂白粉可将PH3氧化为H3PO4,化学方程式为
(5)从(4)中的反应产物中回收磷酸氢钙(CaHPO4)的方法如图2:
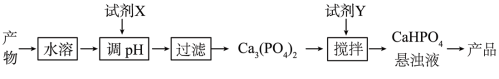
图2
①试剂X为
②已知25℃时,H3PO4的Ka1=7.5×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13.
CaHPO4悬浊液pH
您最近一年使用:0次
2019-12-08更新
|
289次组卷
|
3卷引用:福建省2020届高三化学大题练——化工流程为载体的综合实验



