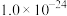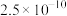名校
解题方法
1 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)写出基态 价电子的轨道表示式
价电子的轨道表示式___________ 。第三周期主族元素中,第一电离能比Mg元素高的有___________ 种。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中S元素的化合价为
),其中S元素的化合价为___________ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、 ;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被
;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ;再加入石灰乳,所得滤渣中主要成分是 、
、___________ (填化学式)。
(4)①将“钴镍渣”酸溶后,先加入NaClO溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
②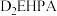 (以
(以 表示)为一种有效的金属萃取剂,不溶于水。用
表示)为一种有效的金属萃取剂,不溶于水。用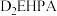 萃取酸浸液中的镍:
萃取酸浸液中的镍: ,已知萃取前溶液pH=3,
,已知萃取前溶液pH=3,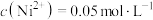 ,萃取完成后溶液pH=1,则镍的萃取率=
,萃取完成后溶液pH=1,则镍的萃取率=___________ [萃取率= ]。
]。
(5)一种钴镍氧化物的立方晶胞结构如图,晶胞结构中有两种八面体空隙,一种全部由O构成(用x表示),另一种由O和Ni共同构成(用y表示),则晶体中x和y的数目之比为___________ ;已知晶胞参数为a pm,晶胞密度为 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数
___________ (列出计算式)。
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)写出基态
 价电子的轨道表示式
价电子的轨道表示式(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中S元素的化合价为
),其中S元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、 ;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被
;“氧化”时,先通入足量混合气,溶液中的正二价铁元素Fe(Ⅱ)被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、(4)①将“钴镍渣”酸溶后,先加入NaClO溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:②
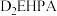 (以
(以 表示)为一种有效的金属萃取剂,不溶于水。用
表示)为一种有效的金属萃取剂,不溶于水。用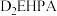 萃取酸浸液中的镍:
萃取酸浸液中的镍: ,已知萃取前溶液pH=3,
,已知萃取前溶液pH=3,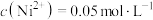 ,萃取完成后溶液pH=1,则镍的萃取率=
,萃取完成后溶液pH=1,则镍的萃取率= ]。
]。(5)一种钴镍氧化物的立方晶胞结构如图,晶胞结构中有两种八面体空隙,一种全部由O构成(用x表示),另一种由O和Ni共同构成(用y表示),则晶体中x和y的数目之比为
 ,据此推断阿伏加德罗常数
,据此推断阿伏加德罗常数

您最近半年使用:0次
2024高三下·全国·专题练习
解题方法
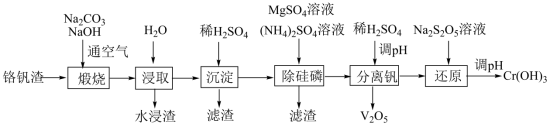
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示: 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________ 。
(2)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)“沉淀”步骤调pH到弱碱性,主要除去的杂质是
(2)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+在碱性条件下,溶解为VO
或VO3+在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
您最近半年使用:0次
解题方法
3 . 利用硫酸渣(主要含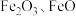 ,杂质为
,杂质为 和
和 等)生产铁基颜料铁黄
等)生产铁基颜料铁黄 的制备流程如图:
的制备流程如图:
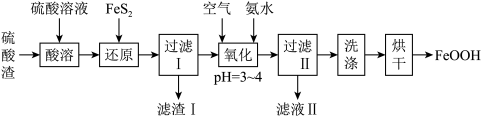
(1)滤渣I的主要成分是 和
和_______ (填化学式)。
(2) 被
被 还原的离子方程式为
还原的离子方程式为_______ 。
(3)“氧化”中,生成 的离子方程式为
的离子方程式为_______ 。
(4)“氧化时,用 浓溶液代替空气氧化
浓溶液代替空气氧化 浆液,虽然能缩短氧化时间,缺点可能是
浆液,虽然能缩短氧化时间,缺点可能是_______ 。
(5)“过滤II”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是_______ 。
(6)实验测得反应溶液的 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。

①反应温度宜选择_______ ;
②氧化时应控制 的合理范围是4.5左右,
的合理范围是4.5左右, 过小或过大均会导致铁黄产率较低,其可能原因是
过小或过大均会导致铁黄产率较低,其可能原因是_______ 。
(7)欲从硫铁矿烧渣(主要成分为 )出发制备绿矾(
)出发制备绿矾( 晶体),请设计实验方案:
晶体),请设计实验方案:_______ 。[相关金属离子生成氢氧化物沉淀的 (开始沉淀的
(开始沉淀的 按金属离子浓度为
按金属离子浓度为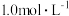 计算如下表所示),须使用的试剂:铁粉、稀硫酸和
计算如下表所示),须使用的试剂:铁粉、稀硫酸和 溶液]。
溶液]。
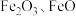 ,杂质为
,杂质为 和
和 等)生产铁基颜料铁黄
等)生产铁基颜料铁黄 的制备流程如图:
的制备流程如图:
(1)滤渣I的主要成分是
 和
和(2)
 被
被 还原的离子方程式为
还原的离子方程式为(3)“氧化”中,生成
 的离子方程式为
的离子方程式为(4)“氧化时,用
 浓溶液代替空气氧化
浓溶液代替空气氧化 浆液,虽然能缩短氧化时间,缺点可能是
浆液,虽然能缩短氧化时间,缺点可能是(5)“过滤II”所得铁黄在洗涤过程中,检验铁黄表面已洗涤干净的操作是
(6)实验测得反应溶液的
 、温度对铁黄产率的影响如图1、图2所示。
、温度对铁黄产率的影响如图1、图2所示。
①反应温度宜选择
②氧化时应控制
 的合理范围是4.5左右,
的合理范围是4.5左右, 过小或过大均会导致铁黄产率较低,其可能原因是
过小或过大均会导致铁黄产率较低,其可能原因是(7)欲从硫铁矿烧渣(主要成分为
 )出发制备绿矾(
)出发制备绿矾( 晶体),请设计实验方案:
晶体),请设计实验方案: (开始沉淀的
(开始沉淀的 按金属离子浓度为
按金属离子浓度为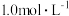 计算如下表所示),须使用的试剂:铁粉、稀硫酸和
计算如下表所示),须使用的试剂:铁粉、稀硫酸和 溶液]。
溶液]。| 金属离子 | 开始沉淀的 | 沉淀完全的 |
 | 1.1 | 3.2 |
 | 3.0 | 5.0 |
 | 5.8 | 8.8 |
您最近半年使用:0次
名校
解题方法
4 . 用某铜矿(主要含CuS、FeO)制备 的一种工艺流程如图:
的一种工艺流程如图:
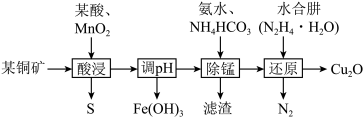
已知:①常温下,
②常温下,金属离子浓度小于 时,认为沉淀完全;
时,认为沉淀完全;
③水合肼溶液呈碱性。
请回答下列问题:
(1)基态O的电子排布图为______ 。
(2)“酸浸”时加入的某酸常选择______ (填化学式),加入酸溶解后,再加入 发生的主要离子方程式为
发生的主要离子方程式为______ 。
(3)根据表格数据,调节pH的最大值为______ ,此时溶液中 的浓度为
的浓度为______ 。
(4)用化学用语表示水合肼溶液呈碱性的原因:______ 。
(5)“还原”前Cu元素以 的形式存在,写出还原过程中的离子方程式:
的形式存在,写出还原过程中的离子方程式:______ 。
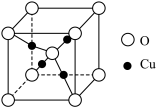
(6) 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为
的配位数为______ ;若该氧化物的密度为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
______  (列出计算式)。
(列出计算式)。
 的一种工艺流程如图:
的一种工艺流程如图:
已知:①常温下,
金属氢氧化物 |
|
|
|
|
开始沉淀的pH | 1.9 | 7.5 | 5.0 | 8.8 |
沉淀完全的pH | 3.2 | 9.7 | 6.5 | 10.4 |
 时,认为沉淀完全;
时,认为沉淀完全;③水合肼溶液呈碱性。
请回答下列问题:
(1)基态O的电子排布图为
(2)“酸浸”时加入的某酸常选择
 发生的主要离子方程式为
发生的主要离子方程式为(3)根据表格数据,调节pH的最大值为
 的浓度为
的浓度为(4)用化学用语表示水合肼溶液呈碱性的原因:
(5)“还原”前Cu元素以
 的形式存在,写出还原过程中的离子方程式:
的形式存在,写出还原过程中的离子方程式:(6)
 立方晶胞结构如图所示,则
立方晶胞结构如图所示,则 的配位数为
的配位数为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则 晶体的摩尔体积
晶体的摩尔体积
 (列出计算式)。
(列出计算式)。
您最近半年使用:0次
名校
解题方法
5 . 一种高硫锰矿的主要成分为 ,主要杂质为
,主要杂质为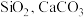 ,还含有少量
,还含有少量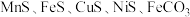 等,其中
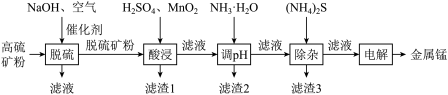
等,其中 含量较大。研究人员设计了如下流程,制得了金属锰。
含量较大。研究人员设计了如下流程,制得了金属锰。
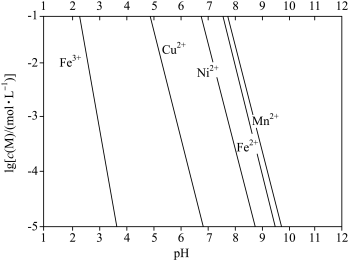
已知:①金属离子的 与溶液pH的关系如下图所示:
与溶液pH的关系如下图所示:
②金属硫化物的溶度积常数如下表。
金属硫化物 |
|
|
|
|
|
|
|
|
|
回答下列问题。
(1)碱性溶液中,在催化剂存在下通空气氧化脱硫,硫化物中的硫元素被氧化为单质,铁元素变成氢氧化铁。写出该过程中硫化亚铁反应的化学方程式
(2)根据矿物组成,脱硫时能被
 溶解的物质是
溶解的物质是(3)若未经脱硫直接酸浸,会产生的污染物是
(4)酸浸时主要含锰组分发生反应的化学方程式为
 的作用是
的作用是(5)调溶液
 到5左右,滤渣2的主要成分是
到5左右,滤渣2的主要成分是 除去的主要离子是
除去的主要离子是(6)除杂后的
 溶液通过电解制得金属锰,若生成
溶液通过电解制得金属锰,若生成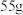 金属锰,则阳极放出的气体在标准状况下的体积为
金属锰,则阳极放出的气体在标准状况下的体积为
您最近半年使用:0次
名校
解题方法
6 . 三氯化锑(SbCl3)用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为Sb2S3,还含有As2S3、PbS、CuO和SiO2等)为原料制备SbCl3的工艺流程如图:

已知:① 具有强氧化性,“浸出液”主要含盐酸和:
具有强氧化性,“浸出液”主要含盐酸和: ,还含
,还含 、
、 、
、 和
和 等杂质;
等杂质;
②常温下, ,
,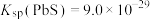 ;
;
③溶液中离子浓度小于或等于 时,认为该离子沉淀完全。
时,认为该离子沉淀完全。
回答下列问题:
(1)Cu位于元素周期表第
(2)“滤渣1”的主要成分有S和
(3)“浸出液”中加入适量Sb的目的是
(4)当
 、
、 共沉淀时,溶液中
共沉淀时,溶液中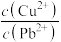 =
=(5)“除砷”时,氧化产物为
 ,则
,则 (可溶于水)与
(可溶于水)与 反应的离子方程式为
反应的离子方程式为(6)已知:“电解”
 溶液时有
溶液时有 生成。则上述流程中可循环利用的物质有
生成。则上述流程中可循环利用的物质有
您最近半年使用:0次
解题方法
7 . 硫酸镍一般用于电镀、催化剂制备和医药制造等领域。电镀污泥中主要含有Cr2O3、CuO、NiO、Al2O3、Fe2O3和SiO2等物质。一种从电镀污泥制备回收金属铜和制备硫酸镍晶体的工艺流程如图1,回答下列问题:
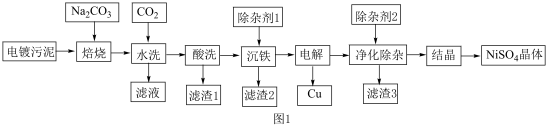
已知:①“焙烧”时Cr2O3和Al2O3分别转化为Na2CrO4、NaAlO2
②Na2CrO4溶液中存在平衡: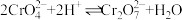
(1)“焙烧”时,Cr2O3参与反应的化学方程式为___________ 。
(2)提高“酸洗”的速率的措施为___________ 、___________ (写出两种措施)。
(3)“酸洗”后,滤渣1的化学式为___________ 。
(4)“滤液”主要成分是含有少量重金属阳离子的Na2CrO4溶液,除杂装置如图2所示
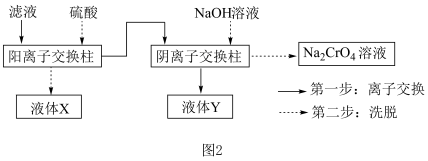
已知:图中离子交换柱原理为HR+M+ MR+H+;2ROH+CrO
MR+H+;2ROH+CrO
 R2CrO4+2OH-
R2CrO4+2OH-
则液体X的溶质主要是___________ (填化学式),液体Y是___________ (填名称)。
(5)为确定硫酸镍晶体中含有的结晶水,称取纯化后的硫酸镍晶体5.26g,加热至完全失去结晶水,固体减重2.16g,则该晶体的化学式为___________ 。

已知:①“焙烧”时Cr2O3和Al2O3分别转化为Na2CrO4、NaAlO2
②Na2CrO4溶液中存在平衡:
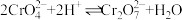
(1)“焙烧”时,Cr2O3参与反应的化学方程式为
(2)提高“酸洗”的速率的措施为
(3)“酸洗”后,滤渣1的化学式为
(4)“滤液”主要成分是含有少量重金属阳离子的Na2CrO4溶液,除杂装置如图2所示

已知:图中离子交换柱原理为HR+M+
 MR+H+;2ROH+CrO
MR+H+;2ROH+CrO
 R2CrO4+2OH-
R2CrO4+2OH-则液体X的溶质主要是
(5)为确定硫酸镍晶体中含有的结晶水,称取纯化后的硫酸镍晶体5.26g,加热至完全失去结晶水,固体减重2.16g,则该晶体的化学式为
您最近半年使用:0次
名校
解题方法
8 . 某科研小组制备了新型锂离子电池电极材料-ZnLix/Li3N。科研小组以废旧锌锰电池的锌皮为原料合成该电极材料,简易流程如下:

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
回答下列问题:
(1)提高“酸浸”速率的措施有_____ (答一条即可),“调pH”的范围为_____ 。
(2)“沉锌”的离子方程式为_____ 。
(3)系列操作包括的操作步骤有_____ 、过滤、洗涤、干燥
(4)SOCl2的作用是_____ (用化学方程式表示)。
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
如果氧化剂X选择硝酸,其后果是_____ 和会产生大气污染物。从下列物质中选择氧化剂X,杂质除去率最高的是_____ (填标号)。
A.NaClO B.Cl2 C.O2 D.O3
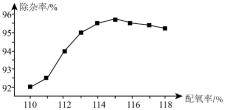
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:_____ 。

已知:①锌皮的主要成分为Zn和ZnO,还含少量NH4Cl、Fe、Mn2O3等。
②Mn2O3在酸性条件下转化成Mn2+和MnO2;SOCl2的沸点为78.8°C.
③已知几种金属离子形成氢氧化物沉淀时的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 2.2 | 7.5 | 8.0 | 6.5 |
| 完全沉淀的pH | 3.5 | 9.5 | 10.8 | 8.5 |
(1)提高“酸浸”速率的措施有
(2)“沉锌”的离子方程式为
(3)系列操作包括的操作步骤有
(4)SOCl2的作用是
(5)已知部分信息如下:
①自发的电池反应实质是氧化还原反应,可以拆分为两个半反应,正极、负极的标准电极电势分别表示为φ0(+)和φ0(-);标准电动势E0=φ0(+)-φ0(-)。例如,2Ag+Hg2+=2Ag++Hg的E0=φ0(Hg2+/Hg)-φ0(Ag+/Ag)。
②E0>0,反应能自发进行,E0>0.2,反应趋向完全反应。
③在酸性介质中几种半反应的电极电势数据如下表所示:
| 物质 | HClO/Cl- | Cl2/Cl- | O2/H2O | O3/O2 | HNO3/NO | Fe3+/Fe2+ | MnO2/Mn2+ |
| φ0 | 1.482 | 1.358 | 1.229 | 2.076 | 0.983 | 0.771 | 1.224 |
A.NaClO B.Cl2 C.O2 D.O3
工业生产中,氧化剂的实际用量和理论计算量之间的比值称为配氧率。“氧化除锰”中除杂率与配氧率的关系如图所示。试解释配氧率选择115%时除杂率最高的原因:

您最近半年使用:0次
名校
解题方法
9 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为____________ (答出一条即可)。
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸( ),其中
),其中 元素的化合价为
元素的化合价为______ 。
(3)已知: 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素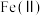 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ ;再加入石灰乳,所得滤渣中主要成分是 、
、______ 。
②通入混合气中 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是____________ ; 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是____________ 。 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成
 沉淀的离子方程式:
沉淀的离子方程式:______ 。
②若“镍钴分离”后溶液中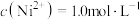 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中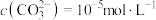 ,则沉镍率=
,则沉镍率=______ 。[已知: ,沉镍率=
,沉镍率=
 、
、 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。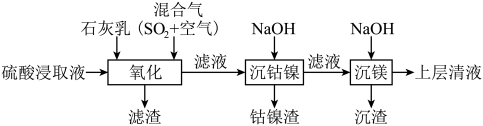
(1)工业上用一定浓度的硫酸浸取已粉碎的镍钴矿并不断搅拌,提高浸取速率的方法为
(2)“氧化”时,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(
 ),其中
),其中 元素的化合价为
元素的化合价为(3)已知:
 的电离方程式为
的电离方程式为 、
、
①“氧化”时,先通入足量混合气,溶液中的正二价铁元素
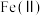 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 、
、②通入混合气中
 的体积分数与
的体积分数与 氧化率随时间的变化关系如图所示,若混合气中不添加
氧化率随时间的变化关系如图所示,若混合气中不添加 ,相同时间内
,相同时间内 氧化率较低的原因是
氧化率较低的原因是 的体积分数高于9.0%时,相同时间内
的体积分数高于9.0%时,相同时间内 氧化率开始降低的原因是
氧化率开始降低的原因是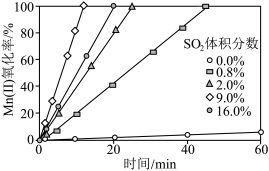
 溶液进行“钴镍分离”,写出“钴镍分离”反应生成
溶液进行“钴镍分离”,写出“钴镍分离”反应生成 沉淀的离子方程式:
沉淀的离子方程式:②若“镍钴分离”后溶液中
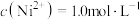 ,加入
,加入 溶液“沉镍”后的滤液中
溶液“沉镍”后的滤液中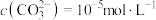 ,则沉镍率=
,则沉镍率= ,沉镍率=
,沉镍率=
您最近半年使用:0次
2024-02-17更新
|
441次组卷
|
4卷引用:安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题
安徽省合肥市第一中学2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学
解题方法
10 . 利用以下流程回收废旧电池正极材料(主要含 、
、 等)中
等)中 金属资源.
金属资源.
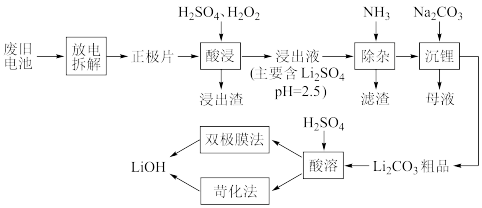
已知:i. 难溶于水可溶于酸,
难溶于水可溶于酸, 、
、 微溶于水.
微溶于水.
ii.25℃时,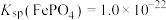 ,
, 的
的 ,
, ,
, .
.
(1)“放电拆解”过程中 从
从__________ (填“正”或“负”,下同)极经电解质溶液移向__________ 极.
(2)“酸浸”过程生成 的化学方程式为
的化学方程式为_________ .
(3)“浸出液”检测出微量 ,此时
,此时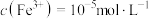 ,则溶液中
,则溶液中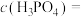
________ .
(4) 溶解度随温度升高而降低.“沉锂”后为提高
溶解度随温度升高而降低.“沉锂”后为提高 的析出量和纯度应进行的操作为
的析出量和纯度应进行的操作为_________ .
(5)“双极膜法”获得 的原理如图.
的原理如图.

① 从
从__________ (选填“一室”“二室”或“三室”)获得.
②该法总反应化学方程式为__________ .
③该法产生可在流程中循环使用的物质为__________ (填化学式).
(6)“苛化法”获得 的流程如图.
的流程如图.
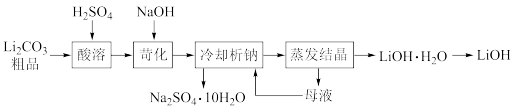
下列有关苛化法和双极膜法说法正确的是____________(填标号).
 、
、 等)中
等)中 金属资源.
金属资源.
已知:i.
 难溶于水可溶于酸,
难溶于水可溶于酸, 、
、 微溶于水.
微溶于水.ii.25℃时,
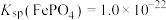 ,
, 的
的 ,
, ,
, .
.(1)“放电拆解”过程中
 从
从(2)“酸浸”过程生成
 的化学方程式为
的化学方程式为(3)“浸出液”检测出微量
 ,此时
,此时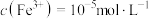 ,则溶液中
,则溶液中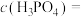
(4)
 溶解度随温度升高而降低.“沉锂”后为提高
溶解度随温度升高而降低.“沉锂”后为提高 的析出量和纯度应进行的操作为
的析出量和纯度应进行的操作为(5)“双极膜法”获得
 的原理如图.
的原理如图.
①
 从
从②该法总反应化学方程式为
③该法产生可在流程中循环使用的物质为
(6)“苛化法”获得
 的流程如图.
的流程如图.
下列有关苛化法和双极膜法说法正确的是____________(填标号).
| A.相较于苛化法,双极膜法工艺更简单 | B.相较于苛化法,双极膜法副产物之一为清洁能源 |
| C.相较于双极膜法,苛化法的产物纯度更高 | D.相较于双极膜法,苛化法耗酸量更少 |
您最近半年使用:0次