解题方法
1 . 磷酸锌常用作氯化橡胶合成高分子材料的阻燃剂。工业上利用烧渣灰( 主要含ZnO,还含少量FeO、Al2O3、 CuO 及SiO2)为原料制取磷酸锌的工艺流程如图所示:
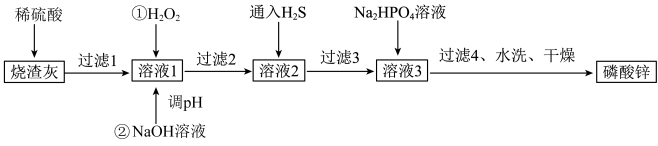
已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
回答下列问题:
(1)基态锌原子的价电子排布式为_____________ 。
(2)加入H2O2的作用是___________________________ 。
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是___________ 。
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:_________________ 。
(5)洗涤磷酸锌沉淀时应选用________ (填“冷水”或“热水”),洗涤沉淀的操作是________________ 。
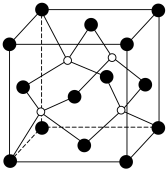
(6)图是碳化硅的晶胞结构,其晶体类型属于___________ 晶体。若碳化硅晶胞边长为a pm,阿伏加德罗常数的值为NA,则碳化硅晶体的密度为______________ g·cm-3 (列出计算式即可)。

已知:①Zn3(PO4)2在水中几乎不溶,其在水中的溶解度随温度的升高而降低;
②“溶液1”中几种金属离子开始沉淀与沉淀完全的pH如表所示:
| 金属离子 | Al3+ | Fe3+ | Cu2+ | Zn2+ |
| 开始沉淀的pH | 3.0 | 2.2 | 5.4. | 6.5 |
| 完全沉淀的pH | 5.0 | 3.6 | 6.7 | 8.5 |
(1)基态锌原子的价电子排布式为
(2)加入H2O2的作用是
(3)经过滤2得到滤渣的主要成分是Fe( OH)3和Al(OH)3,则用NaOH溶液调节pH的范围是
(4)通入H2S的目的是除去Cu2+,写出该反应的离子方程式:
(5)洗涤磷酸锌沉淀时应选用
(6)图是碳化硅的晶胞结构,其晶体类型属于

您最近一年使用:0次
解题方法
2 . 碱式碳酸钴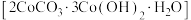 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:

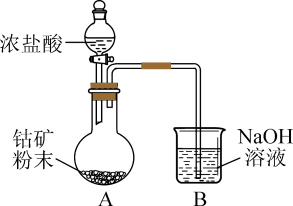
(1)还原时使用的装置如图所示。 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:___________ 。
(2)为控制装置A中应加入盐酸的量,需测定钴矿中 的含量。准确称取
的含量。准确称取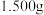 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。
①滴定终点的现象是___________ ;
②计算钴矿中 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程___________ 。
(3)补充完整由装置A反应后的溶液提取 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应;___________ ,得到 溶液。
溶液。
[已知:①在浓 溶液中会发生反应:
溶液中会发生反应: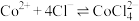 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
(4)沉钴步骤中的试剂是 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。
①适宜的加料方式为___________ 。
A.将 溶液加入到
溶液加入到 溶液中
溶液中
B.将 溶液加入到
溶液加入到 溶液中
溶液中
②写出沉钴时生成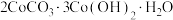 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:___________ 。
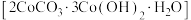 可用于制含钴催化剂。实验小组以某种钴矿(主要含
可用于制含钴催化剂。实验小组以某种钴矿(主要含 及少量
及少量 、
、 )制取碱式碳酸钴的过程如下:
)制取碱式碳酸钴的过程如下:
(1)还原时使用的装置如图所示。
 溶液的作用是吸收
溶液的作用是吸收 ,装置A反应后烧瓶溶液中主要存在的阳离子是
,装置A反应后烧瓶溶液中主要存在的阳离子是 、
、 和
和 。写出装置A中
。写出装置A中 所发生反应的化学方程式:
所发生反应的化学方程式:
(2)为控制装置A中应加入盐酸的量,需测定钴矿中
 的含量。准确称取
的含量。准确称取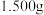 钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应(
钴矿粉末于锥形瓶中,加入硫酸和过量的KI溶液,充分反应( 和
和 不与
不与 反应)。向锥形瓶中滴加2滴淀粉溶液,用
反应)。向锥形瓶中滴加2滴淀粉溶液,用 的
的 标准溶液滴定,恰好完全反应时消耗
标准溶液滴定,恰好完全反应时消耗 标准溶液
标准溶液 。滴定过程中发生的反应为
。滴定过程中发生的反应为 。
。①滴定终点的现象是
②计算钴矿中
 的计算钴矿中
的计算钴矿中 的质量分数,并写出计算过程
的质量分数,并写出计算过程(3)补充完整由装置A反应后的溶液提取
 的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量
的实验方案:将装置A烧瓶中的混合物进行过滤,向所得滤液中加入足量 固体,充分反应;
固体,充分反应; 溶液。
溶液。[已知:①在浓
 溶液中会发生反应:
溶液中会发生反应: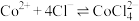 ;②
;② 易溶解于一种有机胺溶剂(密度比水小,难溶于水),
易溶解于一种有机胺溶剂(密度比水小,难溶于水), 和
和 不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水]
不溶。实验中可选用的试剂有有机胺溶剂、蒸馏水](4)沉钴步骤中的试剂是
 溶液和
溶液和 溶液,合理混合得到碱式碳酸钴沉淀。
溶液,合理混合得到碱式碳酸钴沉淀。①适宜的加料方式为
A.将
 溶液加入到
溶液加入到 溶液中
溶液中B.将
 溶液加入到
溶液加入到 溶液中
溶液中②写出沉钴时生成
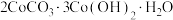 沉淀和
沉淀和 时的离子方程式:
时的离子方程式:
您最近一年使用:0次
解题方法
3 . 合质金,也称矿产金,大多与其他金属伴生,由于产于不同的矿山而所含的其他金属成分不同,一般金含量在50%~90%之间。以高银合质金作为原料(含有Au、Ag、Cu、Fe等单质及Se、Te的化合物)快速提取金和银的工艺流程如图所示:

回答下列问题:
(1)“浸取”前需将高银合质金原料粉化造粒,其目的是_____ 。“浸取”时,单质Ag溶解的化学方程式为_____ 。
(2)熔炼电解的阴极反应式为_____ 。
(3)已知:25℃时, 。实验测得,沉银前浸液中
。实验测得,沉银前浸液中 ,现取50mL浸液,加50mL0.020mol/LNaCl溶液沉银,忽略溶液体积变化,完全沉银后,溶液中
,现取50mL浸液,加50mL0.020mol/LNaCl溶液沉银,忽略溶液体积变化,完全沉银后,溶液中
_____ ,若继续加入50mL0.001mol/LNaCl溶液,是否有白色沉淀生成:_____ (填“是”或“否”)。
(4)氯化工艺中盐酸和NaClO3接触会产生氯自由基 ,
, 具有强氧化性,能与Au反应生成
具有强氧化性,能与Au反应生成 ,写出产生氯自由基
,写出产生氯自由基 的离子方程式:
的离子方程式:_____ 。
(5)还原时,在滴加还原剂Na2S2O5溶液,发生反应的离子方程式:
① ;
;
② 。
。
请写出反应②配平后的离子方程式:_____ ,当转移12mol电子时,生成Au的质量为_____ g。

回答下列问题:
(1)“浸取”前需将高银合质金原料粉化造粒,其目的是
(2)熔炼电解的阴极反应式为
(3)已知:25℃时,
 。实验测得,沉银前浸液中
。实验测得,沉银前浸液中 ,现取50mL浸液,加50mL0.020mol/LNaCl溶液沉银,忽略溶液体积变化,完全沉银后,溶液中
,现取50mL浸液,加50mL0.020mol/LNaCl溶液沉银,忽略溶液体积变化,完全沉银后,溶液中
(4)氯化工艺中盐酸和NaClO3接触会产生氯自由基
 ,
, 具有强氧化性,能与Au反应生成
具有强氧化性,能与Au反应生成 ,写出产生氯自由基
,写出产生氯自由基 的离子方程式:
的离子方程式:(5)还原时,在滴加还原剂Na2S2O5溶液,发生反应的离子方程式:
①
 ;
;②
 。
。请写出反应②配平后的离子方程式:
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
4 . 某无色溶液中含有Na+、Ag+、Ba2+、Al3+、AlO 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种。现取该溶液进行如下实验:
中的若干种。现取该溶液进行如下实验:
A.取适量溶液,加入过量盐酸,有气体甲生成,并得到澄清溶液;
B.在A所得溶液中再加入过量的碳酸氢铵溶液,有气体甲生成,同时析出白色沉淀a;
C.在B所得溶液中加入过量Ba(OH)2溶液,有气体乙生成,同时析出白色沉淀b。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是_______ ;一定存在的离子是_______ 。
(2)气体甲为_______ (填化学式,下同),白色沉淀a为_______ ,气体乙为_______ 。
(3)判断沉淀b成分的方法是_______ 。
 、MnO
、MnO 、CO
、CO 、SO
、SO 中的若干种。现取该溶液进行如下实验:
中的若干种。现取该溶液进行如下实验:A.取适量溶液,加入过量盐酸,有气体甲生成,并得到澄清溶液;
B.在A所得溶液中再加入过量的碳酸氢铵溶液,有气体甲生成,同时析出白色沉淀a;
C.在B所得溶液中加入过量Ba(OH)2溶液,有气体乙生成,同时析出白色沉淀b。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是
(2)气体甲为
(3)判断沉淀b成分的方法是
您最近一年使用:0次
名校
解题方法
5 . 碲在冶金工业中用途广泛,被誉为现代工业的维生素。某精炼铜的阳极泥经过处理后的主要成分为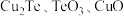 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下:

已知:①高温熔烧后的产物为 和
和 ;
;
② 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;
③ 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为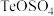 和
和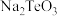
两种易溶于水的盐 。
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析 的产物是
的产物是 而不是
而不是 的原因为
的原因为___________ 。
(2)“酸化”时还需要加入一定量的 ,其目的是
,其目的是___________ 。
(3)“还原”时发生反应的离子方程式为___________ 。
(4)碱浸后铜元素的存在形式为___________ (写化学式)。
(5)“电解”制 的原理如图,其中N与电源的
的原理如图,其中N与电源的___________ (填“正极”或“负极”)相连:与M相连的惰性电极上发生电极反应式为___________ 。

(6)胆矾的结构如图所示。下列说法正确的是___________。

(7) 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为___________ ;已知晶胞边长为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。

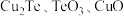 等,从中回收碲和胆矾的工艺如下:
等,从中回收碲和胆矾的工艺如下:
已知:①高温熔烧后的产物为
 和
和 ;
;②
 在酸性条件下会发生歧化反应;
在酸性条件下会发生歧化反应;③
 元素在酸化和碱浸后分别转化为
元素在酸化和碱浸后分别转化为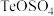 和
和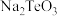
回答下列问题:
(1)“高温焙烧”时,从结构的角度分析
 的产物是
的产物是 而不是
而不是 的原因为
的原因为(2)“酸化”时还需要加入一定量的
 ,其目的是
,其目的是(3)“还原”时发生反应的离子方程式为
(4)碱浸后铜元素的存在形式为
(5)“电解”制
 的原理如图,其中N与电源的
的原理如图,其中N与电源的
(6)胆矾的结构如图所示。下列说法正确的是___________。

| A.胆矾晶体中含有离子键、配位键、氢键等化学键 | B.胆矾属于离子晶体 |
C. 的空间结构为正四面体形 的空间结构为正四面体形 | D.电负性O>S,第一电离能 |
 的立方晶胞结构如图。其中
的立方晶胞结构如图。其中 的配位数为
的配位数为 ,
, 为阿伏伽德罗常数的值,则该晶体的密度为
为阿伏伽德罗常数的值,则该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
2023-06-22更新
|
473次组卷
|
3卷引用:广东省汕头市潮阳区2023届高三下学期三模化学试题
名校
解题方法
6 . 废钒催化剂的回收、提取和再利用具有显著的经济效益和环保效益。从某种废钒催化剂(含SiO2、VOSO4、V2O3、Fe2O3、Al2O3、有机物等)中回收制备V2O5的工艺流程如下:
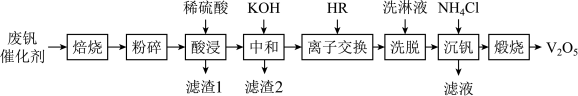
回答下列问题:
(1)工业生产中的钒催化剂一般以疏松多孔的硅藻土为载体,该做法的优点是_______ 。
(2)在空气中“焙烧”废钒催化剂的目的是_______ (填选项标号)。
A.改变发钒催化剂的结构,便于后续“酸浸”
B.除去废钒催化剂中的有机杂质
C.使废钒催化剂中的杂质氧化,便于除去
(3)在不同pH的溶液中,+ 5价钒元素的存在形式不同,如下:
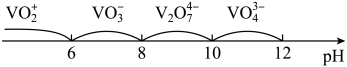
①“酸浸”时,V2O5转化为VO 的离子方程式为
的离子方程式为_______ 。
②“中和”时,调节溶液pH为7左右的目的为_______ 和_______ 。
(4)“离子交换”效率与钒溶液通过离子交换树脂的流速及钒淬液的pH有关。
①钒溶液通过离子交换树脂的流速过慢,会导致溶液滞留,离子交换时间太长;而流速过快也会影响离子交换效果,其原因是_______ 。
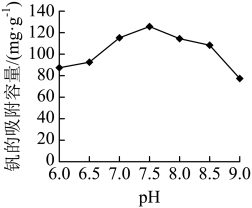
②钒吸附液的pH对吸附效果的影响如下图所示,“离子交换”时最适宜的pH=_______ 。
(5)“煅烧”反应的化学方程式为_______ 。

回答下列问题:
(1)工业生产中的钒催化剂一般以疏松多孔的硅藻土为载体,该做法的优点是
(2)在空气中“焙烧”废钒催化剂的目的是
A.改变发钒催化剂的结构,便于后续“酸浸”
B.除去废钒催化剂中的有机杂质
C.使废钒催化剂中的杂质氧化,便于除去
(3)在不同pH的溶液中,+ 5价钒元素的存在形式不同,如下:

①“酸浸”时,V2O5转化为VO
 的离子方程式为
的离子方程式为②“中和”时,调节溶液pH为7左右的目的为
(4)“离子交换”效率与钒溶液通过离子交换树脂的流速及钒淬液的pH有关。
①钒溶液通过离子交换树脂的流速过慢,会导致溶液滞留,离子交换时间太长;而流速过快也会影响离子交换效果,其原因是
②钒吸附液的pH对吸附效果的影响如下图所示,“离子交换”时最适宜的pH=
(5)“煅烧”反应的化学方程式为

您最近一年使用:0次
名校
解题方法
7 . 有机物样品在如图电炉中充分燃烧,通过测定生成的 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
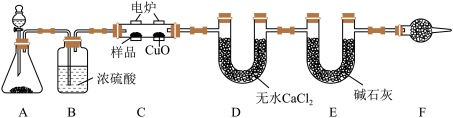
请回答下列问题:
(1)锥形瓶内的固体 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是___________ 。
(2)C装置中CuO的作用是___________ ,F装置内的试剂为___________ ,F装置的作用为___________ 。
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为___________ ,若该有机物的密度是相同条件下 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为___________ 。若该物质是一种能与Na反应的链状有机物,则它的结构简式为___________ 。
(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会___________ (填“偏大”、“偏小”或“不变”)。
 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
请回答下列问题:
(1)锥形瓶内的固体
 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是(2)C装置中CuO的作用是
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为
 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会
您最近一年使用:0次
8 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸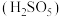 ,
, 中过氧键的数目为
中过氧键的数目为_______ 。
(3)“氧化”中,用石灰乳调节 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ( 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、_______ (填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成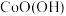 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(6)“沉镁”中为使 沉淀完全
沉淀完全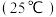 ,需控制
,需控制 不低于
不低于_______ (精确至0.1)。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。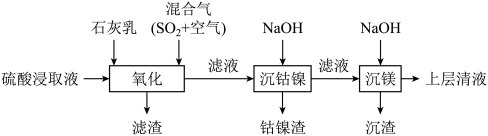
| 物质 |  |  |  |  |
 |  |  |  | 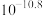 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
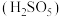 ,
, 中过氧键的数目为
中过氧键的数目为(3)“氧化”中,用石灰乳调节
 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、(4)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是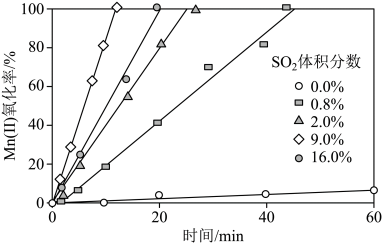
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成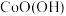 ,该反应的化学方程式为
,该反应的化学方程式为(6)“沉镁”中为使
 沉淀完全
沉淀完全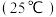 ,需控制
,需控制 不低于
不低于
您最近一年使用:0次
2023-06-13更新
|
12081次组卷
|
20卷引用:2023年高考辽宁卷化学真题
2023年高考辽宁卷化学真题(已下线)测试辽宁化学 请勿下载(已下线)T16-工业流程题(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题山西省三重教育联盟2023-2024学年高三上学期9月联考化学试题四川省成都市第七中学2023-2024学年高三上学期入学考试理综化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷福建泉州科技中学2022-2023学年高二下学期期末考化学试题甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题
名校
9 . 钪(Sc)是一种功能强大但产量稀少的稀土金属,广泛用于航天、激光、导弹等尖端科学领域。钛铁矿主要成分为钛酸亚铁(FeTiO3),还含有少量Sc2O3、MgO、SiO2等杂质,从钛铁矿中提取Sc2O3的流程如图:

已知:①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
② ,
,
回答下列问题:
(1)“滤渣1”的主要成分是_______ 。
(2)“酸浸”后Ti元素转化为 ,其水解反应的化学方程式是
,其水解反应的化学方程式是_______ 。
(3)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和酸液体积(A)之比]的关系如图,应选择最合适的O/A值为_______ 。

②温度对钪、钛的萃取率影响情况见上表,合适的萃取温度为10~15℃,其理由是_______ 。
(4)“酸溶”后滤液中存在的金属阳离子 、
、 、
、 浓度均小于0.01mol/L,再用氨水调节溶液pH使
浓度均小于0.01mol/L,再用氨水调节溶液pH使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调pH应控制的范围是
不沉淀,则调pH应控制的范围是_______ 。
(5)“萃取”与“反萃取”的目的是_______ 。
(6)“沉钪"得到草酸钪 ,将其置于
,将其置于_______ (填仪器名称)中,在空气中充分灼烧得到 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式_______ 。

已知:①室温下TiO2+完全沉淀的pH为1.05,Fe3+完全沉淀的pH为3.2
②
 ,
,
回答下列问题:
(1)“滤渣1”的主要成分是
(2)“酸浸”后Ti元素转化为
 ,其水解反应的化学方程式是
,其水解反应的化学方程式是(3)探讨影响钪的萃取率的因素:
①钪的萃取率(E%)与O/A值[萃取剂体积(O)和酸液体积(A)之比]的关系如图,应选择最合适的O/A值为

| T/℃ | 5 | 10 | 15 | 25 | 30 |
| 钪的萃取率/% | 91.3 | 96 | 97.1 | 97.3 | 98.0 |
| 钛的萃取率/% | 0.94 | 0.95 | 2.10 | 3.01 | 4.20 |
(4)“酸溶”后滤液中存在的金属阳离子
 、
、 、
、 浓度均小于0.01mol/L,再用氨水调节溶液pH使
浓度均小于0.01mol/L,再用氨水调节溶液pH使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调pH应控制的范围是
不沉淀,则调pH应控制的范围是(5)“萃取”与“反萃取”的目的是
(6)“沉钪"得到草酸钪
 ,将其置于
,将其置于 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式
您最近一年使用:0次
解题方法
10 . 纳米级硒化铜 是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含
是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含 ,含少量
,含少量 、
、 等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。

请回答下列问题:
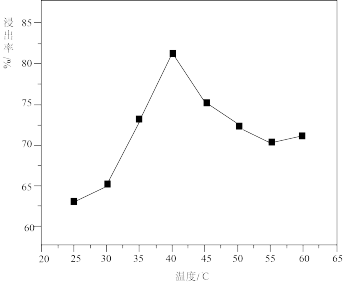
(1)“浸取”中,其他条件相同,测得温度与金属浸出率的关系如图所示。简述40℃达到峰值的原因:_______ 。
(2)写出“浸取”中 反应的离子方程式:
反应的离子方程式:_______ 。
(3)加入过量氨水时,反应分两步进行,写出 参与反应的化学方程式:
参与反应的化学方程式:_______ 。滤渣的主要成分是_______ (填化学式)。
(4)有人认为,用 或
或 代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:
代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:_______ 。若可行,需调节溶液的pH最低为_______ {若不可行,此空可不填。已知:常温下残留在溶液中的离子浓度小于 时,可认为沉淀完全,
时,可认为沉淀完全,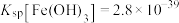 ,
,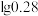 的值取-0.6}。
的值取-0.6}。
(5)在高压、加热条件下,用 还原
还原 溶液的反应中,氧化剂和还原剂的物质的量之比为
溶液的反应中,氧化剂和还原剂的物质的量之比为_______ 。
(6)已知Cu2-xSe晶胞结构如图所示,设晶胞参数为anm。
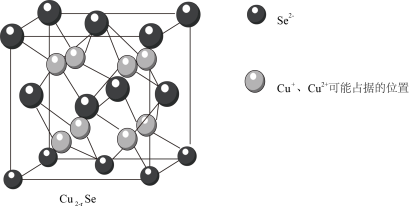
①该晶胞中 和
和 的个数比为
的个数比为_______ (用含 的代数式表示)。
的代数式表示)。
②该晶胞中 与
与 或
或 之间的最短距离为
之间的最短距离为_______  。
。
 是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含
是钠离子电池的正极材料。某小组以黄铜矿粉末(主要含 ,含少量
,含少量 、
、 等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
等)为原料,在酸性条件下生物催化氧化法制备纳米级硒化铜的流程如图。
请回答下列问题:
(1)“浸取”中,其他条件相同,测得温度与金属浸出率的关系如图所示。简述40℃达到峰值的原因:

(2)写出“浸取”中
 反应的离子方程式:
反应的离子方程式:(3)加入过量氨水时,反应分两步进行,写出
 参与反应的化学方程式:
参与反应的化学方程式:(4)有人认为,用
 或
或 代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行:
代替氨水调节溶液的pH也可以达到相同的目的。请你判断此法是否可行: 时,可认为沉淀完全,
时,可认为沉淀完全,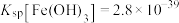 ,
,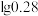 的值取-0.6}。
的值取-0.6}。(5)在高压、加热条件下,用
 还原
还原 溶液的反应中,氧化剂和还原剂的物质的量之比为
溶液的反应中,氧化剂和还原剂的物质的量之比为(6)已知Cu2-xSe晶胞结构如图所示,设晶胞参数为anm。

①该晶胞中
 和
和 的个数比为
的个数比为 的代数式表示)。
的代数式表示)。②该晶胞中
 与
与 或
或 之间的最短距离为
之间的最短距离为 。
。
您最近一年使用:0次



