名校
解题方法
1 . 工业上常用CO2为原料合成甲酸或甲醇。
Ⅰ.用CO2和水蒸气为原料,在等离子体和双金属催化剂 的作用下制备CH3OH。研究表明,在等离子体的协同下,双金属催化剂中的ZrO2更易形成氧空位,从而更有利于吸附或结合外界O原子,使得制备CH3OH的反应条件更趋温和。
的作用下制备CH3OH。研究表明,在等离子体的协同下,双金属催化剂中的ZrO2更易形成氧空位,从而更有利于吸附或结合外界O原子,使得制备CH3OH的反应条件更趋温和。
(1)催化剂的制备
将一定比例的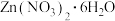 和
和 溶于水,搅拌下将其滴入pH为8的氨水中,充分反应后得到
溶于水,搅拌下将其滴入pH为8的氨水中,充分反应后得到 沉淀,将固体过滤、洗涤、干燥,于55O℃焙烧6h,制得双金属催化剂
沉淀,将固体过滤、洗涤、干燥,于55O℃焙烧6h,制得双金属催化剂 。写出生成
。写出生成 沉淀的离子方程式:
沉淀的离子方程式:___________ 。
(2)工艺参数的研究
控制水蒸气流速为28.74 、温度为150℃、反应电流为4.17A,在使用单独的等离子体(P)、等离子体与双金属催化剂协同(P+C)两种不同催化条件下,测得CO2流速对醇类产生的影响关系如图所示。
、温度为150℃、反应电流为4.17A,在使用单独的等离子体(P)、等离子体与双金属催化剂协同(P+C)两种不同催化条件下,测得CO2流速对醇类产生的影响关系如图所示。___________ 。
②分析图像可知,选用等离子体与双金属催化剂协同催化条件的优势是___________ 。
(3)反应机理的分析
利用等离子体和双金属催化剂 催化CO2和H2O反应生成CH3OH的过程中Zr的化合价发生变化,可能机理如图所示:
催化CO2和H2O反应生成CH3OH的过程中Zr的化合价发生变化,可能机理如图所示:___________ 。
②增大反应电流,等离子体会释放出数量更多、能量更大的高能粒子。随着反应电流的增加,CH3OH的产量增大,其可能原因是___________ 。
Ⅱ.工业上可以通过CO2电催化加氢合成甲酸。一种利用电催化反应器合成甲酸的工作原理如图所示。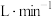 ,且保证CO2气体略过量,通气10min后,阴极收集到5.6LH2和CO的混合气体,阳极出口处收集到22.4LH2.则生成HCOOH的物质的量为
,且保证CO2气体略过量,通气10min后,阴极收集到5.6LH2和CO的混合气体,阳极出口处收集到22.4LH2.则生成HCOOH的物质的量为___________ 。(气体体积均已折算成标准状况下的体积)
(5)电极表面积对CO2转化率和HCOOH选择性[ ]的影响如图所示。控制其他条件不变,随着电极表面积的增大,CO2转化率增大且HCOOH选择性下降的原因是
]的影响如图所示。控制其他条件不变,随着电极表面积的增大,CO2转化率增大且HCOOH选择性下降的原因是___________ 。
Ⅰ.用CO2和水蒸气为原料,在等离子体和双金属催化剂
 的作用下制备CH3OH。研究表明,在等离子体的协同下,双金属催化剂中的ZrO2更易形成氧空位,从而更有利于吸附或结合外界O原子,使得制备CH3OH的反应条件更趋温和。
的作用下制备CH3OH。研究表明,在等离子体的协同下,双金属催化剂中的ZrO2更易形成氧空位,从而更有利于吸附或结合外界O原子,使得制备CH3OH的反应条件更趋温和。(1)催化剂的制备
将一定比例的
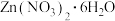 和
和 溶于水,搅拌下将其滴入pH为8的氨水中,充分反应后得到
溶于水,搅拌下将其滴入pH为8的氨水中,充分反应后得到 沉淀,将固体过滤、洗涤、干燥,于55O℃焙烧6h,制得双金属催化剂
沉淀,将固体过滤、洗涤、干燥,于55O℃焙烧6h,制得双金属催化剂 。写出生成
。写出生成 沉淀的离子方程式:
沉淀的离子方程式:(2)工艺参数的研究
控制水蒸气流速为28.74
 、温度为150℃、反应电流为4.17A,在使用单独的等离子体(P)、等离子体与双金属催化剂协同(P+C)两种不同催化条件下,测得CO2流速对醇类产生的影响关系如图所示。
、温度为150℃、反应电流为4.17A,在使用单独的等离子体(P)、等离子体与双金属催化剂协同(P+C)两种不同催化条件下,测得CO2流速对醇类产生的影响关系如图所示。
②分析图像可知,选用等离子体与双金属催化剂协同催化条件的优势是
(3)反应机理的分析
利用等离子体和双金属催化剂
 催化CO2和H2O反应生成CH3OH的过程中Zr的化合价发生变化,可能机理如图所示:
催化CO2和H2O反应生成CH3OH的过程中Zr的化合价发生变化,可能机理如图所示:
说明:图中的 表示ZnO,
表示ZnO, 表示ZrO2,
表示ZrO2, 表示氧空位;“—”表示化学键,“……”表示吸附作用。
表示氧空位;“—”表示化学键,“……”表示吸附作用。
②增大反应电流,等离子体会释放出数量更多、能量更大的高能粒子。随着反应电流的增加,CH3OH的产量增大,其可能原因是
Ⅱ.工业上可以通过CO2电催化加氢合成甲酸。一种利用电催化反应器合成甲酸的工作原理如图所示。

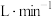 ,且保证CO2气体略过量,通气10min后,阴极收集到5.6LH2和CO的混合气体,阳极出口处收集到22.4LH2.则生成HCOOH的物质的量为
,且保证CO2气体略过量,通气10min后,阴极收集到5.6LH2和CO的混合气体,阳极出口处收集到22.4LH2.则生成HCOOH的物质的量为(5)电极表面积对CO2转化率和HCOOH选择性[
 ]的影响如图所示。控制其他条件不变,随着电极表面积的增大,CO2转化率增大且HCOOH选择性下降的原因是
]的影响如图所示。控制其他条件不变,随着电极表面积的增大,CO2转化率增大且HCOOH选择性下降的原因是
您最近一年使用:0次
名校
解题方法
2 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂粉末制备超细银粉的过程如下图所示:
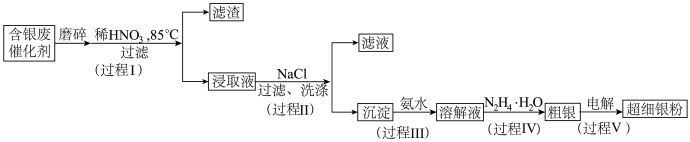
资料:i.含银废催化剂成分:主要含 、
、 及少量
及少量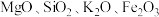
ⅱ. 为载体,且不溶于硝酸
为载体,且不溶于硝酸
回答下列问题:
(1) 与
与 属于同一族但位于下一周期,
属于同一族但位于下一周期, 的价电子轨道表示式是
的价电子轨道表示式是_______ 。
(2)过程I中,银与稀硝酸反应的离子方程式是_______ ,但实际消耗的稀硝酸会超过理论值,原因是_______ 。
(3)过程Ⅱ中,检验沉淀已洗涤干净的操作是_______ 。
(4)过程Ⅲ中反应的离子方程式是_______ 。
(5)测定粗银中银的回收率:取样品用硝酸溶解,以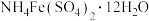 为指示剂,用
为指示剂,用 标准溶液滴定,当锥形瓶中溶液变为红色,且半分钟内不褪色即达到滴定终点。
标准溶液滴定,当锥形瓶中溶液变为红色,且半分钟内不褪色即达到滴定终点。
已知:i. 为自色难溶固体,
为自色难溶固体,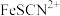 离子为红色。
离子为红色。
ⅱ. 开始沉淀的
开始沉淀的 为1.9,完全沉淀的
为1.9,完全沉淀的 为3.2
为3.2
为保证获取数据准确性,滴定时溶液 一般控制在
一般控制在 之间,氢离子浓度太小对实验的影响是
之间,氢离子浓度太小对实验的影响是_______ 。
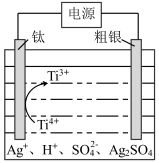
(6)可用电解法对粗银进行精炼,装置如下图所示,电解液为稀 (含
(含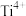 ),获得超细银粉的原理为
),获得超细银粉的原理为 。下列说法正确的是_______(填标号)。
。下列说法正确的是_______(填标号)。

资料:i.含银废催化剂成分:主要含
 、
、 及少量
及少量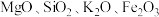
ⅱ.
 为载体,且不溶于硝酸
为载体,且不溶于硝酸回答下列问题:
(1)
 与
与 属于同一族但位于下一周期,
属于同一族但位于下一周期, 的价电子轨道表示式是
的价电子轨道表示式是(2)过程I中,银与稀硝酸反应的离子方程式是
(3)过程Ⅱ中,检验沉淀已洗涤干净的操作是
(4)过程Ⅲ中反应的离子方程式是
(5)测定粗银中银的回收率:取样品用硝酸溶解,以
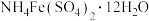 为指示剂,用
为指示剂,用 标准溶液滴定,当锥形瓶中溶液变为红色,且半分钟内不褪色即达到滴定终点。
标准溶液滴定,当锥形瓶中溶液变为红色,且半分钟内不褪色即达到滴定终点。已知:i.
 为自色难溶固体,
为自色难溶固体,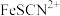 离子为红色。
离子为红色。ⅱ.
 开始沉淀的
开始沉淀的 为1.9,完全沉淀的
为1.9,完全沉淀的 为3.2
为3.2为保证获取数据准确性,滴定时溶液
 一般控制在
一般控制在 之间,氢离子浓度太小对实验的影响是
之间,氢离子浓度太小对实验的影响是(6)可用电解法对粗银进行精炼,装置如下图所示,电解液为稀
 (含
(含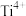 ),获得超细银粉的原理为
),获得超细银粉的原理为 。下列说法正确的是_______(填标号)。
。下列说法正确的是_______(填标号)。
| A.钛电极接电源的正极 |
B.阳极的电极反应式为: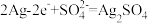 |
C.体系中存在沉淀溶解平衡: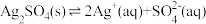 |
D.电解过程中,需要不断补充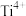 |
您最近一年使用:0次
2022-12-14更新
|
288次组卷
|
4卷引用:湖北省部分学校2022-2023学年高三上学期12月联考化学试题
名校
解题方法
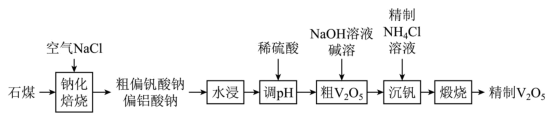
3 .  (五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 、
、 、
、 、
、 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:(1) (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
(2) 、
、 沉淀生成和溶解的pH如表所示:
沉淀生成和溶解的pH如表所示:
(1)石煤在“钠化焙烧”前需要经过粉碎预处理,粉碎的目的是_________ 。
(2)“钠化焙烧”过程中 会转变为偏钒酸钠,同时有黄绿色气体生成,其化学方程式为
会转变为偏钒酸钠,同时有黄绿色气体生成,其化学方程式为_________ 。
(3)“调pH”分两步操作完成:第一步向水浸后溶液中加入稀硫酸“沉铝”,调节pH的范围为_________ ,过滤;第二步继续向滤液中滴加稀硫酸,调节pH的范围为_________ ,过滤得到粗 。
。
(4)“沉钒”时加入精制 溶液,若温度超过80℃以后沉钒率将会下降,其原因是
溶液,若温度超过80℃以后沉钒率将会下降,其原因是_________ 。
(5)已知:存在沉淀溶解平衡 ,沉钒后将
,沉钒后将 过滤出需要洗涤,可以选择的洗涤剂是
过滤出需要洗涤,可以选择的洗涤剂是_________ 。
A.冷水 B.热水 C.1%
(6)测定产品中 的纯度:称取2.5 g产品,先用硫酸溶解,得到
的纯度:称取2.5 g产品,先用硫酸溶解,得到 溶液。再加入100 mL 0.5 mol/L
溶液。再加入100 mL 0.5 mol/L  溶液(
溶液(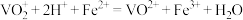 )。最后用0.2 mol/L酸性
)。最后用0.2 mol/L酸性 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为25.00 mL(假设杂质不参与反应)。
溶液的体积为25.00 mL(假设杂质不参与反应)。
①达到滴定终点的现象是_________ 。
②产品中 的质量分数是
的质量分数是_________ 。
 (五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 、
、 、
、 、
、 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:(1)
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水(2)
 、
、 沉淀生成和溶解的pH如表所示:
沉淀生成和溶解的pH如表所示:| 物质 | 溶液pH | |||
| 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 | |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(2)“钠化焙烧”过程中
 会转变为偏钒酸钠,同时有黄绿色气体生成,其化学方程式为
会转变为偏钒酸钠,同时有黄绿色气体生成,其化学方程式为(3)“调pH”分两步操作完成:第一步向水浸后溶液中加入稀硫酸“沉铝”,调节pH的范围为
 。
。(4)“沉钒”时加入精制
 溶液,若温度超过80℃以后沉钒率将会下降,其原因是
溶液,若温度超过80℃以后沉钒率将会下降,其原因是(5)已知:存在沉淀溶解平衡
 ,沉钒后将
,沉钒后将 过滤出需要洗涤,可以选择的洗涤剂是
过滤出需要洗涤,可以选择的洗涤剂是A.冷水 B.热水 C.1%

(6)测定产品中
 的纯度:称取2.5 g产品,先用硫酸溶解,得到
的纯度:称取2.5 g产品,先用硫酸溶解,得到 溶液。再加入100 mL 0.5 mol/L
溶液。再加入100 mL 0.5 mol/L  溶液(
溶液(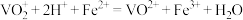 )。最后用0.2 mol/L酸性
)。最后用0.2 mol/L酸性 溶液滴定过量的
溶液滴定过量的 至终点,消耗
至终点,消耗 溶液的体积为25.00 mL(假设杂质不参与反应)。
溶液的体积为25.00 mL(假设杂质不参与反应)。①达到滴定终点的现象是
②产品中
 的质量分数是
的质量分数是
您最近一年使用:0次
名校
解题方法
4 . 草酸钴在化学中应用广泛,可以用于制取催化剂和指示剂。以钴矿[主要成分是 、
、 、
、 ,还含有少量
,还含有少量 、
、 、CuO、FeO及
、CuO、FeO及 杂质]制取草酸钴晶体(
杂质]制取草酸钴晶体( )
)
的工艺流程如图所示:

常温下,有关沉淀数据如表(“完全沉淀时,金属离子浓度 )。
)。
回答下列问题:
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是_______ ;浸出渣的主要成分是_______ 。(填化学式)。浸出液中主要含有 、
、 、
、 、
、 、
、 和
和 离子,写出“浸取”时,
离子,写出“浸取”时, 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
(2)“氧化”时,发生反应的离子方程式为_______ 。
(3)常温下,“调节pH”得到的沉淀X的主要成分是_______ ;若“调节pH”后,溶液中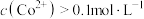 ,则需调节溶液pH的范围是
,则需调节溶液pH的范围是_______ (忽略溶液的体积变化)。
(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂 ,发生反应:
,发生反应: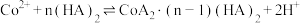 。当溶液pH处于4.5到6.5之间时,
。当溶液pH处于4.5到6.5之间时, 萃取率随着溶液pH增大而增大,其原因是
萃取率随着溶液pH增大而增大,其原因是_______ ;反萃取时,应加入的物质是_______ (填溶液名称)。
(5)钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取36.6g草酸钴晶体,在空气中加热至恒重,得到CoO与 的混合物15.8g,该混合物中CoO与
的混合物15.8g,该混合物中CoO与 的物质的量之比为
的物质的量之比为_______ 。
 、
、 、
、 ,还含有少量
,还含有少量 、
、 、CuO、FeO及
、CuO、FeO及 杂质]制取草酸钴晶体(
杂质]制取草酸钴晶体( )
)的工艺流程如图所示:

常温下,有关沉淀数据如表(“完全沉淀时,金属离子浓度
 )。
)。| 沉淀 |  |  |  |  |  |
| 恰好完全沉淀时pH | 10.1 | 9.4 | 6.7 | 2.8 | 5.2 |
(1)“浸取”前,需要对钴矿进行粉碎处理的目的是
 、
、 、
、 、
、 、
、 和
和 离子,写出“浸取”时,
离子,写出“浸取”时, 发生反应的化学方程式:
发生反应的化学方程式:(2)“氧化”时,发生反应的离子方程式为
(3)常温下,“调节pH”得到的沉淀X的主要成分是
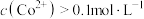 ,则需调节溶液pH的范围是
,则需调节溶液pH的范围是(4)“提纯”分为萃取和反萃取两步进行,先向除杂后的溶液中加入某有机酸萃取剂
 ,发生反应:
,发生反应: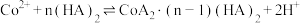 。当溶液pH处于4.5到6.5之间时,
。当溶液pH处于4.5到6.5之间时, 萃取率随着溶液pH增大而增大,其原因是
萃取率随着溶液pH增大而增大,其原因是(5)钴的氧化物常用作颜料或反应催化剂,可以由草酸钴晶体在空气中加热制取,取36.6g草酸钴晶体,在空气中加热至恒重,得到CoO与
 的混合物15.8g,该混合物中CoO与
的混合物15.8g,该混合物中CoO与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
2022-11-20更新
|
344次组卷
|
4卷引用:江西省名校2022届高三下学期第三次模拟理科综合化学试题
名校
解题方法
5 . 工业上两次转化法从天青石矿(主要成分 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。
(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品 。滤液中
。滤液中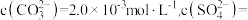
_________  。[已知:
。[已知: ]
]
②酸化:用稀盐酸浸泡粗品 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为_________ (催化剂氯化铵参与了 与盐酸生成
与盐酸生成 的反应)。
的反应)。
③除杂。
ⅰ)除铁、铝:向 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在_________ 范围内,充分搅拌,过滤。
已知:相关金属离子生成氢氧化物沉淀的 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。
ⅱ)除钙:取ⅰ中滤液,逐滴加入适量稀 溶液。
溶液。
请补充完整去除 的后续实验操作:
的后续实验操作:_________ ,得到较纯净的 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,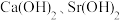 的溶解度分别为
的溶解度分别为 、
、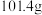 。
。
(2)二次转化。向 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。
①写出沉淀过程中发生反应的化学方程式:_________ 。
②锶转化率随温度的变化如图所示。当反应温度大于 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是_________ 。

 ,含有
,含有 等杂质)制备高纯碳酸锶。
等杂质)制备高纯碳酸锶。(1)一次转化
①浸泡:用饱和碳酸钠溶液浸泡天青石矿粉,过滤得到粗品
 。滤液中
。滤液中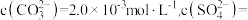
 。[已知:
。[已知: ]
]②酸化:用稀盐酸浸泡粗品
 ,加入一定量的催化剂氯化铵,得到含有杂质(
,加入一定量的催化剂氯化铵,得到含有杂质( )的
)的 粗溶液。该酸化过程可描述为
粗溶液。该酸化过程可描述为 与盐酸生成
与盐酸生成 的反应)。
的反应)。③除杂。
ⅰ)除铁、铝:向
 粗溶液中加入少量的
粗溶液中加入少量的 溶液,在
溶液,在 条件下加入少量的稀氨水,控制溶液
条件下加入少量的稀氨水,控制溶液 在
在已知:相关金属离子生成氢氧化物沉淀的
 如下表所示,
如下表所示, 为7.8时
为7.8时 沉淀开始溶解。
沉淀开始溶解。| 物质 |  |  |  |  | 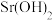 |
开始沉淀 | 1.9 | 7.0 | 3.4 | - | - |
完全沉淀 | 3.2 | 9.0 | 4.7 | 12 | - |
 溶液。
溶液。请补充完整去除
 的后续实验操作:
的后续实验操作: 溶液。已知:
溶液。已知: 的溶解度随温度的升高而降低;
的溶解度随温度的升高而降低; 时,
时,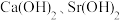 的溶解度分别为
的溶解度分别为 、
、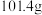 。
。(2)二次转化。向
 溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度
溶液中加入适量碳酸氢铵溶液,微热、过滤、洗涤得到高纯度 。
。①写出沉淀过程中发生反应的化学方程式:
②锶转化率随温度的变化如图所示。当反应温度大于
 时,锶转化率急剧下降的原因是
时,锶转化率急剧下降的原因是
您最近一年使用:0次
2022-11-12更新
|
590次组卷
|
4卷引用:江苏省盐城市2023届高三上学期期中考试化学试题
名校
解题方法
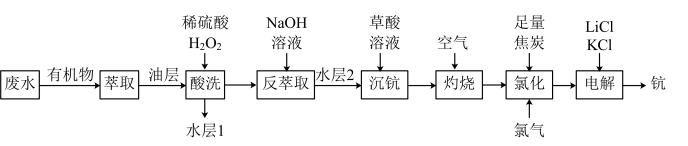
6 . 一种从钛白酸性废水(主要含 、
、 ,还含微量
,还含微量 )中富集钪并制备钪的工艺流程如图。
)中富集钪并制备钪的工艺流程如图。
已知:i.钪元素主要化合价为+3价。
ii. 衰变:放出电子的衰变过程,
衰变:放出电子的衰变过程,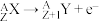 。
。
ii.分配比D是指在溶剂萃取过程中,当萃取体系达到平衡后,被萃物在有机相的总浓度和在水相的总浓度之比。
iv. 为砖红色固体;
为砖红色固体;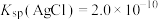 ,
, 。
。
(1)钪的一种核素可作示踪原子用于对恶性肿瘤放射治疗,该种核素的中子数为25,该核素的符号为_________ 。该核素可发生 衰变和
衰变和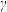 衰变,请书写出
衰变,请书写出 衰变方程式
衰变方程式_________ 。
(2)当pH=5时 易发生水解,此时用环烷酸(HA)萃取,原理为:
易发生水解,此时用环烷酸(HA)萃取,原理为: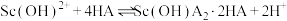 ,平衡常数
,平衡常数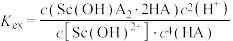 。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数
。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数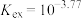 ,当第一次萃取后萃余液的pH=5,
,当第一次萃取后萃余液的pH=5,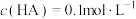 ,请计算是否还需要二次萃取?
,请计算是否还需要二次萃取?_________ (请书写出计算过程)。
(3)流程中从“萃取”到“反萃取"过程的目的是_________ 。
(4)请书写出“氯化”工艺的化学方程式_________ 。
(5)流程中不采用“灼烧”后,而采用“氯化”后电解的原因是_________ 。
(6)现取制得的 粗产品(只含难溶
粗产品(只含难溶 杂质)溶于水,配成溶液,采用
杂质)溶于水,配成溶液,采用 为指示剂,用
为指示剂,用 标准溶液滴定,描述达到滴定终点时现象
标准溶液滴定,描述达到滴定终点时现象_________ ,溶液中 沉淀完全[此时
沉淀完全[此时 为
为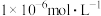 ],则此时溶液中
],则此时溶液中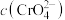 的浓度为
的浓度为_________  。
。
 、
、 ,还含微量
,还含微量 )中富集钪并制备钪的工艺流程如图。
)中富集钪并制备钪的工艺流程如图。
已知:i.钪元素主要化合价为+3价。
ii.
 衰变:放出电子的衰变过程,
衰变:放出电子的衰变过程,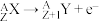 。
。ii.分配比D是指在溶剂萃取过程中,当萃取体系达到平衡后,被萃物在有机相的总浓度和在水相的总浓度之比。
iv.
 为砖红色固体;
为砖红色固体;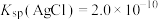 ,
, 。
。(1)钪的一种核素可作示踪原子用于对恶性肿瘤放射治疗,该种核素的中子数为25,该核素的符号为
 衰变和
衰变和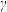 衰变,请书写出
衰变,请书写出 衰变方程式
衰变方程式(2)当pH=5时
 易发生水解,此时用环烷酸(HA)萃取,原理为:
易发生水解,此时用环烷酸(HA)萃取,原理为: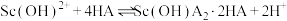 ,平衡常数
,平衡常数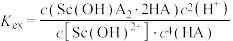 。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数
。当分配比D>10时,钪的萃取回收率高,不需要二次萃取。已知平衡常数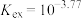 ,当第一次萃取后萃余液的pH=5,
,当第一次萃取后萃余液的pH=5,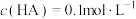 ,请计算是否还需要二次萃取?
,请计算是否还需要二次萃取?(3)流程中从“萃取”到“反萃取"过程的目的是
(4)请书写出“氯化”工艺的化学方程式
(5)流程中不采用“灼烧”后,而采用“氯化”后电解的原因是
(6)现取制得的
 粗产品(只含难溶
粗产品(只含难溶 杂质)溶于水,配成溶液,采用
杂质)溶于水,配成溶液,采用 为指示剂,用
为指示剂,用 标准溶液滴定,描述达到滴定终点时现象
标准溶液滴定,描述达到滴定终点时现象 沉淀完全[此时
沉淀完全[此时 为
为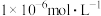 ],则此时溶液中
],则此时溶液中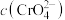 的浓度为
的浓度为 。
。
您最近一年使用:0次
2022-11-12更新
|
409次组卷
|
2卷引用:湖南省长沙市宁乡市第一高级中学2022-2023学年高三上学期11月质量检测化学试题
名校
解题方法
7 . 炼铁的矿石主要有赤铁矿、磁铁矿和菱铁矿等。在测定磁铁矿中铁的含量前,通常要对矿石进行预处理。对矿样进行预处理后,用重铬酸钾标准溶液可测定铁矿石的含铁量,现有两种对矿样进行预处理的方法如下:

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有 (无色)、
(无色)、 (无色)、
(无色)、 、
、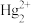 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
II.钨酸钠 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
III. 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: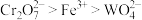 ;
;
IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为_______ (写化学式)。
(2)过程①发生反应的离子方程式为_______ 。
(3)反应③中含铁元素的离子发生的反应:_______ ;反应(3)中溶液变蓝,说明_______ 。
(4)矿样预处理后,加入 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当_______ 现象,说明达到了滴定终点。
(5)现称取 矿样进行实验,最终消耗
矿样进行实验,最终消耗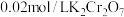 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为_______ 。

已知:
I.Sn、Hg、Ti在溶液中可存在的形式有
 (无色)、
(无色)、 (无色)、
(无色)、 、
、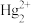 、
、 (紫色)、
(紫色)、 (无色),
(无色), 能与
能与 反应,且
反应,且 也能与
也能与 反应,氯化汞溶于水,氯化亚汞是白色难溶固体;
反应,氯化汞溶于水,氯化亚汞是白色难溶固体;II.钨酸钠
 可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;
可作指示剂,若+6价钨被还原为+5价钨,溶液由无色变为蓝色;III.
 和
和 均具有还原性,氧化性:
均具有还原性,氧化性: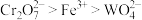 ;
;IV.二苯胺硫磺钠本身无色,被氧化后呈现紫红色
请回答下列问题:
(1)反应②后得到的悬浊液中固体物质为
(2)过程①发生反应的离子方程式为
(3)反应③中含铁元素的离子发生的反应:
(4)矿样预处理后,加入
 混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当
混酸溶液,以二苯胺硫磺钠为指示剂,用重铬酸钾标准溶液可测定铁矿石的含铁量,当(5)现称取
 矿样进行实验,最终消耗
矿样进行实验,最终消耗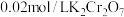 标准溶液
标准溶液 ,则矿样中含铁的质量分数为
,则矿样中含铁的质量分数为
您最近一年使用:0次
2022-11-10更新
|
170次组卷
|
2卷引用:山东省菏泽市2022-2023学年高三上学期期中联考化学(A卷)试题
名校
解题方法
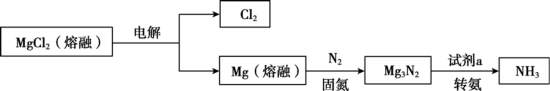
8 . 合成NH3是重要的研究课题,一种合成NH3的流程示意如图。
相关数据如表:
(1)固氮:
①固氮反应的化学方程式是____ 。
②固氮的适宜温度范围是____ 。
a.500~600℃ b.700~800℃ c.900~1000℃
③检测固氮作用:向固氮后的产物中加水,____ (填操作和现象),说明Mg能起到固氮作用。
(2)转氨:选用试剂a完成转化。
Ⅰ.选用H2O进行转化。发现从体系中分离出NH3较困难。
Ⅱ.选用HCl气体进行转化。发现能产生NH3,且产物MgCl2能直接循环利用。但NH3的收率较低,原因是____ 。
Ⅲ.选用NH4Cl固体进行转化。合成氨的过程如图:

①合成氨的总反应方程式是____ 。
②经实验研究,证实了Mg3N2中的氮元素在“转氨”过程中能转变为氨。
实验:将____ (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在15NH3。
③测量Mg3N2的转化率:取固体mgMg3N2和足量NH4Cl的混合物[n(Mg3N2):n(NH4Cl)≤1:6],混匀,充分反应。用cmol•L-1的H2SO4滴定生成的NH3,至滴定终点时消耗vmLH2SO4。Mg3N2的转化率为____ 。(Mg3N2摩尔质量为100g•mol-1)

相关数据如表:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 分解温度/℃ |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)固氮:
①固氮反应的化学方程式是
②固氮的适宜温度范围是
a.500~600℃ b.700~800℃ c.900~1000℃
③检测固氮作用:向固氮后的产物中加水,
(2)转氨:选用试剂a完成转化。
Ⅰ.选用H2O进行转化。发现从体系中分离出NH3较困难。
Ⅱ.选用HCl气体进行转化。发现能产生NH3,且产物MgCl2能直接循环利用。但NH3的收率较低,原因是
Ⅲ.选用NH4Cl固体进行转化。合成氨的过程如图:

①合成氨的总反应方程式是
②经实验研究,证实了Mg3N2中的氮元素在“转氨”过程中能转变为氨。
实验:将
检测结果:经探测仪器检测,所得氨气中存在15NH3。
③测量Mg3N2的转化率:取固体mgMg3N2和足量NH4Cl的混合物[n(Mg3N2):n(NH4Cl)≤1:6],混匀,充分反应。用cmol•L-1的H2SO4滴定生成的NH3,至滴定终点时消耗vmLH2SO4。Mg3N2的转化率为
您最近一年使用:0次
名校
解题方法
9 . 钛(Ti)及其合金具有密度小、质量轻、比强度高、耐腐蚀性等优点,被称为“全能金属”。
(1)工业上利用金红石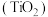 制备金属钛的流程如下:
制备金属钛的流程如下:

已知: 转化为
转化为 有直接氯化法和碳氯化法。
有直接氯化法和碳氯化法。
a.直接氯化:

b.碳氯化: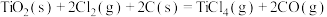
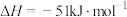
①“碳氯化”的反应趋势远大于直接氯化,原因是_______ 。
②“碳氯化”过程中每生成1mol ,理论上转移电子数为
,理论上转移电子数为_______ 。
③“还原”步骤中可使用金属Mg在800~900℃及氩气保护下制取金属钛。相比于传统的氢气还原法(2500℃下,用 作还原剂),请从能源利用、物质转化与资源综合利用角度分析,用金属Mg还原的优点是
作还原剂),请从能源利用、物质转化与资源综合利用角度分析,用金属Mg还原的优点是_______ 。
(2)我国科学家研究出USTB工艺制取金属钛,其原理如图。
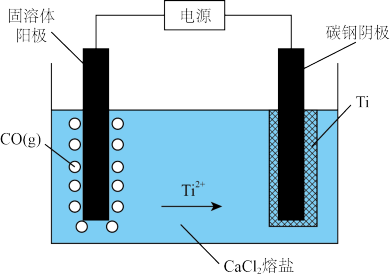
①该方法使用具有导电性的TiO•TiC固溶体作阳极,碳钢作阴极,熔盐作电解质,电解时阳极发生的主要电极反应为_______ 。
②由于水对实验有严重影响,而熔盐 具有很强的吸水性,所以必须对
具有很强的吸水性,所以必须对 进行预处理。将装有
进行预处理。将装有 的坩埚置于电阻炉后,同时以
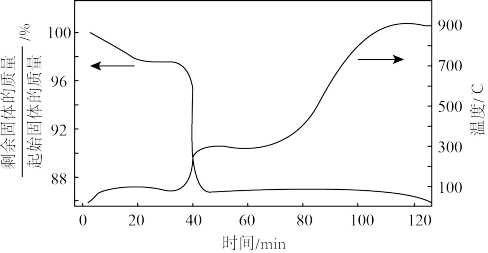
的坩埚置于电阻炉后,同时以 的速度通入显气,实验所得到的熔盐
的速度通入显气,实验所得到的熔盐 重量随温度和时间的变化曲线如图所示。图中244℃时发生
重量随温度和时间的变化曲线如图所示。图中244℃时发生 脱除结晶水的反应。请结合图象分析,工业上一般在778℃时,将通入氩气的速度降至
脱除结晶水的反应。请结合图象分析,工业上一般在778℃时,将通入氩气的速度降至 ,其原因可能是
,其原因可能是_______ 。
(1)工业上利用金红石
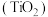 制备金属钛的流程如下:
制备金属钛的流程如下:
已知:
 转化为
转化为 有直接氯化法和碳氯化法。
有直接氯化法和碳氯化法。a.直接氯化:


b.碳氯化:
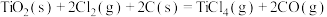
①“碳氯化”的反应趋势远大于直接氯化,原因是
②“碳氯化”过程中每生成1mol
 ,理论上转移电子数为
,理论上转移电子数为③“还原”步骤中可使用金属Mg在800~900℃及氩气保护下制取金属钛。相比于传统的氢气还原法(2500℃下,用
 作还原剂),请从能源利用、物质转化与资源综合利用角度分析,用金属Mg还原的优点是
作还原剂),请从能源利用、物质转化与资源综合利用角度分析,用金属Mg还原的优点是(2)我国科学家研究出USTB工艺制取金属钛,其原理如图。

①该方法使用具有导电性的TiO•TiC固溶体作阳极,碳钢作阴极,熔盐作电解质,电解时阳极发生的主要电极反应为
②由于水对实验有严重影响,而熔盐
 具有很强的吸水性,所以必须对
具有很强的吸水性,所以必须对 进行预处理。将装有
进行预处理。将装有 的坩埚置于电阻炉后,同时以
的坩埚置于电阻炉后,同时以 的速度通入显气,实验所得到的熔盐
的速度通入显气,实验所得到的熔盐 重量随温度和时间的变化曲线如图所示。图中244℃时发生
重量随温度和时间的变化曲线如图所示。图中244℃时发生 脱除结晶水的反应。请结合图象分析,工业上一般在778℃时,将通入氩气的速度降至
脱除结晶水的反应。请结合图象分析,工业上一般在778℃时,将通入氩气的速度降至 ,其原因可能是
,其原因可能是
您最近一年使用:0次
解题方法
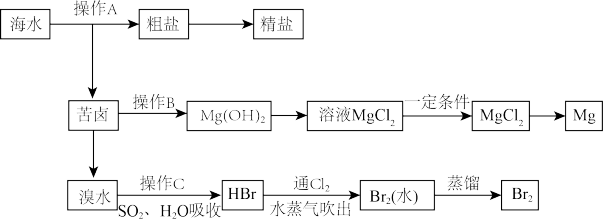
10 . 如图是人类从海水资源中提取某些重要化工原料的流程示意图:
请回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO 等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:
等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:____ 。
(2)电解饱和食盐水的化学反应方程式为____ 。
(3)与电源负极相连的电极附近溶液pH____ (填“变大、不变”或“变小”)。
(4)操作B需加入下列试剂中的一种,最合适的是____ (填字母)。
(5)向苦卤中通入Cl2,发生反应的离子方程式是____ 。
(6)溴水中通入二氧化硫和水的反应为SO2+Br2+2H2O=2HBr+H2SO4,请用单线桥标出该反应电子转移的方向和数目____ 。

请回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO
 等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:
等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液。加入试剂的顺序是:(2)电解饱和食盐水的化学反应方程式为
(3)与电源负极相连的电极附近溶液pH
(4)操作B需加入下列试剂中的一种,最合适的是
| A.氢氧化钠溶液 | B.澄清石灰水 | C.石灰乳 | D.碳酸钠溶液 |
(6)溴水中通入二氧化硫和水的反应为SO2+Br2+2H2O=2HBr+H2SO4,请用单线桥标出该反应电子转移的方向和数目
您最近一年使用:0次



