名校
解题方法
1 . 铊(Tl)在工业中的用途非常广泛,其中铊锡合金可作超导材料:铊镉合金是原子能工业中的重要材料。铊主要从铅精矿焙烧产生的富铊灰(主要成分PbO、ZnO、Fe2O3、 FeO、Tl2O等)中提炼,具体工艺流程如图。
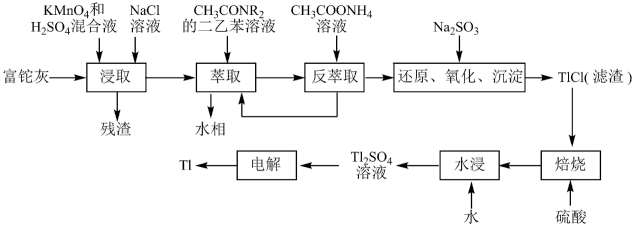
已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl
 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。
回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为_______ 。
(2)在实验室中,“萃取”过程使用的玻璃仪器有烧杯,还有_______ ,用平衡移动解释“反萃取”过程的原理和目的_______ 。
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为_______ ,为提高经济效益充分利用原料,该反应的滤液可加入_______ 步骤循环使用最合适。
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:_______ 。
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为_______ 。


已知:萃取剂选用对铊有很高选择性的酰胺类萃取剂CH3CONR2的二乙苯溶液,萃取过程的反应原理为H+ +CH3CONR2+TlCl

 [CH3CONR2H]TlCl4。
[CH3CONR2H]TlCl4。回答下列问题:
(1)浸取过程中硫酸的作用除了酸化提供H+,另一作用为
(2)在实验室中,“萃取”过程使用的玻璃仪器有烧杯,还有
(3)“还原、氧化、沉淀”过程中生成TlCl,该反应的离子方程式为
(4)Tl+对人体毒性很大,难溶盐KFe[Fe(CN)6]可通过离子交换治疗Tl2SO4中毒,将其转化为沉淀同时生成K2SO4溶液,写出治疗Tl2SO4中毒的离子方程式:
(5)电解Tl2SO4溶液制备金属Tl的装置如图所示。石墨(C)上电极反应式为

您最近一年使用:0次
名校
解题方法
2 . 碲(Te)元素是当今新材料的主要成分之一。工业上从电解法精炼铜的阳极泥中提取纯度较高的碲,经预处理后的阳极泥中含TeO2及铁、铅、铜的化合物等,通过以下流程得到:

已知:
①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为_________ 。
(2)加入Na2S溶液的主要目的是________ 。
(3)“沉碲”发生反应的化学方程式为_______ 。
(4)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为_______ 。
(5)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中 :c(H2TeO3) =
:c(H2TeO3) =________ 。(已知:H2TeO3的Ka1=1.0×10-3Ka2=2.0×10-8)

已知:
①TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
②部分难溶物的Ksp如表:
| 化合物 | Fe(OH)2 | Pb(OH)2 | Cu(OH)2 | FeS | PbS | CuS |
| Ksp | 8×10-16 | 1.2×10-15 | 1.3×10-20 | 4×10-19 | 1×10-28 | 6×10-36 |
回答下列问题:
(1)“碱浸”时TeO2发生反应的化学方程式为
(2)加入Na2S溶液的主要目的是
(3)“沉碲”发生反应的化学方程式为
(4)电解法提纯粗碲时,以Na2TeO3溶液为电解质溶液,阳极材料为
(5)常温下,向0.lmol/LNa2TeO3溶液中滴加盐酸,当溶液pH=5时,溶液中
 :c(H2TeO3) =
:c(H2TeO3) =
您最近一年使用:0次
名校
解题方法
3 . 高纯硫酸锶(SrSO4)作为锶铁氧体的主要原料广泛应用于磁性材料行业,添加到玻璃中可吸收紫外线和X射线,是用作阴极射线管面板的理想材料。以天青石精矿(主要成分为SrSO4、含有少量SiO2、BaSO4等)为原料制备高纯硫酸锶的工艺流程如图所示:

已知: Ksp(SrSO4)=3.2×10 -7、Ksp(SrCO3)=1.6 ×10 -9。请回答下列问题:
(1)“转化”工序实施前要将天青石粉碎研磨,其目的是___________ 。
(2)“转化”时,维持反应温度为70°C,温度不宜过高或过低的原因是___________ 。
(3)写出“转化”过程反应的化学方程式:___________ 。
(4)浸渣的主要成分有___________ (填化学式);浸液中溶质的碱性___________ (填“>”“<”或“=”)Ca(OH)2。
(5)“沉淀”过程反应的离子方程式为___________ 。
(6)气体1和气体2与水经过化合反应后的生成物可以返回___________ 工序循环利用。
(7)将天青石粉末与Na2CO3溶液混合,经一系列操作也可以得到SrCO3。将含有0.50 mol SrSO4的天青石粉末置于盛有100mL蒸馏水的烧杯中,再加入Na2CO3粉末并充分搅拌(忽略溶液体积的变化),若使SrSO4全部转化为SrCO3,则最少需要加入Na2CO3的物质的量为___________ (保留四位有效数字)。

已知: Ksp(SrSO4)=3.2×10 -7、Ksp(SrCO3)=1.6 ×10 -9。请回答下列问题:
(1)“转化”工序实施前要将天青石粉碎研磨,其目的是
(2)“转化”时,维持反应温度为70°C,温度不宜过高或过低的原因是
(3)写出“转化”过程反应的化学方程式:
(4)浸渣的主要成分有
(5)“沉淀”过程反应的离子方程式为
(6)气体1和气体2与水经过化合反应后的生成物可以返回
(7)将天青石粉末与Na2CO3溶液混合,经一系列操作也可以得到SrCO3。将含有0.50 mol SrSO4的天青石粉末置于盛有100mL蒸馏水的烧杯中,再加入Na2CO3粉末并充分搅拌(忽略溶液体积的变化),若使SrSO4全部转化为SrCO3,则最少需要加入Na2CO3的物质的量为
您最近一年使用:0次
名校
解题方法
4 . 葡萄糖、葡萄糖酸在医疗和工业上有广泛用途。
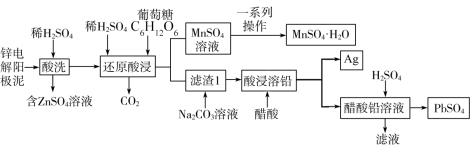
(1)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。
回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为_______ ;“还原酸浸”过程中主要反应的离子方程式为_______ 。
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ ;将分离出晶体的母液收集、循环使用,其意义是_______ 。
③整个流程中可循环利用的物质是_______ ;加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为_______ mol·L-1(保留一位小数);PbSO4(s)+ (aq)⇌PbCO3(s)+
(aq)⇌PbCO3(s)+ (aq),平衡常数K=
(aq),平衡常数K=_______ (列出计算式)。
(2)工业上常采用电渗析法从含葡萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。
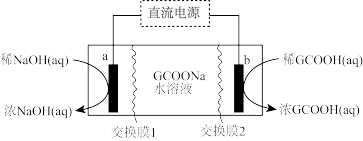
①交换膜1为_______ 交换膜(选填“阴离子”、“阳离子”);电路中通过2mol电子时,理论上回收_______ gNaOH。
②b电极上发生反应的电极反应式为_______ 。
(1)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。

回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是
③整个流程中可循环利用的物质是
 (aq)⇌PbCO3(s)+
(aq)⇌PbCO3(s)+ (aq),平衡常数K=
(aq),平衡常数K=(2)工业上常采用电渗析法从含葡萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。

①交换膜1为
②b电极上发生反应的电极反应式为
您最近一年使用:0次
2022-06-14更新
|
329次组卷
|
2卷引用:四川省内江市2022届高三下学期第三次模拟考试题理科综合化学试题
名校
解题方法
5 . 某油脂厂废弃的催化剂主要含有金属Pb、Al、Fe及其氧化物,采用如图工艺流程回收其中的铝并制备绿矾晶体( )。
)。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)废催化剂“酸浸”前,先用热的 溶液除去表面的油污,然后粉碎,用离子方程式表示
溶液除去表面的油污,然后粉碎,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:_______ 。粉碎的主要目的为_______ 。
(2)滤渣1的主要成分为_______ (填化学式),加入M发生反应的离子方程式为_______ 。
(3)“沉铝”时pH应该控制的范围为_______ ,若“沉铝”时用 溶液代替NaOH溶液,则滤渣2为碱式碳酸铝[
溶液代替NaOH溶液,则滤渣2为碱式碳酸铝[ ],同时有
],同时有 逸出,写出该反应的离子方程式:
逸出,写出该反应的离子方程式:_______ 。
(4)“控制pH”后从溶液中得到绿矾晶体,包含的操作是_______ 、过滤、洗涤及干燥。
(5)铝电池有广泛应用前景,一种可充放电的铝离子电池工作原理如图所示,电解质为 离子液体,CuS在电池反应后转化为
离子液体,CuS在电池反应后转化为 和
和 。
。

放电时,负极每消耗 ,有
,有_______ g Al溶解。该电池充电时,阳极反应式为_______ 。
 )。
)。
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 4.7 | 3.2 | 9.0 |
(1)废催化剂“酸浸”前,先用热的
 溶液除去表面的油污,然后粉碎,用离子方程式表示
溶液除去表面的油污,然后粉碎,用离子方程式表示 溶液显碱性的原因:
溶液显碱性的原因:(2)滤渣1的主要成分为
(3)“沉铝”时pH应该控制的范围为
 溶液代替NaOH溶液,则滤渣2为碱式碳酸铝[
溶液代替NaOH溶液,则滤渣2为碱式碳酸铝[ ],同时有
],同时有 逸出,写出该反应的离子方程式:
逸出,写出该反应的离子方程式:(4)“控制pH”后从溶液中得到绿矾晶体,包含的操作是
(5)铝电池有广泛应用前景,一种可充放电的铝离子电池工作原理如图所示,电解质为
 离子液体,CuS在电池反应后转化为
离子液体,CuS在电池反应后转化为 和
和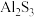 。
。
放电时,负极每消耗
 ,有
,有
您最近一年使用:0次
2022-06-06更新
|
783次组卷
|
2卷引用:湖北省华中师范大学第一附属中学2022届高三学业水平等级考试模拟演练(一)化学试题
名校
解题方法
6 . 磷酸二氢钾( )广泛用于工农业生产中,以磷灰石为原料生产磷酸二氢钾的工业流程为:
)广泛用于工农业生产中,以磷灰石为原料生产磷酸二氢钾的工业流程为:
I.制备磷酸
方法1——热法(如图)
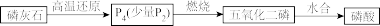
方法2——湿法(如图)

已知:①磷灰石的主要成分是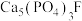 ,还含有铝、铁、镁、硅等元素。
,还含有铝、铁、镁、硅等元素。
②白磷( )常温下为固体,易升华。
)常温下为固体,易升华。
③除了钾、钠、铵外的磷酸盐、磷酸一氢盐往往难溶于水;磷酸二氢盐绝大多数都易溶于水。
(1)热法和湿法都需要先将磷灰石粉碎,目的是___________ 。
(2)“高温还原”是在石英砂(主要成分 )存在下,用焦炭将
)存在下,用焦炭将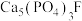 还原,反应过程中同时有CO和两种钙盐生成,主要反应的化学方程式为
还原,反应过程中同时有CO和两种钙盐生成,主要反应的化学方程式为___________ 。
(3)“酸浸”时,用两酸(硫酸和磷酸)分步浸取比只用硫酸浸取率更高,先加入的酸为___________ 。酸浸时会产生一种能腐蚀玻璃的物质,这种物质的分子式为___________ 。
(4)“脱硫”时,用 除去粗磷酸中少量的
除去粗磷酸中少量的 ,其离子方程式为
,其离子方程式为___________ 。
(5)与湿法相比,热法制备磷酸的缺点是___________ 。(列一条)
II.制备磷酸二氢钾
向原料液(含等物质的量KCl与 的水溶液)加入正三丁胺(难溶于水的无色液体、弱碱),保持30℃一个小时,抽滤,滤饼经洗涤、干燥得磷酸二氢钾,滤液中加入氨水再生有机相,并生成副产物。
的水溶液)加入正三丁胺(难溶于水的无色液体、弱碱),保持30℃一个小时,抽滤,滤饼经洗涤、干燥得磷酸二氢钾,滤液中加入氨水再生有机相,并生成副产物。
(6)正三丁胺在制备过程中的作用为___________ 。
(7)副产物的化学式为___________ 。
(8)若制备磷酸过程中磷元素损失a%,制备磷酸二氢钾时原料的转化率为b%,则1吨含“ ”(类似于盐可写成氧化物的形式)28.4%的磷灰石可生产磷酸二氢钾
”(类似于盐可写成氧化物的形式)28.4%的磷灰石可生产磷酸二氢钾___________ g。
 )广泛用于工农业生产中,以磷灰石为原料生产磷酸二氢钾的工业流程为:
)广泛用于工农业生产中,以磷灰石为原料生产磷酸二氢钾的工业流程为:I.制备磷酸
方法1——热法(如图)
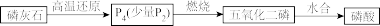
方法2——湿法(如图)

已知:①磷灰石的主要成分是
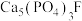 ,还含有铝、铁、镁、硅等元素。
,还含有铝、铁、镁、硅等元素。②白磷(
 )常温下为固体,易升华。
)常温下为固体,易升华。③除了钾、钠、铵外的磷酸盐、磷酸一氢盐往往难溶于水;磷酸二氢盐绝大多数都易溶于水。
(1)热法和湿法都需要先将磷灰石粉碎,目的是
(2)“高温还原”是在石英砂(主要成分
 )存在下,用焦炭将
)存在下,用焦炭将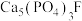 还原,反应过程中同时有CO和两种钙盐生成,主要反应的化学方程式为
还原,反应过程中同时有CO和两种钙盐生成,主要反应的化学方程式为(3)“酸浸”时,用两酸(硫酸和磷酸)分步浸取比只用硫酸浸取率更高,先加入的酸为
(4)“脱硫”时,用
 除去粗磷酸中少量的
除去粗磷酸中少量的 ,其离子方程式为
,其离子方程式为(5)与湿法相比,热法制备磷酸的缺点是
II.制备磷酸二氢钾
向原料液(含等物质的量KCl与
 的水溶液)加入正三丁胺(难溶于水的无色液体、弱碱),保持30℃一个小时,抽滤,滤饼经洗涤、干燥得磷酸二氢钾,滤液中加入氨水再生有机相,并生成副产物。
的水溶液)加入正三丁胺(难溶于水的无色液体、弱碱),保持30℃一个小时,抽滤,滤饼经洗涤、干燥得磷酸二氢钾,滤液中加入氨水再生有机相,并生成副产物。(6)正三丁胺在制备过程中的作用为
(7)副产物的化学式为
(8)若制备磷酸过程中磷元素损失a%,制备磷酸二氢钾时原料的转化率为b%,则1吨含“
 ”(类似于盐可写成氧化物的形式)28.4%的磷灰石可生产磷酸二氢钾
”(类似于盐可写成氧化物的形式)28.4%的磷灰石可生产磷酸二氢钾
您最近一年使用:0次
名校
解题方法
7 . 某化工厂设计用含钴废催化剂(Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体(CoCl2·6H2O)与新型高效消毒剂高铁酸钾(K2FeO4)的工艺流程如下:
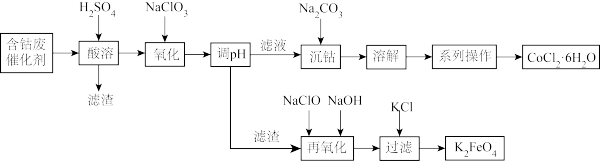
已知:①常温下Fe(OH)3的溶度积为1×10-35,Co(OH)2的溶度积为1.6×10-15
②CoCl2·6H2O呈红色,常温下稳定,易溶于水、乙醇。110-120℃时脱水形成蓝色无水氯化钴。
(1)酸溶时,写出能加快反应速率一种方法:_______ 。
(2)加入氯酸钠氧化的目的是_______ 。
(3)若溶液中Co2+为0.16mol·L-1,则调节pH的范围应为_______ 。
(4)再氧化时,发生反应的化学方程式是_______ 。同条件下溶解度Na2FeO4_______ (填“>”“=”“<”)K2FeO4
(5)得到产品CoCl2·6H2O所进行的一系列操作为_______ 、_______ 、过滤制得CoCl2·6H2O需要减压烘干的原因是_______ 。

已知:①常温下Fe(OH)3的溶度积为1×10-35,Co(OH)2的溶度积为1.6×10-15
②CoCl2·6H2O呈红色,常温下稳定,易溶于水、乙醇。110-120℃时脱水形成蓝色无水氯化钴。
(1)酸溶时,写出能加快反应速率一种方法:
(2)加入氯酸钠氧化的目的是
(3)若溶液中Co2+为0.16mol·L-1,则调节pH的范围应为
(4)再氧化时,发生反应的化学方程式是
(5)得到产品CoCl2·6H2O所进行的一系列操作为
您最近一年使用:0次
2022·江苏·模拟预测
解题方法
8 . 铁矿石中含铁量的测定是铁元素提炼的基础和前提,目前主要采用重铬酸钾法测定铁矿石中的铁含量,其流程如图所示:
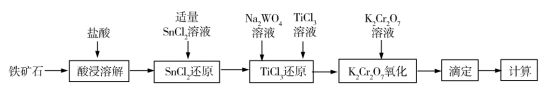
已知:①氧化性顺序: >Fe3+>WO
>Fe3+>WO ;
;
②Sn在溶液中的主要存在形式为Sn2+和SnCl ;
;
③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有_______ (任写两条)。
(2)“SnCl2还原”过程的离子反应方程式为_______ 。
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为_______ ,Na2WO4的作用为_______ 。
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是_______ 。
(5)“滴定”过程以二苯胺磺酸钠为指示剂,用酸性K2Cr2O7标准溶液滴定,滴定的反应离子方程式为_______ ;平行滴定5次,其中一组数据异常,所测c(Fe3+)偏大,原因可能是_______ (填标号)。
A.滴定终点读数时仰视滴定管刻度线
B.摇动锥形瓶时有液体溅出
C.未进行“K2Cr2O7氧化”过程就开始滴定
D.加入二苯胺磺酸钠指示剂的量过多
(6)现称取mg铁矿石进行测定,“滴定”时共消耗VmLcmol·L−1K2Cr2O7,则该铁矿石中铁的质量分数为_______ (用含m、c、V的代数式表示)。

已知:①氧化性顺序:
 >Fe3+>WO
>Fe3+>WO ;
;②Sn在溶液中的主要存在形式为Sn2+和SnCl
 ;
;③二苯胺磺酸钠可作氧化还原指示剂,氧化型为紫红色,还原型为无色。
回答下列问题:
(1)提高“酸浸溶解”速率可采取的措施有
(2)“SnCl2还原”过程的离子反应方程式为
(3)“SnCl2还原”后溶液仍呈浅黄色,而“TiCl3还原”后溶液呈现蓝色溶液(五价钨溶液为蓝色),则蓝色溶液中铁元素的主要存在形式为
(4)滴定前先进行“K2Cr2O7氧化”,即滴加K2Cr2O7溶液至溶液蓝色褪去,请分析该过程的目的是
(5)“滴定”过程以二苯胺磺酸钠为指示剂,用酸性K2Cr2O7标准溶液滴定,滴定的反应离子方程式为
A.滴定终点读数时仰视滴定管刻度线
B.摇动锥形瓶时有液体溅出
C.未进行“K2Cr2O7氧化”过程就开始滴定
D.加入二苯胺磺酸钠指示剂的量过多
(6)现称取mg铁矿石进行测定,“滴定”时共消耗VmLcmol·L−1K2Cr2O7,则该铁矿石中铁的质量分数为
您最近一年使用:0次
名校
解题方法
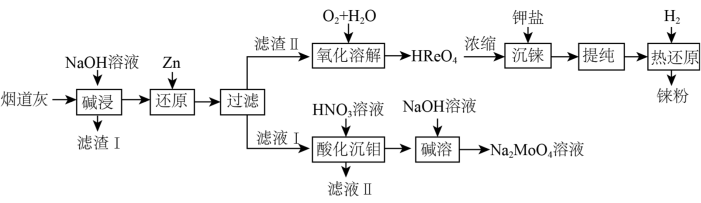
9 . 铼(Re)是地壳中最稀有的元素之一,广泛用于航天航空等领域。从辉钼矿氧化焙烧后的烟道灰(主要成分有 、
、 、CuO、
、CuO、 )中提取铼粉和制钼酸钠的流程如下图所示。
)中提取铼粉和制钼酸钠的流程如下图所示。
已知:
Ⅰ. 是酸性氧化物,溶于水生成一元强酸高铼酸(
是酸性氧化物,溶于水生成一元强酸高铼酸(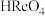 )。
)。
Ⅱ.Zn与Al性质相似。
Ⅲ.高铼酸钾(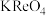 )微溶于冷水。
)微溶于冷水。
回答下列问题:
(1)“碱浸”时,提高碱浸效率的方法是_______ ,“滤渣Ⅰ”的主要成分为_______ (填化学式)。
(2)“还原”时,Zn被氧化成 ,铼的化合物被还原生成难溶的
,铼的化合物被还原生成难溶的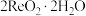 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(3)滤液Ⅱ中的金属阳离子是_______ 。
(4)“氧化溶解”时,往往通氧气并进行加压,目的是_______ 。
(5)“热还原”过程是在管式电炉中,800℃时通入氢气,反应的化学方程式是_______ 。
(6)不纯的 溶液中若含少量可溶性硫酸盐杂质,可加入
溶液中若含少量可溶性硫酸盐杂质,可加入 固体除去
固体除去 ,若溶液中
,若溶液中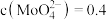 mol/L,
mol/L,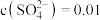 mol/L,在结晶前加入
mol/L,在结晶前加入 固体,当
固体,当 开始沉淀时,
开始沉淀时, 的去除率是
的去除率是_______ 。(溶液体积变化可忽略不计, ,
,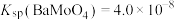 )
)
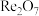 、
、 、CuO、
、CuO、 )中提取铼粉和制钼酸钠的流程如下图所示。
)中提取铼粉和制钼酸钠的流程如下图所示。
已知:
Ⅰ.
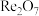 是酸性氧化物,溶于水生成一元强酸高铼酸(
是酸性氧化物,溶于水生成一元强酸高铼酸(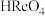 )。
)。Ⅱ.Zn与Al性质相似。
Ⅲ.高铼酸钾(
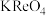 )微溶于冷水。
)微溶于冷水。回答下列问题:
(1)“碱浸”时,提高碱浸效率的方法是
(2)“还原”时,Zn被氧化成
 ,铼的化合物被还原生成难溶的
,铼的化合物被还原生成难溶的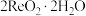 ,该反应的离子方程式为
,该反应的离子方程式为(3)滤液Ⅱ中的金属阳离子是
(4)“氧化溶解”时,往往通氧气并进行加压,目的是
(5)“热还原”过程是在管式电炉中,800℃时通入氢气,反应的化学方程式是
(6)不纯的
 溶液中若含少量可溶性硫酸盐杂质,可加入
溶液中若含少量可溶性硫酸盐杂质,可加入 固体除去
固体除去 ,若溶液中
,若溶液中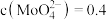 mol/L,
mol/L,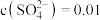 mol/L,在结晶前加入
mol/L,在结晶前加入 固体,当
固体,当 开始沉淀时,
开始沉淀时, 的去除率是
的去除率是 ,
,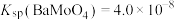 )
)
您最近一年使用:0次
解题方法
10 . 铜阳极泥含有Cu、Ag、Pt、Au、Ag2Se和Cu2S等,下图是从中回收Se和贵重金属的工艺:

已知:
①该工艺中萃取与反萃取原理为2RH+Cu2+⇌R2Cu+2H+;
② 在碱性条件下很稳定,易与Ag+络合:Ag++2
在碱性条件下很稳定,易与Ag+络合:Ag++2 ⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
回答下列问题:
(1)写出“焙烧”时Ag2Se生成Ag2O的化学方程式_______ ,“洗气”时n(氧化剂):n(还原剂)=_______ 。
(2)写出“滤渣I”的一种用途_______ ;“酸浸氧化”中通入气体X可防止污染,写出X的名称_______ 。
(3)在实验室进行萃取操作所需的玻璃仪器_______ 。“反萃取剂”最好选用_______ (填化学式)溶液。
(4)“溶浸”中发生的反应为AgCl(s)+2 (aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:
(aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:_______ 。[已知Ksp(AgCl)=1.80×10-10]。
(5)“滤液IV”中含有Na2SO3,则“还原”中发生反应的离子方程式为_______ 。“滤液IV”可返回“溶浸”工序循环使用,但循环多次后,银的浸出率会降低,原因是_______ (试用平衡原理解释)。

已知:
①该工艺中萃取与反萃取原理为2RH+Cu2+⇌R2Cu+2H+;
②
 在碱性条件下很稳定,易与Ag+络合:Ag++2
在碱性条件下很稳定,易与Ag+络合:Ag++2 ⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。
⇌[Ag(S2O3)2]3-,常温下该反应的平衡常数K=2.80×1013。回答下列问题:
(1)写出“焙烧”时Ag2Se生成Ag2O的化学方程式
(2)写出“滤渣I”的一种用途
(3)在实验室进行萃取操作所需的玻璃仪器
(4)“溶浸”中发生的反应为AgCl(s)+2
 (aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:
(aq)⇌[Ag(S2O3)2]3-(aq)+C1-(aq),通过计算说明该反应能否进行完全:(5)“滤液IV”中含有Na2SO3,则“还原”中发生反应的离子方程式为
您最近一年使用:0次



