葡萄糖、葡萄糖酸在医疗和工业上有广泛用途。
(1)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。
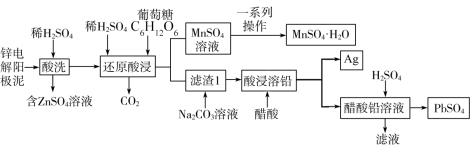
回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为_______ ;“还原酸浸”过程中主要反应的离子方程式为_______ 。
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是_______ ;将分离出晶体的母液收集、循环使用,其意义是_______ 。
③整个流程中可循环利用的物质是_______ ;加入Na2CO3溶液的目的是将PbSO4转化为PbCO3,Na2CO3溶液的最小浓度为_______ mol·L-1(保留一位小数);PbSO4(s)+ (aq)⇌PbCO3(s)+
(aq)⇌PbCO3(s)+ (aq),平衡常数K=
(aq),平衡常数K=_______ (列出计算式)。
(2)工业上常采用电渗析法从含葡萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。
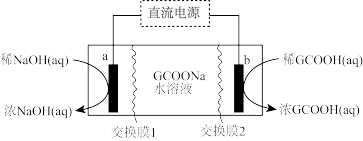
①交换膜1为_______ 交换膜(选填“阴离子”、“阳离子”);电路中通过2mol电子时,理论上回收_______ gNaOH。
②b电极上发生反应的电极反应式为_______ 。
(1)锌电解阳极泥(主要成分为MnO2、PbSO4和ZnO,还有少量锰铅氧化物Pb2Mn8O16和Ag)是冶锌过程中产生的废渣,一种回收锌电解阳极泥中金属元素锌、锰、铅和银的工艺如图。

回答下列问题:
已知:MnSO4·H2O易溶于水,不溶于乙醇。20℃时Ksp(PbSO4)=1.6×10-8mol2·L-2,Ksp(PbCO3)=7.4×10-14mol2·L-2,1.262≈1.6。
①“酸洗”过程中生成硫酸锌的离子方程式为
②实验室中获得MnSO4·H2O晶体的一系列操作是指蒸发结晶趁热过滤、洗涤、干燥,其中洗涤的具体操作是
③整个流程中可循环利用的物质是
 (aq)⇌PbCO3(s)+
(aq)⇌PbCO3(s)+ (aq),平衡常数K=
(aq),平衡常数K=(2)工业上常采用电渗析法从含葡萄糖酸钠(用GCOONa表示)的废水中提取化工产品葡萄糖酸(GCOOH)和烧碱,模拟装置如图所示(电极均为石墨)。

①交换膜1为
②b电极上发生反应的电极反应式为
更新时间:2022-06-14 21:35:33
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
【推荐1】H2S和SO2是两种大气污染物,H2S和SO2的转化是资源利用和环境保护的重要研究课题。
(1)H2S与CO2发生如下反应:H2S(g)+CO2(g) COS(g)+H2O(g)△H相关的化学键键能数据如表:
COS(g)+H2O(g)△H相关的化学键键能数据如表:
由此计算△H=__ 。
(2)高温下CO可将SO2还原成硫蒸气:4CO(g)+2SO2(g) 4CO2(g)+S2(g)△H1<0。
4CO2(g)+S2(g)△H1<0。
①平衡时CO的体积分数(%)与温度和压强的关系如图1所示(虚线框表示没有测定该条件下的数据)。
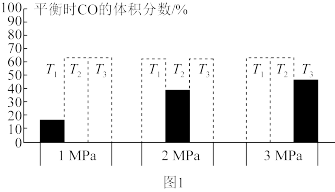
T1、T2、T3由大到小的关系是__ ,判断的理由是___ 。
②742K时,在起始压强为p0,体积为VL的恒容密闭容器中投入amolCO和0.5amolSO2,达到平衡后容器压强变为0.9p0,则SO2的平衡转化率为__ ,该温度下该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度计算平衡常数,列出计算式即可)。
③该反应的正、逆反应速率表达式分别为v正=k正·c4(CO)·c2(SO2)、v逆=k逆·c4(CO2)·c(S2)。(k正、k逆分别为正、逆反应的反应速率常数,只与温度有关)Arrhenius提出了速率常数与温度的经验公式:k=A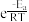 (k为速率常数,A为常数,e为自然对数的底数,R为理想气体常数,T为热力学温度,Ea为活化能)。在相同温度下,活化能越大,速率常数越
(k为速率常数,A为常数,e为自然对数的底数,R为理想气体常数,T为热力学温度,Ea为活化能)。在相同温度下,活化能越大,速率常数越__ (填“大”或“小”)。当该反应达到平衡后,升高温度,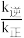
___ (填“增大”、“减小”或“不变”)。
(3)电化学处理H2S和SO2是近年来发展迅速的废气处理方法。某科研小组将微电池技术用于去除工业尾气中的H2S,装置示意图如图2,主要反应为2Fe+2H2S+O2=2FeS+2H2O,室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。装置中微电池负极的电极反应式为___ 。一段时间后,单位时间内H2S的去除率降低,可能的原因是__ 。

(1)H2S与CO2发生如下反应:H2S(g)+CO2(g)
 COS(g)+H2O(g)△H相关的化学键键能数据如表:
COS(g)+H2O(g)△H相关的化学键键能数据如表:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H—O | H—S |
| E/kJ•mol-1 | 803 | 739 | 577 | 465 | 399 |
(2)高温下CO可将SO2还原成硫蒸气:4CO(g)+2SO2(g)
 4CO2(g)+S2(g)△H1<0。
4CO2(g)+S2(g)△H1<0。①平衡时CO的体积分数(%)与温度和压强的关系如图1所示(虚线框表示没有测定该条件下的数据)。

T1、T2、T3由大到小的关系是
②742K时,在起始压强为p0,体积为VL的恒容密闭容器中投入amolCO和0.5amolSO2,达到平衡后容器压强变为0.9p0,则SO2的平衡转化率为
③该反应的正、逆反应速率表达式分别为v正=k正·c4(CO)·c2(SO2)、v逆=k逆·c4(CO2)·c(S2)。(k正、k逆分别为正、逆反应的反应速率常数,只与温度有关)Arrhenius提出了速率常数与温度的经验公式:k=A
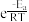 (k为速率常数,A为常数,e为自然对数的底数,R为理想气体常数,T为热力学温度,Ea为活化能)。在相同温度下,活化能越大,速率常数越
(k为速率常数,A为常数,e为自然对数的底数,R为理想气体常数,T为热力学温度,Ea为活化能)。在相同温度下,活化能越大,速率常数越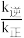
(3)电化学处理H2S和SO2是近年来发展迅速的废气处理方法。某科研小组将微电池技术用于去除工业尾气中的H2S,装置示意图如图2,主要反应为2Fe+2H2S+O2=2FeS+2H2O,室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。装置中微电池负极的电极反应式为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】科学家对CO2的应用研究日新月异。
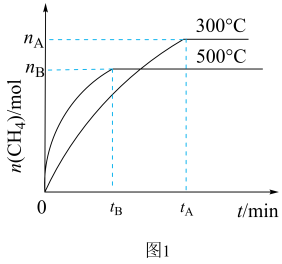
(1)科学家研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300℃,CO2与H2体积比为1︰4时在体积为V L的容器中反应,CO2转化率达90%。由图1可知升高温度,K将___ (填“增大”“减小”或“不变”);300℃时,从反应开始,到达到平衡,以H2的浓度变化表示化学反应速率是____ (用nA、tA、V表示)。
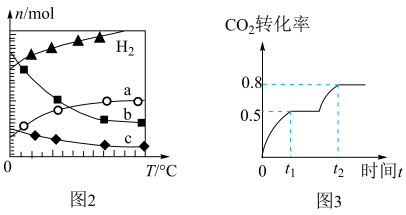
(2)CO2经催化加氢还可合成低碳烯烃有机物:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) ΔH=Q kJ·mol−1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) ΔH=Q kJ·mol−1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
①Q___ 0(填“>”“=”或“<”);
②曲线c表示的物质为____ ;
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是___ 。
(3)已知CO2(g)+2CH3OH(g) CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为
CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为_____ mL。
(1)科学家研制成功一种新型催化剂,能将CO2转变为甲烷。在常压、300℃,CO2与H2体积比为1︰4时在体积为V L的容器中反应,CO2转化率达90%。由图1可知升高温度,K将


(2)CO2经催化加氢还可合成低碳烯烃有机物:2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g) ΔH=Q kJ·mol−1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。
C2H4(g)+4H2O(g) ΔH=Q kJ·mol−1。在0.1MPa时,按n(CO2)︰n(H2)=1︰3投料,图2表示平衡时四种气态物质的物质的量(n)与温度(T)的关系。①Q
②曲线c表示的物质为
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是
(3)已知CO2(g)+2CH3OH(g)
 CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为
CH3OCOOCH3(g)+H2O(g)。在恒温容积可变的容器中加入1mol CO2、2mol CH3OH,CO2的转化率与反应时间如图3所示,在反应过程中加压,若t1时容器体积为1000mL,则t2时容器体积为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下: 2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应的相关的化学键键能数据如下:
则该反应的△H=________ kJ/mol.
(2)在恒容密闭容器中充入2molNO2 与1molO2发生反应如下:4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________ 。

②下列有关该反应的说法正确的是________ 。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________ 。

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L 的X、Y、Z、W溶液的pH。将X、Y、Z各1mol 同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________ 。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+ NaCl(s) NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g) 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+ 2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=_____ (用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min 时反应II达到平衡。测得10min 内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____ ;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___ α1(填“>”“<”或“=”)。
(1)在一定条件下: 2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)在恒容密闭容器中充入2molNO2 与1molO2发生反应如下:4NO2(g)+O2(g)
 2N2O5(g)
2N2O5(g)①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是

②下列有关该反应的说法正确的是
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为

(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L 的X、Y、Z、W溶液的pH。将X、Y、Z各1mol 同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I: 2NO2(g)+ NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1II:2NO(g)+Cl2(g)
 2ClNO(g) K2
2ClNO(g) K2①4NO(g)+ 2NaCl(s)
 2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=
2NaNO3(s)+ 2NO(g)+Cl2(g)的平衡常数K=②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min 时反应II达到平衡。测得10min 内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=
您最近一年使用:0次
【推荐1】草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4的工艺流程如下:

已知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是________ 。
(2)NaClO3可将Fe2+氧化为Fe3+离子。可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3。实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为________ (标准状况下)。

(3)萃取剂对金属离子的萃取率与pH的关系如图所示。使用萃取剂最适宜的pH是________ (填选项序号)。
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液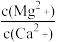 =
=________ 。
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由时________ (填颜色变化),共用去高锰酸钾溶液VmL,计算草酸钴样品的纯度为________ 。

已知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3可将Fe2+氧化为Fe3+离子。可用氯气通入到热的浓氢氧化钠溶液来制取NaClO3。实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为

(3)萃取剂对金属离子的萃取率与pH的关系如图所示。使用萃取剂最适宜的pH是
| A.接近2.0 | B.接近3.0 | C.接近5.0 |
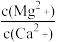 =
=(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由时
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】中国的锰矿石和锌矿石产地在云南、广东、青海等。软锰矿是一种常见的锰矿石,其主要成分是MnO2,含少量Al2O3和SiO2。闪锌矿主要成分是ZnS,含少量FeS、CuS、CdS等杂质,晶体属于六方晶系。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下。
已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
回答下列问题:
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式___________________ 。
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是_________________ 。
(3)步骤③中MnO2的作用是___________________ ,另外一种物质X可以是___________________ 。
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____________________ 。
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为_____________________ 。
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=________ 。[已知:Ksp(MnS)=1.4×10-15]

已知:Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
(1)步骤①中MnO2、CuS与硫酸共热时有淡黄色物质析出,请写出该反应的化学方程
式
(2)步骤②加入适量金属锌是为了回收金属,回收金属的主要成分是
(3)步骤③中MnO2的作用是
A.ZnO B.MgO C.Cu2(OH)2CO3 D.MnCO3
(4)锂离子电池的正极材料有多种,其中MnO2与Li构成LiMnO2是一种常见的正极材料。电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,
向NaCN溶液中通入少量的H2S气体,反应的离子方程式为
在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L-1 Mn2+废水
中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10―4 mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上以孔雀石(主要成分为 ,其杂质有铁和硅的氧化物)为原料制备胆矾的流程如下图所示:
,其杂质有铁和硅的氧化物)为原料制备胆矾的流程如下图所示:

已知:① ,
, ,
, ;
;
②溶液中的离子浓度等于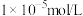 时就认为沉淀完全。
时就认为沉淀完全。
回答下列问题:
(1)粉碎的目的是_______ 。
(2)酸浸产生气体的化学方程式为_______ 。
(3)试剂b可选用_______ (填序号),氧化时的离子方程式为_______ 。
A. B.空气 C.
B.空气 C. D.
D.
(4)氧化后的溶液中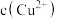 为
为 ,则调节
,则调节 的范围是
的范围是_______ ,用平衡移动原理解释产生滤渣2的原因是_______ 。
(5)滤液得产品的操作是_______ 、_______ 、过滤、洗涤、干燥。
(6)若流程中省掉加试剂b氧化步骤,其后果是_______ 。
 ,其杂质有铁和硅的氧化物)为原料制备胆矾的流程如下图所示:
,其杂质有铁和硅的氧化物)为原料制备胆矾的流程如下图所示:
已知:①
 ,
, ,
, ;
;②溶液中的离子浓度等于
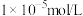 时就认为沉淀完全。
时就认为沉淀完全。回答下列问题:
(1)粉碎的目的是
(2)酸浸产生气体的化学方程式为
(3)试剂b可选用
A.
 B.空气 C.
B.空气 C. D.
D.
(4)氧化后的溶液中
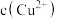 为
为 ,则调节
,则调节 的范围是
的范围是(5)滤液得产品的操作是
(6)若流程中省掉加试剂b氧化步骤,其后果是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】SbCl3可用于红外光谱分析用溶剂、显像管生产等。以某矿渣(主要成分为Sb2O3,含有少量CuO、As2O3等杂质)为原料制备SbCl3的工艺流程如图所示:
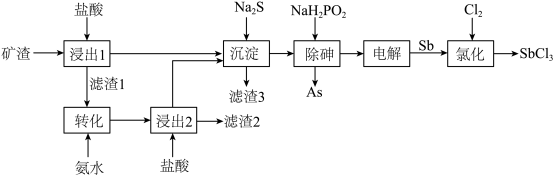
已知:①Sb属于第VA族元素,主要化合价为+3、+5价。
②常温下,Ksp(CuS)=6.3×10-36,Ksp(Sb2S3)=1.5×10-93。
③As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
④次磷酸(H3PO2)为一元中强酸,具有强还原性。
回答下列问题:
(1)基态As的简化电子排布式为___________ ;As、P、Cl三种元素的电负性从大到小的顺序为___________ 。
(2)“滤渣1”的主要成分是SbOCl,为了提高锑的利用率,将滤渣1用氨水浸取使其转化为Sb2O3,写出该反应的离子方程式:___________ 。
(3)已知“沉淀”阶段溶液中c(Sb3+)起始=0.01mol·L-1.当“沉淀”后溶液中c(Cu2+)=6.3×10-6mol·L-1时,该阶段是否有Sb2S3沉淀生成?___________ (通过计算说明,简要写出计算过程,不考虑溶液体积的变化)。
(4)“除砷”时,NaH2PO2的氧化产物为H3PO4。
①NaH2PO2的化学名称为___________ 。H3PO4中磷原子的杂化类型为___________ 。
②“除砷”过程中生成As的反应的化学方程式是___________ 。
(5)“电解”SbCl3溶液时,被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2,则电解方程式为___________ 。

已知:①Sb属于第VA族元素,主要化合价为+3、+5价。
②常温下,Ksp(CuS)=6.3×10-36,Ksp(Sb2S3)=1.5×10-93。
③As2O3微溶于水、Sb2O3难溶于水,它们均为两性氧化物;SbOCl难溶于水。
④次磷酸(H3PO2)为一元中强酸,具有强还原性。
回答下列问题:
(1)基态As的简化电子排布式为
(2)“滤渣1”的主要成分是SbOCl,为了提高锑的利用率,将滤渣1用氨水浸取使其转化为Sb2O3,写出该反应的离子方程式:
(3)已知“沉淀”阶段溶液中c(Sb3+)起始=0.01mol·L-1.当“沉淀”后溶液中c(Cu2+)=6.3×10-6mol·L-1时,该阶段是否有Sb2S3沉淀生成?
(4)“除砷”时,NaH2PO2的氧化产物为H3PO4。
①NaH2PO2的化学名称为
②“除砷”过程中生成As的反应的化学方程式是
(5)“电解”SbCl3溶液时,被氧化的Sb元素与被还原的Sb元素的质量之比为3∶2,则电解方程式为
您最近一年使用:0次
【推荐2】当今,世界多国相继规划了碳达峰、碳中和的时间节点,降低空气中二氧化碳含量成为研究热点。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一。
(1)大气中二氧化碳的主要来源是煤、石油及其他含碳化合物的燃烧。已知25℃时:
①6C(石墨,s)+3H2(g)=C6H6(l) △H=+49.1kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
③H2(g)+ O2(g)=H2O(l) △H=-285.8kJ·mol-1
O2(g)=H2O(l) △H=-285.8kJ·mol-1
则25℃时C6H6(l)的燃烧热△H=___ 。
(2)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),改变氢碳比[
CH3OH(g)+H2O(g),改变氢碳比[ ],在不同温度下反应达到平衡状态,测得的实验数据如表。
],在不同温度下反应达到平衡状态,测得的实验数据如表。
①下列说法中正确的是___ (填标号)。
A.v(CH3OH)=v(CO2)时,反应达到平衡
B.增大氢碳比,平衡正向移动,平衡常数增大
C.CO2和H2合成甲醇为放热反应
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为___ 。
(3)二氧化碳催化加氢合成乙烯的原理为2CO2(g)+6H2(g) C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。
C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。

①CO2催化加氢合成C2H4反应的△H___ 0(填“大于”或“小于”)。
②根据图中点A(a、b两线交点),计算该温度时反应的平衡常数Kp=___ (MPa)-3(列出计算式,以分压表示,分压=总压×物质的量分数)。
(4)电解法转化CO2可实现CO2的资源化利用,电解CO2制HCOO-的原理示意图如图2所示:装置中Pt片应与电源的___ 极相连,反应时阴极电极反应式为___ 。
(1)大气中二氧化碳的主要来源是煤、石油及其他含碳化合物的燃烧。已知25℃时:
①6C(石墨,s)+3H2(g)=C6H6(l) △H=+49.1kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
③H2(g)+
 O2(g)=H2O(l) △H=-285.8kJ·mol-1
O2(g)=H2O(l) △H=-285.8kJ·mol-1则25℃时C6H6(l)的燃烧热△H=
(2)CO2和H2在一定条件下合成甲醇。在2L恒容密闭容器中充入总物质的量为6mol的CO2和H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),改变氢碳比[
CH3OH(g)+H2O(g),改变氢碳比[ ],在不同温度下反应达到平衡状态,测得的实验数据如表。
],在不同温度下反应达到平衡状态,测得的实验数据如表。| 温度/K CO2转化率/%  | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 40 | 22 |
A.v(CH3OH)=v(CO2)时,反应达到平衡
B.增大氢碳比,平衡正向移动,平衡常数增大
C.CO2和H2合成甲醇为放热反应
D.当混合气体密度不变时,达到平衡
②在700K、氢碳比为3.0的条件下,若5min时反应达到平衡状态,则0~5min内用H2表示的平均反应速率为
(3)二氧化碳催化加氢合成乙烯的原理为2CO2(g)+6H2(g)
 C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。
C2H4(g)+4H2O(g)。原料初始组成n(CO2):n(H2)=1:3,体系压强恒定为0.1MPa,不同温度下反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图1所示。
①CO2催化加氢合成C2H4反应的△H
②根据图中点A(a、b两线交点),计算该温度时反应的平衡常数Kp=
(4)电解法转化CO2可实现CO2的资源化利用,电解CO2制HCOO-的原理示意图如图2所示:装置中Pt片应与电源的

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】用零价铁(Fe)进行水体脱氮、(去除水体中的NO3-),已成为环境修复研究的热点之一。
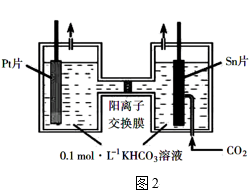
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是________ ,正极的电极反应式是_________ 。
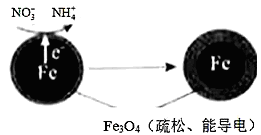
(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
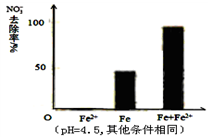
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是_______ 。
②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为_______________ ,加入Fe2+提高NO3-去除率的原因:____________ 。
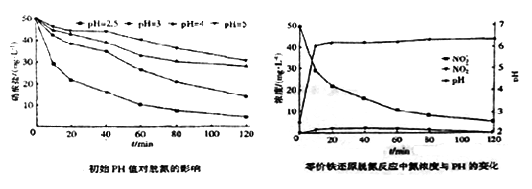
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为_________________ 。
(1)Fe还原水体中NO3-的反应原理如图所示。其中作负极的物质是

(2)研究表明,零价铁脱氮后最终会在表面生成不导电的FeO(OH)外皮,从而使得脱氮过程停止。补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;Ⅱ. Fe2+破坏FeO(OH)氧化层。
针对假设I:做对比实验,结果如图所示,可得到的结论是

②针对假设II:以同位素示踪法,证实Fe2+能与FeO(OH)反应生成Fe3O4。该反应的离子方程式为
(3)将足量铁粉投入水体中,测定不同初始pH对脱氧的影响见下边左图,初始PH为2.5时氮浓度与pH变化见下边图。结合两图分析,不同初始pH对脱氮产生影响的原因为

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:

(1)反应I中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为___________ 。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是___________ ;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是___________ 。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,___________ 。
(4)整个流程中,可循环利用的物质有___________ (填化学式)。
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B(NOCl),该反应的化学方程式为___________ ;气体B与O2反应生成1体积气体A和2体积红棕色气体C,该反应的化学方程式为___________ 。

(1)反应I中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,
(4)整个流程中,可循环利用的物质有
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B(NOCl),该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】钛(T)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由钛铁矿(主要成分是钛酸亚铁FeTiO3)提取金属钛并获得副产品FeSO4·7H2O的工艺流程如下:
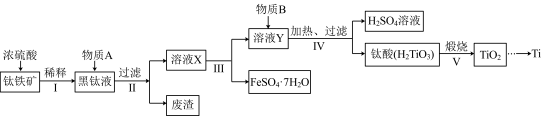
(1)钛铁矿和浓硫酸反应的产物之一是 TiOSO4。常温下,该物质易溶于酸性溶液,在pH=5.0时开始转化为钛酸沉淀,则物质A是___________ (填化学式,下同),B是___________ ;步骤Ⅳ生成TiO(OH)2(H2TiO3)的离子方程式是______________________ 。
(2)已知FeSO4·7H2O和TiOSO4的溶解度曲线如图所示,则步骤Ⅲ采用的操作是___________ 。

(3)工业上可通过下列反应由TiO2制备金属Ti:
TiO2+2C+2Cl2 TiCi4+2CO
TiCi4+2CO
TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
已知:常温下TiCl4是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl4,按气流方向连接起来:A→___________ →___________ →___________ →___________ →C→___________ 。

②下列仪器中盛放的药品分别是B___________ ,G___________ 。
(4)一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品0.60g,消耗0.20mol/L的NH4Fe(SO4)2溶液36.75mL,则样品中TiO2的质量分数是___________ 。

(1)钛铁矿和浓硫酸反应的产物之一是 TiOSO4。常温下,该物质易溶于酸性溶液,在pH=5.0时开始转化为钛酸沉淀,则物质A是
(2)已知FeSO4·7H2O和TiOSO4的溶解度曲线如图所示,则步骤Ⅲ采用的操作是

(3)工业上可通过下列反应由TiO2制备金属Ti:
TiO2+2C+2Cl2
 TiCi4+2CO
TiCi4+2COTiCl4+2Mg
 Ti+2MgCl2
Ti+2MgCl2已知:常温下TiCl4是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl4,按气流方向连接起来:A→

②下列仪器中盛放的药品分别是B
(4)一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品0.60g,消耗0.20mol/L的NH4Fe(SO4)2溶液36.75mL,则样品中TiO2的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】苯胺( ),沸点为184℃,有碱性,易被氧化,微溶于水,易溶于乙醚等有机物,广泛应用于医药和染料行业。实验室用硝基苯与H2反应制备苯胺的反应原理为:
),沸点为184℃,有碱性,易被氧化,微溶于水,易溶于乙醚等有机物,广泛应用于医药和染料行业。实验室用硝基苯与H2反应制备苯胺的反应原理为: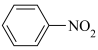 +3H2
+3H2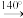
 +2H2O,实验装置如图所示(部分夹持装置省略)。
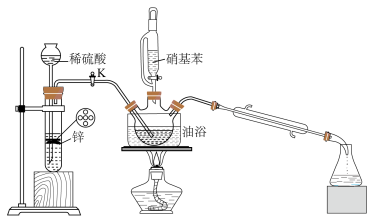
+2H2O,实验装置如图所示(部分夹持装置省略)。
已知: +HCl
+HCl
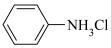 (苯胺盐酸盐,易溶于水)
(苯胺盐酸盐,易溶于水)
(1)试管中发生反应的离子方程式为
(2)实验时,须先打开K,通一段时间H2的原因是
(3)实验制得苯胺粗品中含有少量硝基苯,某同学设计如下流程提纯苯胺、回收硝基苯。
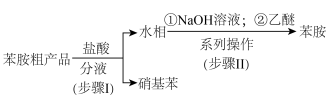
③“步骤Ⅱ”中,加入乙醚的作用是
A.浓硫酸 B.碱石灰 C.无水MgSO4 D.P2O5
您最近一年使用:0次



