1 . 氯化银(AgCl,白色)、铬酸银( ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或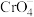 )。下列叙述正确的是
)。下列叙述正确的是
 ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或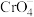 )。下列叙述正确的是
)。下列叙述正确的是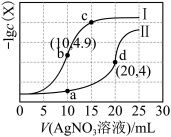
A.T℃下,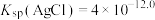 |
B.曲线Ⅱ表示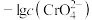 与V( 与V( 溶液)的变化关系 溶液)的变化关系 |
| C.向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 |
D.浓度均为 的 的 和 和 ,可通过分步沉淀进行分离 ,可通过分步沉淀进行分离 |
您最近半年使用:0次
名校
2 . 某工业废水中含有较高浓度的 及少量的
及少量的 、
、 ,欲回收锰元素并净化废水,实验小组设计了如图流程:
,欲回收锰元素并净化废水,实验小组设计了如图流程: )如表:
)如表:
下列说法错误的是
 及少量的
及少量的 、
、 ,欲回收锰元素并净化废水,实验小组设计了如图流程:
,欲回收锰元素并净化废水,实验小组设计了如图流程: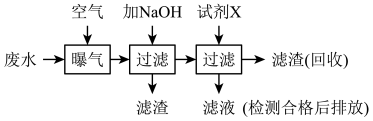
 )如表:
)如表:| 沉淀物 |  |  |  | MnS |
 | 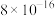 | 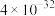 | 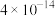 | 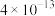 |
A.通空气氧化 ,可降低NaOH的用量 ,可降低NaOH的用量 |
B. 的3d能级处于半充满状态,稳定性较好 的3d能级处于半充满状态,稳定性较好 |
C.试剂X可用 ,它比NaOH更有利于滤液检测合格 ,它比NaOH更有利于滤液检测合格 |
D. 悬浊液中加 悬浊液中加 , , 不可能转化为MnS 不可能转化为MnS |
您最近半年使用:0次
3 . 某温度下,PbCO3饱和溶液和PbI2饱和溶液中的阴、阳离子浓度满足如图所示的关系。
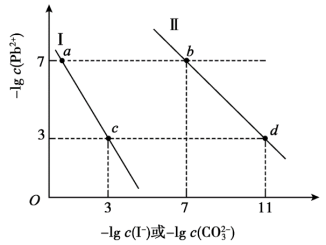
| A.曲线Ⅰ表示PbCO3的溶解平衡 |
| B.该温度下Ksp(PbI2):Ksp(PbCO3)=108 |
| C.曲线Ⅱ上的b点可通过改变温度移动至d点 |
| D.向PbI2的悬浊液中加入Na2CO3浓溶液,可以将其转化成PbCO3 |
您最近半年使用:0次
4 . 某科研人员以废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO)为原料回收镍,工艺流程如图。
回答下列问题:
(1)为提高“酸浸”时镍的浸取率,可采取的措施有___________ (写一条);
(2)浸出渣主要成分为___________ (填化学式);
(3)“除铜”时,写出生成S的离子方程式___________ ;
(4)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,该步骤温度不能太高的原因是___________ ;
(5)“调pH”时,pH的控制范围为___________ ;
(6)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程发生反应:CaSO4(s) (ag)
(ag) CaCO3(s)
CaCO3(s) (aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为___________ 。

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)为提高“酸浸”时镍的浸取率,可采取的措施有
(2)浸出渣主要成分为
(3)“除铜”时,写出生成S的离子方程式
(4)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,该步骤温度不能太高的原因是
(5)“调pH”时,pH的控制范围为
(6)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程发生反应:CaSO4(s)
 (ag)
(ag) CaCO3(s)
CaCO3(s) (aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
您最近半年使用:0次
5 . 已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(Ag2CrO4)=2.0×10-12.某溶液中含有Cl-、Br-和 的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
 的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为A.Br-、Cl-、 | B. 、Br-、Cl- 、Br-、Cl- | C.Cl-、Br-、 | D.Br-、 、Cl- 、Cl- |
您最近半年使用:0次
名校
解题方法
6 . 室温下,用饱和Na2CO3溶液浸泡BaSO4粉末,一段时间后过滤,向滤渣中加入过量盐酸产生气泡,滤渣未完全溶解,已知:室温下 ,
,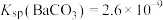 ,下列说法
,下列说法错误 的是
 ,
,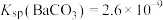 ,下列说法
,下列说法A.反应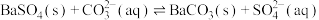 正向进行,需满足 正向进行,需满足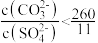 |
| B.室温下,BaSO4的溶解度小于BaCO3的溶解度 |
C.滤渣中加入盐酸反应的离子方程式: |
D.过滤后所得清液中存在: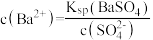 ,且 ,且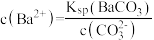 |
您最近半年使用:0次
7 . T℃时, 和
和 的沉淀溶解平衡曲线如图所示,已知
的沉淀溶解平衡曲线如图所示,已知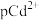 为
为 浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
 和
和 的沉淀溶解平衡曲线如图所示,已知
的沉淀溶解平衡曲线如图所示,已知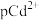 为
为 浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是
浓度的负对数,pN为阴离子浓度的负对数,下列说法正确的是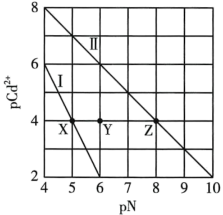
A.X点: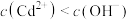 ,Z点: ,Z点: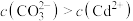 |
B.溶度积的负对数: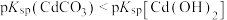 |
C.Y点对应的 溶液为不饱和溶液,可以继续溶解 溶液为不饱和溶液,可以继续溶解 |
D.T℃时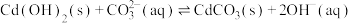 的平衡常数K为 的平衡常数K为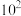 |
您最近半年使用:0次
8 . 已知:常温下Ksp(CuS)<Ksp(PbS)。25℃时,饱和溶液中–lgc(S2-)与-lgc(X)的关系如图所示,其中,X代表Cu2+、Pb2+。下列叙述错误的是
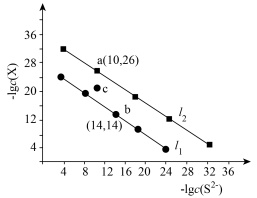
| A.l1直线代表–lgc(S2-)与-lgc(Pb2+)的关系 |
| B.该温度下Ksp(CuS)=1.0×10-36 |
| C.加热,可使溶液由c点变到a点 |
D.PbS(s)+Cu2+(aq) CuS(s)+Pb2+(aq)的平衡常数K=108 CuS(s)+Pb2+(aq)的平衡常数K=108 |
您最近半年使用:0次
名校
解题方法
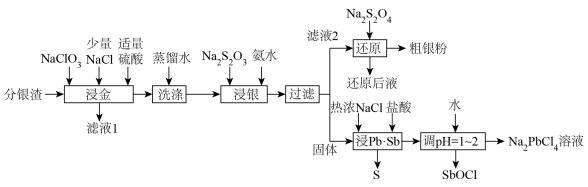
9 . 分银渣(主要成分为PbSO4、Sb2O3、AgCl、Ag2S、Au)是电解精炼铜的尾渣,具有较高的综合利用价值。一种提取流程如下:
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3 S+Na2SO3。
S+Na2SO3。
回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为___________ ,“浸金”过程中Ag2S转化为AgCl的离子方程式为__________
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是___________ ;
(3)“浸银”操作前先进行“洗涤”操作的目的是___________ ;
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O
 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是___________ ;
(5)“还原”过程中S2O 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到___________ 操作中(填操作单元名称)。
(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为___________ ,电解Na2PbCl4溶液制备金属单质Pb,装置如图,电路中通过0.2mole-时,阴极的质量增加___________ g。
2.Ksp(PbSO4)=2.53×10-8,Ksp(PbCl2)=1.70×10-5;
3.升高温度时,发生反应:Na2S2O3
 S+Na2SO3。
S+Na2SO3。回答下列问题:
(1)滤液1的主要成分为HAuCl4,该物质中金元素的化合价为
(2)“浸金”过程中加入适量硫酸,除防止Pb部分转化为PbCl2造成损失,还具有的作用是
(3)“浸银”操作前先进行“洗涤”操作的目的是
(4)“浸银”过程控制pH=8~10,温度50℃,发生反应:AgCl+2S2O

 [Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是
[Ag(S2O3)2]3-+Cl-,“浸银”过程添加Na2SO3固体的作用是(5)“还原”过程中S2O
 被氧化为SO
被氧化为SO 。还原后液可循环使用,应当将其导入到
。还原后液可循环使用,应当将其导入到(6)“浸Pb、Sb”过程中生成Na2PbCl4的化学方程式为

您最近半年使用:0次
10 . 盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :_______ 。
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为______
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c( ) 由大到小的顺是
) 由大到小的顺是 _______ ( 用序号表示)。
(4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成_______ ( 填化学式)沉淀 ; 当体系中两种沉淀共存时,  =
= _______ 。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c(
 ) 由大到小的顺是
) 由大到小的顺是 (4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成
 =
=
您最近半年使用:0次



