1 . 25℃时, In(OH)3和
In(OH)3和 的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示
的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示 和
和 的浓度负对数
的浓度负对数 ,pOH表示OH—的浓度负对数
,pOH表示OH—的浓度负对数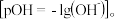 已知:
已知: 。下列说法正确的是
。下列说法正确的是
 In(OH)3和
In(OH)3和 的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示
的沉淀溶解平衡曲线如图所示。图中pc(阳离子)表示 和
和 的浓度负对数
的浓度负对数 ,pOH表示OH—的浓度负对数
,pOH表示OH—的浓度负对数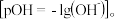 已知:
已知: 。下列说法正确的是
。下列说法正确的是
| A.Ⅱ线代表Ga(OH)3 |
B.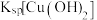 的数量级为10-19 的数量级为10-19 |
C. 恰好完全沉淀时溶液的pOH为9.4 恰好完全沉淀时溶液的pOH为9.4 |
D.向  和 和 均为1mol/L的混合液中滴加NaOH溶液,Cu(OH)2先沉淀 均为1mol/L的混合液中滴加NaOH溶液,Cu(OH)2先沉淀 |
您最近半年使用:0次
2 . 氯化银(AgCl,白色)、铬酸银( ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或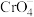 )。下列叙述正确的是
)。下列叙述正确的是
 ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或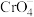 )。下列叙述正确的是
)。下列叙述正确的是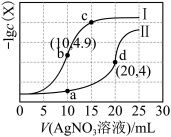
A.T℃下,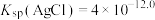 |
B.曲线Ⅱ表示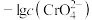 与V( 与V( 溶液)的变化关系 溶液)的变化关系 |
| C.向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 |
D.浓度均为 的 的 和 和 ,可通过分步沉淀进行分离 ,可通过分步沉淀进行分离 |
您最近半年使用:0次
3 . 某科研人员以废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO)为原料回收镍,工艺流程如图。
回答下列问题:
(1)为提高“酸浸”时镍的浸取率,可采取的措施有___________ (写一条);
(2)浸出渣主要成分为___________ (填化学式);
(3)“除铜”时,写出生成S的离子方程式___________ ;
(4)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,该步骤温度不能太高的原因是___________ ;
(5)“调pH”时,pH的控制范围为___________ ;
(6)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程发生反应:CaSO4(s) (ag)
(ag) CaCO3(s)
CaCO3(s) (aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为___________ 。

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(1)为提高“酸浸”时镍的浸取率,可采取的措施有
(2)浸出渣主要成分为
(3)“除铜”时,写出生成S的离子方程式
(4)“氧化”的目的是将溶液中Fe2+氧化为Fe3+,该步骤温度不能太高的原因是
(5)“调pH”时,pH的控制范围为
(6)用可溶性碳酸盐,可以浸取CaSO4固体,在溶液浸取过程发生反应:CaSO4(s)
 (ag)
(ag) CaCO3(s)
CaCO3(s) (aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
(aq)。已知:298K时,KspCaCO32.8010-9,KspCaSO44.9010-5,则此温度下该反应的平衡常数K为
您最近半年使用:0次
4 . 已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(Ag2CrO4)=2.0×10-12.某溶液中含有Cl-、Br-和 的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
 的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
的浓度均为0.010mol•L-1,向该溶液中逐滴加入0.010mol•L-1AgNO3溶液时,三种阴离子产生沉淀的先后顺序为A.Br-、Cl-、 | B. 、Br-、Cl- 、Br-、Cl- | C.Cl-、Br-、 | D.Br-、 、Cl- 、Cl- |
您最近半年使用:0次
5 . 盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :_______ 。
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为______
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c( ) 由大到小的顺是
) 由大到小的顺是 _______ ( 用序号表示)。
(4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成_______ ( 填化学式)沉淀 ; 当体系中两种沉淀共存时,  =
= _______ 。
(1)用离子方程式表示 FeCl3 可作净水剂的原因 :
(2)常温下,在 pH=3 的硫酸与 pH =11 的 Na 2 S 溶液中,水电离出来的 c(OH- ) 之比为
(3)物质的量浓度相等的下列溶液溶液 ①NH4Cl、②NH4HSO4、③(NH4)2SO4、④CH3COONH4 ⑤NH3·H2O ,溶液中c(
 ) 由大到小的顺是
) 由大到小的顺是 (4)已知 25 ℃ 时 Ksp[Mg(OH) 2 ]=1.8×10 -11 , Ksp[Cu(OH) 2 ] =2.2 ×10 -20 。25 ℃ 时,向浓度均为 0.1 mol/L 的 MgCl 2 和 CuCl 2 混合溶液中逐滴加入氨水,先生成
 =
=
您最近半年使用:0次
6 . 化工生产中常用MnS作为沉淀剂除去工业废水中的Cu2+: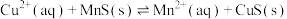 ,下列说法正确的是
,下列说法正确的是
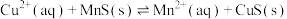 ,下列说法正确的是
,下列说法正确的是A.相同温度时,MnS的 比CuS的 比CuS的 小 小 |
B.该反应达到平衡时 |
C.设该反应的平衡常数为K,则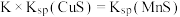 |
D.向平衡体系中加入少量 固体后, 固体后, 减小, 减小, 增大 增大 |
您最近半年使用:0次
7 . 下列实验操作和现象,得出的相应结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用pH计分别测定饱和SO2溶液和饱和CO2溶液的pH | 前者pH较小 | 酸性:H2SO3>H2CO3 |
| B | 向滴有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅并且有白色沉淀生成 | Na2CO3溶液中存在水解平衡 |
| C | 向KCl、KI的混合溶液中滴入AgNO3溶液 | 有黄色沉淀生成 | Ksp(AgI)<Ksp(AgCl) |
| D | 分别测定浓度均为 的CH3COONH4和NaHCO3溶液的pH 的CH3COONH4和NaHCO3溶液的pH | 后者大于前者 | 水解常数:Kh(HCO )>Kh(CH3COO-) )>Kh(CH3COO-) |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
8 . 某温度下,BaSO4的溶解平衡曲线如图,下列说法正确的是
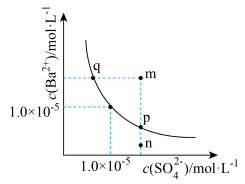
| A.该温度下Ba SO4的溶度积的数量级为10-5 |
| B.m、p点均有BaSO4沉淀析出,而n没有 |
| C.加入BaCl2固体可使p点移动到q点 |
| D.升高温度可使p点移动到q点 |
您最近半年使用:0次
解题方法
9 . 某废水中主要含有Mn2+、Fe3+、Fe2+、Co2+、Ni2+以及 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
②Ksp[Fe(OH)3]=4.0×10-38,Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21。
回答下列问题:
(1)常温下,该废水的pH_____ (填“>”“=”或“<”)7。
(2)“氧化”时反应的离子方程式为_____ ,若用H2O2代替MnO2,则参加反应的n(H2O2)∶n(Fe2+)=_____ 。
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是_____ 。
(4)“除钴镍”时,发生的反应为 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是_____ 。
(5)“电解”时,阳极电极反应式为_____ ;电解液可以返回“_____ ”(填工序名称)循环应用。
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=_____ mol·L-1。
 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 7.5 | 3.7 | 8.4 | 8.2 | 9.8 |
回答下列问题:
(1)常温下,该废水的pH
(2)“氧化”时反应的离子方程式为
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是
(4)“除钴镍”时,发生的反应为
 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是(5)“电解”时,阳极电极反应式为
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=
您最近半年使用:0次
10 . SO2、H2S、Na2S等均是重要的含硫化合物。回答下列问题:
(1)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡_____ (填“正向”或“逆向”)移动;若要使H2S溶液中c(HS-)增大且使其电离平衡逆向移动,可以加入_____ (填化学式)固体。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“正向”“逆向”或“不”)移动。试计算溶液中c( )∶c(
)∶c( )=
)=_____ (常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)将Na2S加入CuCl悬浊液中,发生的反应为2CuCl(s)+S2-(aq) Cu2S(s)+2Cl-(aq),该反应的平衡常数K=
Cu2S(s)+2Cl-(aq),该反应的平衡常数K=_____ [已知Ksp(CuCl)=1.2×10-6,Ksp(Cu2S)=2.5×10-43]。
(4)我国规定生活用水中镉排放的最大允许浓度为0.005mg·L-1.向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为_____ mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时是否符合生活饮用水卫生标准?_____ (填“是”或“否”)。
(5)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:_____ 。
②相同条件下,放电过程中消耗的SO2和O2的体积之比为_____ 。
(1)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
 )∶c(
)∶c( )=
)=(3)将Na2S加入CuCl悬浊液中,发生的反应为2CuCl(s)+S2-(aq)
 Cu2S(s)+2Cl-(aq),该反应的平衡常数K=
Cu2S(s)+2Cl-(aq),该反应的平衡常数K=(4)我国规定生活用水中镉排放的最大允许浓度为0.005mg·L-1.向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为
(5)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:

②相同条件下,放电过程中消耗的SO2和O2的体积之比为
您最近半年使用:0次



