1 . 氯化银(AgCl,白色)、铬酸银( ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或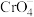 )。下列叙述正确的是
)。下列叙述正确的是
 ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或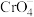 )。下列叙述正确的是
)。下列叙述正确的是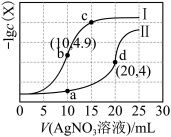
A.T℃下,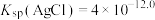 |
B.曲线Ⅱ表示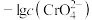 与V( 与V( 溶液)的变化关系 溶液)的变化关系 |
| C.向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 |
D.浓度均为 的 的 和 和 ,可通过分步沉淀进行分离 ,可通过分步沉淀进行分离 |
您最近半年使用:0次
2 . SO2、H2S、Na2S等均是重要的含硫化合物。回答下列问题:
(1)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡_____ (填“正向”或“逆向”)移动;若要使H2S溶液中c(HS-)增大且使其电离平衡逆向移动,可以加入_____ (填化学式)固体。
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_____ (填“正向”“逆向”或“不”)移动。试计算溶液中c( )∶c(
)∶c( )=
)=_____ (常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(3)将Na2S加入CuCl悬浊液中,发生的反应为2CuCl(s)+S2-(aq) Cu2S(s)+2Cl-(aq),该反应的平衡常数K=
Cu2S(s)+2Cl-(aq),该反应的平衡常数K=_____ [已知Ksp(CuCl)=1.2×10-6,Ksp(Cu2S)=2.5×10-43]。
(4)我国规定生活用水中镉排放的最大允许浓度为0.005mg·L-1.向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为_____ mol·L-1[已知:Ksp(CdS)=7.9×10-27],此时是否符合生活饮用水卫生标准?_____ (填“是”或“否”)。
(5)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:_____ 。
②相同条件下,放电过程中消耗的SO2和O2的体积之比为_____ 。
(1)向H2S溶液中加入NaOH固体时,不考虑温度变化,H2S的电离平衡
(2)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡
 )∶c(
)∶c( )=
)=(3)将Na2S加入CuCl悬浊液中,发生的反应为2CuCl(s)+S2-(aq)
 Cu2S(s)+2Cl-(aq),该反应的平衡常数K=
Cu2S(s)+2Cl-(aq),该反应的平衡常数K=(4)我国规定生活用水中镉排放的最大允许浓度为0.005mg·L-1.向某含镉废水中加入Na2S,当S2-浓度达到7.9×10-8mol·L-1时,废水中Cd2+的浓度为
(5)一种新型燃料电池以SO2和空气为原料,工作原理如图所示:

②相同条件下,放电过程中消耗的SO2和O2的体积之比为
您最近半年使用:0次
解题方法
3 . 广安代市镇火力发电厂需要燃烧大量的煤,产生大量CO2和SO2等,并留下大量煤渣,对环境有较大影响。其中一种不能继续燃烧的煤渣成分俗名叫“铁甲石”,主要成分为:Al2O3(15%~24%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)、FeO(0.9%~2.0%)、CuO(8.5%~11.0%)以及其他不溶性杂质,铁甲石中的氧化铝难溶于酸,可以通过煅烧改变铁甲石结构,使其溶于酸。铁甲石经过下列化工工艺,可以制取无水CuCl2。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
(1)第一次过滤的滤渣为___________ 。
(2)加H2O2后发生反应的离子方程式为___________ 。
(3)调节溶液pH需要控制的范围是___________ ,“调节溶液pH”的过程中除添加试剂,还需借助于___________ 测定溶液pH值。
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
(5)从滤液2中得到无水CuCl2的操作为___________ 。

已知Cu2+、Fe2+、Fe3+、Al3+生成沉淀pH范围如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 5.8 | 5.8 | 2.0 | 4.0 |
| 沉淀完成pH | 7.5 | 8.3 | 3.1 | 5.4 |
(1)第一次过滤的滤渣为
(2)加H2O2后发生反应的离子方程式为
(3)调节溶液pH需要控制的范围是
(4)调节pH值用到的试剂或物质是___________(填下列字母)。
| A.氢氧化钠 | B.氨水 | C.CuO | D.AlCl3 |
(5)从滤液2中得到无水CuCl2的操作为
您最近半年使用:0次
4 .  成本低、储氢量高,具有很好的发展前景。
成本低、储氢量高,具有很好的发展前景。 、
、 、
、 等盐溶液能提升
等盐溶液能提升 的水解制氢性能。
的水解制氢性能。 在
在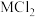 (
( 代表
代表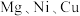 )溶液中水解的示意图如下:
)溶液中水解的示意图如下:
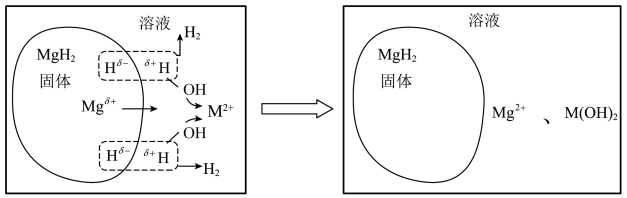
已知: 、
、 、
、 的
的 分别为
分别为 、
、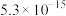 、
、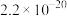 。下列说法正确的是
。下列说法正确的是
 成本低、储氢量高,具有很好的发展前景。
成本低、储氢量高,具有很好的发展前景。 、
、 、
、 等盐溶液能提升
等盐溶液能提升 的水解制氢性能。
的水解制氢性能。 在
在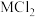 (
( 代表
代表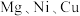 )溶液中水解的示意图如下:
)溶液中水解的示意图如下:
已知:
 、
、 、
、 的
的 分别为
分别为 、
、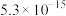 、
、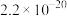 。下列说法正确的是
。下列说法正确的是A. 的水解反应属于复分解反应 的水解反应属于复分解反应 |
B.使用 溶液制备 溶液制备 比 比 溶液、 溶液、 溶液更易进行 溶液更易进行 |
C.溶液中 若更换为 若更换为 ,则生成 ,则生成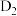 |
D.盐溶液换成硫酸溶液也能提高 的制氢性能 的制氢性能 |
您最近半年使用:0次
解题方法
5 . 轻质氧化镁可用于制备先进功能材料氧化镁单晶。硼泥(主要成分是MgO,杂质为 、CaO、MnO、
、CaO、MnO、 、
、 、FeO、
、FeO、 等)制备轻质氧化镁的工艺流程如图所示。
等)制备轻质氧化镁的工艺流程如图所示。
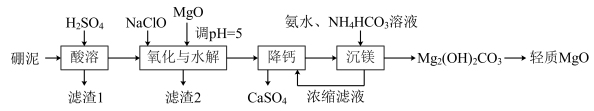
(1)“酸溶”所得“滤渣1”的主要成分是 、
、 、
、_______________ (填化学式)。已知 的解离反应:
的解离反应: ,
, 。“酸溶”后所得滤液中含硼的分子数是含硼的离子数的
。“酸溶”后所得滤液中含硼的分子数是含硼的离子数的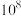 倍,则溶液的pH为
倍,则溶液的pH为_______________ 。
(2)“滤渣2”中含有 、
、 、
、 ,写出“氧化与水解”过程中除锰和除铝反应的离子方程式
,写出“氧化与水解”过程中除锰和除铝反应的离子方程式_______________ 、_______________ 。
(3)“降钙”能实现的原因是_______________ 。
(4)“沉镁”中,发生反应的离子方程式为_______________ 。
(5)即使 洗涤干净并分解完全,该工艺制得的轻质氧化镁仍可能含有
洗涤干净并分解完全,该工艺制得的轻质氧化镁仍可能含有_____________ 杂质。
(6)该工艺中没有涉及的操作是 。
 、CaO、MnO、
、CaO、MnO、 、
、 、FeO、
、FeO、 等)制备轻质氧化镁的工艺流程如图所示。
等)制备轻质氧化镁的工艺流程如图所示。
(1)“酸溶”所得“滤渣1”的主要成分是
 、
、 、
、 的解离反应:
的解离反应: ,
, 。“酸溶”后所得滤液中含硼的分子数是含硼的离子数的
。“酸溶”后所得滤液中含硼的分子数是含硼的离子数的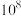 倍,则溶液的pH为
倍,则溶液的pH为(2)“滤渣2”中含有
 、
、 、
、 ,写出“氧化与水解”过程中除锰和除铝反应的离子方程式
,写出“氧化与水解”过程中除锰和除铝反应的离子方程式(3)“降钙”能实现的原因是
(4)“沉镁”中,发生反应的离子方程式为
(5)即使
 洗涤干净并分解完全,该工艺制得的轻质氧化镁仍可能含有
洗涤干净并分解完全,该工艺制得的轻质氧化镁仍可能含有(6)该工艺中没有涉及的操作是 。
| A.过滤 | B.蒸发 | C.蒸馏 | D.灼烧 |
您最近半年使用:0次
解题方法
6 . 镓锗是重要的战略金属资源丹霞冶炼厂以锌精矿(主要成分为ZnS,还含有铁、铜、和锗等金属硫化物)为原料制备Zn、Ga、Ge的工艺流程如图所示:
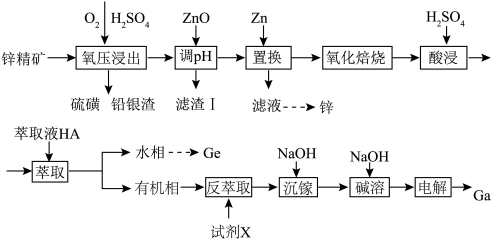
已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Fe3+ | Ga3+ | Cu2+ |
开始沉淀时的pH | 2.5 | 3.5 | 5.3 |
沉淀完全时的pH | 3.3 | 4.6 | 6.4 |
②镓与铝同主族,化学性质相似。
(1)基态镓原子的核外电子排布式为
(2)“氧压浸出”时,ZnS发生反应的化学方程式是
(3)“滤渣I”的主要成分为
(4)“萃取”的原理为Mn+(水相)+nHA(有机相)
 MAn(有机相)+nH+(水相)(M为Cu或Ga),则“反萃取”工序中的试剂X宜选用
MAn(有机相)+nH+(水相)(M为Cu或Ga),则“反萃取”工序中的试剂X宜选用(5)反萃取后的水溶液中含有Ga3+、Cu2+,“沉镓”时应控制溶液的pH范围为
(6)写出“碱溶”过程中发生反应的离子方程式
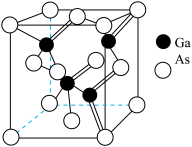
(7)砷化镓GaAs是一种重要的半导体材料,其晶体的立方体晶胞如图所示,设晶胞边长为apm,阿伏加德罗常数为NA,则晶胞的密度为
您最近半年使用:0次
7 . 已知某温度下,Mg(OH)2在水中的溶解度为5.8×10-3g/L。
(1)该温度下Mg(OH)2饱和溶液中的溶度积Ksp为_______ ;
(2)Mg(OH)2在0.001mol/L的NaOH溶液中的溶解度为_______ mol/L
(3)若要使Mg(OH)2饱和溶液中沉淀转化为MgCO3沉淀,加入碳酸钠固体使碳酸根离子浓度至少为_______ mol/L(说明:已知Ksp(MgCO3)=6.6×10-5)。
(4)向物质的量浓度均为0.1mol/l的MgCl2和MnCl2溶液中逐滴加入NaOH溶液,最先析出沉淀是_______ ,可否用控制pH值的方法分离上述溶液中的Mg2+和Mn2+ _______ 。(已知KspMn(OH)2=5×10-14,离子浓度降低到1×10-5mol/L时可认为沉淀完全)
(1)该温度下Mg(OH)2饱和溶液中的溶度积Ksp为
(2)Mg(OH)2在0.001mol/L的NaOH溶液中的溶解度为
(3)若要使Mg(OH)2饱和溶液中沉淀转化为MgCO3沉淀,加入碳酸钠固体使碳酸根离子浓度至少为
(4)向物质的量浓度均为0.1mol/l的MgCl2和MnCl2溶液中逐滴加入NaOH溶液,最先析出沉淀是
您最近半年使用:0次
解题方法
8 . 某小组模拟成垢—除垢过程,实验过程如下图所示。已知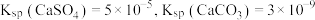 。下列说法正确的是
。下列说法正确的是
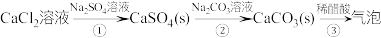
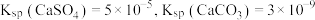 。下列说法正确的是
。下列说法正确的是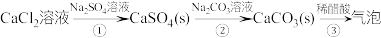
A.步骤①中将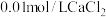 溶液和 溶液和 溶液等体积混合(忽略体积变化),可以形成沉淀 溶液等体积混合(忽略体积变化),可以形成沉淀 |
B.饱和 溶液中存在: 溶液中存在: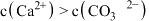 |
C. 溶液中存在: 溶液中存在: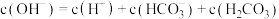 |
D.用饱和 溶液浸泡 溶液浸泡 固体,生成 固体,生成 的反应趋势较大 的反应趋势较大 |
您最近半年使用:0次
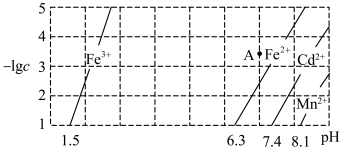
9 . 某工业废水中含有 等离子,现要用沉淀法除去
等离子,现要用沉淀法除去 ,并回收
,并回收 元素,上述金属阳离子在水中达到沉淀溶解平衡时的
元素,上述金属阳离子在水中达到沉淀溶解平衡时的 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是
 等离子,现要用沉淀法除去
等离子,现要用沉淀法除去 ,并回收
,并回收 元素,上述金属阳离子在水中达到沉淀溶解平衡时的
元素,上述金属阳离子在水中达到沉淀溶解平衡时的 关系如图所示。下列说法不正确的是
关系如图所示。下列说法不正确的是
A.A点时 未沉淀 未沉淀 | B.分离 元素前需要加入氧化剂 元素前需要加入氧化剂 |
C.当 时, 时, | D. 沉淀完全时 沉淀完全时 也沉淀完全 也沉淀完全 |
您最近半年使用:0次
10 . 室温下,两种难溶盐 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
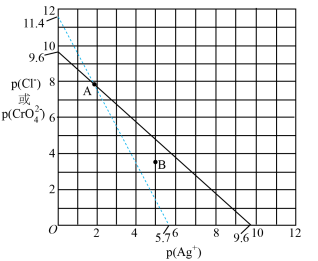
下列说法错误的是
 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
下列说法错误的是
A. |
B.向 点的混合溶液中,加入硝酸银固体, 点的混合溶液中,加入硝酸银固体, 变小 变小 |
| C.B点条件下能生成白色沉淀,不能生成砖红色沉淀 |
D.向等浓度的 和 和 混合溶液中滴加 混合溶液中滴加 溶液,先产生白色沉淀 溶液,先产生白色沉淀 |
您最近半年使用:0次
2024-03-02更新
|
270次组卷
|
2卷引用:河北省唐山市2023-2024学年高三上学期期末考试化学试题



