1 . 氯化银(AgCl,白色)、铬酸银( ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或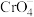 )。下列叙述正确的是
)。下列叙述正确的是
 ,砖红色)都是难溶电解质。T℃下,将
,砖红色)都是难溶电解质。T℃下,将 溶液分别逐滴滴入体积均为10mL、浓度均为
溶液分别逐滴滴入体积均为10mL、浓度均为 的NaCl溶液和
的NaCl溶液和 溶液中,所得的沉淀溶解平衡图像如图所示(X为
溶液中,所得的沉淀溶解平衡图像如图所示(X为 或
或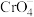 )。下列叙述正确的是
)。下列叙述正确的是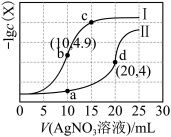
A.T℃下,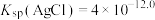 |
B.曲线Ⅱ表示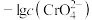 与V( 与V( 溶液)的变化关系 溶液)的变化关系 |
| C.向a点对应的体系中加入少量NaCl固体,白色固体逐渐变为砖红色 |
D.浓度均为 的 的 和 和 ,可通过分步沉淀进行分离 ,可通过分步沉淀进行分离 |
您最近一年使用:0次
2 .  成本低、储氢量高,具有很好的发展前景。
成本低、储氢量高,具有很好的发展前景。 、
、 、
、 等盐溶液能提升
等盐溶液能提升 的水解制氢性能。
的水解制氢性能。 在
在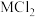 (
( 代表
代表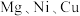 )溶液中水解的示意图如下:
)溶液中水解的示意图如下:
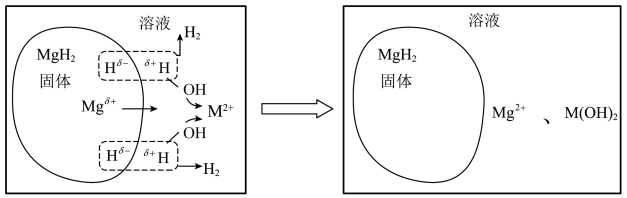
已知: 、
、 、
、 的
的 分别为
分别为 、
、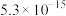 、
、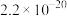 。下列说法正确的是
。下列说法正确的是
 成本低、储氢量高,具有很好的发展前景。
成本低、储氢量高,具有很好的发展前景。 、
、 、
、 等盐溶液能提升
等盐溶液能提升 的水解制氢性能。
的水解制氢性能。 在
在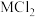 (
( 代表
代表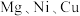 )溶液中水解的示意图如下:
)溶液中水解的示意图如下:
已知:
 、
、 、
、 的
的 分别为
分别为 、
、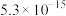 、
、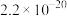 。下列说法正确的是
。下列说法正确的是A. 的水解反应属于复分解反应 的水解反应属于复分解反应 |
B.使用 溶液制备 溶液制备 比 比 溶液、 溶液、 溶液更易进行 溶液更易进行 |
C.溶液中 若更换为 若更换为 ,则生成 ,则生成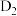 |
D.盐溶液换成硫酸溶液也能提高 的制氢性能 的制氢性能 |
您最近一年使用:0次
解题方法
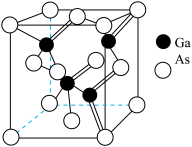
3 . 镓锗是重要的战略金属资源丹霞冶炼厂以锌精矿(主要成分为ZnS,还含有铁、铜、和锗等金属硫化物)为原料制备Zn、Ga、Ge的工艺流程如图所示:
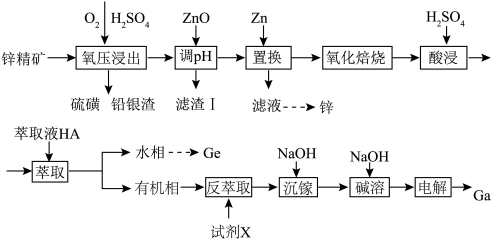
已知:①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Fe3+ | Ga3+ | Cu2+ |
开始沉淀时的pH | 2.5 | 3.5 | 5.3 |
沉淀完全时的pH | 3.3 | 4.6 | 6.4 |
②镓与铝同主族,化学性质相似。
(1)基态镓原子的核外电子排布式为
(2)“氧压浸出”时,ZnS发生反应的化学方程式是
(3)“滤渣I”的主要成分为
(4)“萃取”的原理为Mn+(水相)+nHA(有机相)
 MAn(有机相)+nH+(水相)(M为Cu或Ga),则“反萃取”工序中的试剂X宜选用
MAn(有机相)+nH+(水相)(M为Cu或Ga),则“反萃取”工序中的试剂X宜选用(5)反萃取后的水溶液中含有Ga3+、Cu2+,“沉镓”时应控制溶液的pH范围为
(6)写出“碱溶”过程中发生反应的离子方程式
(7)砷化镓GaAs是一种重要的半导体材料,其晶体的立方体晶胞如图所示,设晶胞边长为apm,阿伏加德罗常数为NA,则晶胞的密度为
您最近一年使用:0次
4 . 室温下,两种难溶盐 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
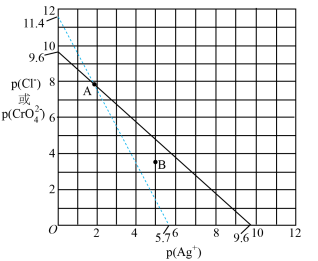
下列说法错误的是
 (白色)、
(白色)、 (砖红色)的离子浓度关系曲线如图所示,其中
(砖红色)的离子浓度关系曲线如图所示,其中 。
。
下列说法错误的是
A. |
B.向 点的混合溶液中,加入硝酸银固体, 点的混合溶液中,加入硝酸银固体, 变小 变小 |
| C.B点条件下能生成白色沉淀,不能生成砖红色沉淀 |
D.向等浓度的 和 和 混合溶液中滴加 混合溶液中滴加 溶液,先产生白色沉淀 溶液,先产生白色沉淀 |
您最近一年使用:0次
2024-03-02更新
|
276次组卷
|
2卷引用:河北省唐山市2023-2024学年高三上学期期末考试化学试题
名校
5 . 钼酸铵是豆科植物的生命素。工业上欲利用废钼催化剂(主要成分为 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
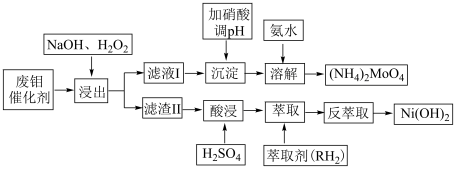
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、___________ (写出2条)。
(2)写出浸出过程中主要反应的离子方程式___________ 。
(3)钼酸铵溶液经___________ 、过滤、洗涤、干燥可得到钼酸铵晶体,为减小产品损失,应选择下列___________ 试剂洗涤晶体。
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式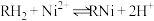 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入___________ (酸性、碱性、中性)溶液。
(5)室温下,为保证反萃取后的溶液中 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围___________ (已知:离子浓度小于 时可认为完全沉淀;
时可认为完全沉淀; )。
)。
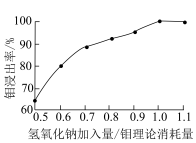
(6) 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为___________ 。
 ,还含少量的
,还含少量的 、CoS、NiO)制备钼酸铵,其具体流程为下:
、CoS、NiO)制备钼酸铵,其具体流程为下:
回答下列问题:
(1)为了提高浸出效率,可采取的措施为粉碎、
(2)写出浸出过程中主要反应的离子方程式
(3)钼酸铵溶液经
A.蒸馏水 B.钼酸铵饱和溶液 C.乙醇水溶液
(4)由萃取过程的方程式
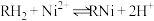 可知反萃取时应向体系中加入
可知反萃取时应向体系中加入(5)室温下,为保证反萃取后的溶液中
 沉淀完全,应控制
沉淀完全,应控制 在什么范围
在什么范围 时可认为完全沉淀;
时可认为完全沉淀; )。
)。(6)
 用量对钼的浸出率的影响如图所示,则浸出时最佳的
用量对钼的浸出率的影响如图所示,则浸出时最佳的 加入量与钼理论消耗量之比为
加入量与钼理论消耗量之比为
您最近一年使用:0次
名校
解题方法
6 . 产自我国昆仑-西秦岭成矿带钴精矿主要化学成分为CoS、FeS、 等,可以通过以下流程生产企业级的
等,可以通过以下流程生产企业级的 晶体。
晶体。

已知:① (黄钠铁钒)是一种难溶于水的黄色晶体
(黄钠铁钒)是一种难溶于水的黄色晶体
②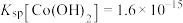 ,
,
(1)为提高酸浸速率可采取的措施有________ 。
(2)残渣中没有S单质,写出酸浸过程中CoS反应的离子方程式________ 。
(3)除铁过程中溶液的pH不宜过小,原因是________ 。
(4)当 完全沉淀时,滤液1的pH=
完全沉淀时,滤液1的pH=________ 。
(5)操作1的步骤是________ ,________ ,过滤。
(6) 晶体热重曲线(样品质量随温度变化的曲线)如图所示,已知由A→B时生成了一种固体和两种气体(均为化合物),则该反应的化学方程式为
晶体热重曲线(样品质量随温度变化的曲线)如图所示,已知由A→B时生成了一种固体和两种气体(均为化合物),则该反应的化学方程式为________ 。

 等,可以通过以下流程生产企业级的
等,可以通过以下流程生产企业级的 晶体。
晶体。
已知:①
 (黄钠铁钒)是一种难溶于水的黄色晶体
(黄钠铁钒)是一种难溶于水的黄色晶体②
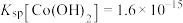 ,
,
(1)为提高酸浸速率可采取的措施有
(2)残渣中没有S单质,写出酸浸过程中CoS反应的离子方程式
(3)除铁过程中溶液的pH不宜过小,原因是
(4)当
 完全沉淀时,滤液1的pH=
完全沉淀时,滤液1的pH=(5)操作1的步骤是
(6)
 晶体热重曲线(样品质量随温度变化的曲线)如图所示,已知由A→B时生成了一种固体和两种气体(均为化合物),则该反应的化学方程式为
晶体热重曲线(样品质量随温度变化的曲线)如图所示,已知由A→B时生成了一种固体和两种气体(均为化合物),则该反应的化学方程式为
您最近一年使用:0次
7 . I.某浓度碳酸钠溶液的pH随温度变化的关系如下图所示:
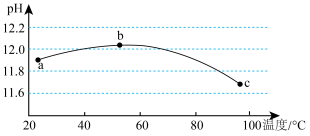
(1)Na2CO3溶液呈碱性的原因是___________ 。(用离子方程式表示)
(2)根据上图信息判断,下列说法中正确的是___________。
II.根据下列数据回答以下问题:
(3)向0.6mol∙L−1Na2CO3溶液通入HCl(g)至溶液中c( )=0.5mol∙L−1,忽略体积变化,此时溶液的pH=
)=0.5mol∙L−1,忽略体积变化,此时溶液的pH=___________ 。(保留2位小数)
(4)25℃时,某Na2SO3和NaHSO3的混合溶液恰好呈中性,则混合溶液中各离子浓度由大到小的顺序是___________ 。
(5)下列反应中可以发生的是___________。
(6)碳酸钙的溶度积常数:Ksp(CaCO3)=2.8×10−9,通过计算说明,向Ca(ClO)2溶液中通入少量CO2是得到Ca(HCO3)2溶液还是CaCO3沉淀___________ (CO2的水溶液可视为H2CO3溶液)。

(1)Na2CO3溶液呈碱性的原因是
(2)根据上图信息判断,下列说法中正确的是___________。
A.a点溶液中c( )最大 )最大 |
| B.b点水的电离程度最大 |
| C.c点溶液中c(OH—)约为10−2.3mol∙L−1 |
| D.b→c段pH降低的主要原因是温度升高,水的电离平衡正向移动 |
II.根据下列数据回答以下问题:
| 电解质 | H2CO3 | H2SO3 | ||
| 酸式电离常数 | Ka1=4.2×10−7 | Ka2=4.8×10−11 | Ka1=1.39×10−2 | Ka2=6.73×10−8 |
| 电解质 | HClO | CH3COOH | ||
| 酸式电离常数 | Ka=3.0×10−8 | Ka=1.75×10−5 | ||
(3)向0.6mol∙L−1Na2CO3溶液通入HCl(g)至溶液中c(
 )=0.5mol∙L−1,忽略体积变化,此时溶液的pH=
)=0.5mol∙L−1,忽略体积变化,此时溶液的pH=(4)25℃时,某Na2SO3和NaHSO3的混合溶液恰好呈中性,则混合溶液中各离子浓度由大到小的顺序是
(5)下列反应中可以发生的是___________。
A. +2CH3COOH=2CH3COO—+CO2↑+H2O +2CH3COOH=2CH3COO—+CO2↑+H2O |
B.2ClO—+CO2+H2O=2HClO+ |
C.2ClO—+SO2+H2O=2HClO+ |
D.HClO+ =ClO—+ =ClO—+ |
(6)碳酸钙的溶度积常数:Ksp(CaCO3)=2.8×10−9,通过计算说明,向Ca(ClO)2溶液中通入少量CO2是得到Ca(HCO3)2溶液还是CaCO3沉淀
您最近一年使用:0次
2023-12-23更新
|
176次组卷
|
2卷引用:上海民办南模中学2023-2024学年高三上学期阶段考试化学(等级考)试题
名校
8 . 已知: ,
, ,CuR难溶于水。常温下,Ka1(
,CuR难溶于水。常温下,Ka1( )=1×10-9,Ka2(
)=1×10-9,Ka2( )=2×10-13,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中c(H+)与(Cu2+)的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
)=2×10-13,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中c(H+)与(Cu2+)的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
 ,
, ,CuR难溶于水。常温下,Ka1(
,CuR难溶于水。常温下,Ka1( )=1×10-9,Ka2(
)=1×10-9,Ka2( )=2×10-13,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中c(H+)与(Cu2+)的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
)=2×10-13,当10mL0.1mol/LH2R溶液中缓慢加入少量CuSO4粉末,溶液中c(H+)与(Cu2+)的变化如图所示(忽略溶液的体积变化)。下列有关说法不正确的是
| A.X点溶液的pH≈5 |
| B.根据Y点数据可求得Ksp(CuR)=1×10-24 |
| C.Z点溶液中含R微粒的主要存在形式为H2R |
D.Y点对应的溶液中:c(H+)+2c(Cu2+)=2c(R2-)+c(HR-)+2c( )+c(OH-) )+c(OH-) |
您最近一年使用:0次
2023-12-15更新
|
371次组卷
|
4卷引用:浙江省浙江省舟山中学2023-2024学年高三上学期12月月考化学试题
浙江省浙江省舟山中学2023-2024学年高三上学期12月月考化学试题江西省上饶市广丰一中2023-2024学年高三上学期12月考试化学试卷(已下线)专题07 水溶液中的离子反应与平衡(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题07 水溶液中微粒变化图像题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
9 . 已知常温下, 电离常数:
电离常数: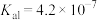 ;
; ;
; ;
; ;
;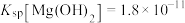 ;
; 。某实验小组进行以下实验(溶液混合后体积变化忽略不计,常温下
。某实验小组进行以下实验(溶液混合后体积变化忽略不计,常温下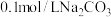 溶液pH为11.65):
溶液pH为11.65):
实验①: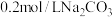 溶液中,小心滴加等体积0.1mol/L盐酸,无气泡产生;
溶液中,小心滴加等体积0.1mol/L盐酸,无气泡产生;
实验②: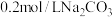 溶液与等体积
溶液与等体积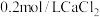 溶液混合,产生白色沉淀;
溶液混合,产生白色沉淀;
实验③: 溶液与等体积
溶液与等体积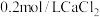 溶液混合,产生白色沉淀和气泡;
溶液混合,产生白色沉淀和气泡;
实验④: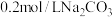 溶液与等体积
溶液与等体积 溶液混合,产生白色沉淀;
溶液混合,产生白色沉淀;
下列说法不正确的是
 电离常数:
电离常数: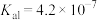 ;
; ;
; ;
; ;
;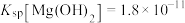 ;
; 。某实验小组进行以下实验(溶液混合后体积变化忽略不计,常温下
。某实验小组进行以下实验(溶液混合后体积变化忽略不计,常温下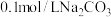 溶液pH为11.65):
溶液pH为11.65):实验①:
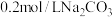 溶液中,小心滴加等体积0.1mol/L盐酸,无气泡产生;
溶液中,小心滴加等体积0.1mol/L盐酸,无气泡产生;实验②:
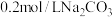 溶液与等体积
溶液与等体积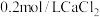 溶液混合,产生白色沉淀;
溶液混合,产生白色沉淀;实验③:
 溶液与等体积
溶液与等体积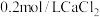 溶液混合,产生白色沉淀和气泡;
溶液混合,产生白色沉淀和气泡;实验④:
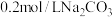 溶液与等体积
溶液与等体积 溶液混合,产生白色沉淀;
溶液混合,产生白色沉淀;下列说法不正确的是
A.实验①反应后的溶液中: |
B.实验②反应后的溶液中, |
C.实验③总反应 ,平衡常数 ,平衡常数 |
| D.实验②中沉淀为正盐,实验④中生成的沉淀可能含有碱式盐 |
您最近一年使用:0次
10 . 室温下用 溶液吸收
溶液吸收 的一种脱硫工艺流程如下图所示。
的一种脱硫工艺流程如下图所示。

(1)流程中各种离子相关的大小或数学关系如下,回答下列问题:
a. 溶液中,c(OH—)
溶液中,c(OH—)___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
b.当“①吸收”后的吸收液中 时,pH=
时,pH=___________ (填整数)。(已知:
 ,
, )
)
c.“②沉淀”分离后的滤液中,
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(2)写出“②沉淀”发生主要反应的离子方程式___________ 。(已知:

 、
、
 )
)
(3)写出“③氧化”中生成石膏(
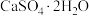 )的化学方程式
)的化学方程式___________ 。
(4)“①吸收”后的溶液为
 和
和
 混合物,可以用下图所示的电解法进行再生,获得较纯净的
混合物,可以用下图所示的电解法进行再生,获得较纯净的
 ,从而循环利用。
,从而循环利用。

在阴极室,再生过程分为两步,分别写出离子方程式:
电极反应:___________ 。
后续反应:___________ 。
(5)焦亚硫酸钠(
 ),其在医药、橡胶、印染、食品等方面应用广泛,可通过
),其在医药、橡胶、印染、食品等方面应用广泛,可通过
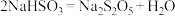 原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
 和
和
 混合物分离。
混合物分离。

电解后,___________ 室(填“a或b”)的 浓度增加,从而循环利用,另一个室的
浓度增加,从而循环利用,另一个室的 浓度增加,将该室溶液进行脱水可得到
浓度增加,将该室溶液进行脱水可得到 。
。
 溶液吸收
溶液吸收 的一种脱硫工艺流程如下图所示。
的一种脱硫工艺流程如下图所示。
(1)流程中各种离子相关的大小或数学关系如下,回答下列问题:
a.
 溶液中,c(OH—)
溶液中,c(OH—) (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。b.当“①吸收”后的吸收液中
 时,pH=
时,pH=
 ,
, )
)c.“②沉淀”分离后的滤液中,

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(2)写出“②沉淀”发生主要反应的离子方程式

 、
、 )
)(3)写出“③氧化”中生成石膏(
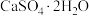 )的化学方程式
)的化学方程式(4)“①吸收”后的溶液为
 和
和 混合物,可以用下图所示的电解法进行再生,获得较纯净的
混合物,可以用下图所示的电解法进行再生,获得较纯净的 ,从而循环利用。
,从而循环利用。
在阴极室,再生过程分为两步,分别写出离子方程式:
电极反应:
后续反应:
(5)焦亚硫酸钠(
 ),其在医药、橡胶、印染、食品等方面应用广泛,可通过
),其在医药、橡胶、印染、食品等方面应用广泛,可通过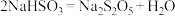 原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的
原理脱水制备。某小组同学为了进一步提高再生过程的效率,设计了如下图所示双膜电解槽,将吸收液中的 和
和 混合物分离。
混合物分离。
电解后,
 浓度增加,从而循环利用,另一个室的
浓度增加,从而循环利用,另一个室的 浓度增加,将该室溶液进行脱水可得到
浓度增加,将该室溶液进行脱水可得到 。
。
您最近一年使用:0次



