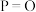名校
1 . 回答下列问题
(1)基态Cu的价电子排布式为______ 。 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为______ ,配体为______ ,配位体所含元素中,电负性最大的是______ ,第一电离能最大的元素是______ 。
(2) 中心原子的价层电子对数目为
中心原子的价层电子对数目为______ ;叠氮酸根 的几何构型为
的几何构型为______ 。
(3)对羟基苯甲醛( )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是______ 。
(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):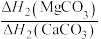
______ 1(选填“>”、“<”或“=”,下同);
②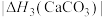
______ 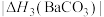 。
。
(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长: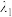
______  (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是______ 。______ 。
②阿伏加德罗常数的值为 ,该晶体的摩尔体积为
,该晶体的摩尔体积为______  (列出计算式)。
(列出计算式)。
(1)基态Cu的价电子排布式为
 是一种配离子,中心离子的配位数为
是一种配离子,中心离子的配位数为(2)
 中心原子的价层电子对数目为
中心原子的价层电子对数目为 的几何构型为
的几何构型为(3)对羟基苯甲醛(
 )的沸点明显高于邻羟基苯甲醛(
)的沸点明显高于邻羟基苯甲醛( )的沸点,主要原因是
)的沸点,主要原因是(4)BaCO3、CaCO3都属于离子晶体,它们的分解反应均属于吸热反应,热分解的能量关系如下(M=Mg或Ca或Ba):

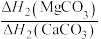
②
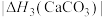
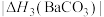 。
。(5)二硒键、二硫键是重要的光响应动态共价键。在光照条件下,含二硒键(-Se-Se-)、二硫键(-S-S-)的化合物可以发生共价交换反应,其光响应原理可用如图表示,则图中实现光响应的最大波长:
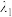
 (选填“>”或“<”或“=”),其原因是
(选填“>”或“<”或“=”),其原因是
②阿伏加德罗常数的值为
 ,该晶体的摩尔体积为
,该晶体的摩尔体积为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
名校
解题方法
2 . 填空题
(1)下表是部分化学键的键能参数:
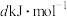 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
________ kJ·mol-1(用含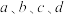 的代数式表示)
的代数式表示)
(2)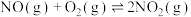 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:
①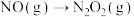
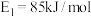
②
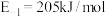
③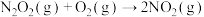
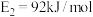
④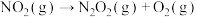
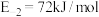
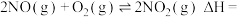
________ 。
(3)已知在 和
和 条件下,有如下反应:①
条件下,有如下反应:①
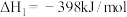
②
 ,若反应
,若反应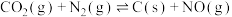 的活化能为
的活化能为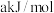 ,则反应
,则反应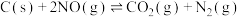 的活化能为
的活化能为________ 。
(4)已知充分燃烧乙炔 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量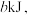 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为____________________ 。
(5)I.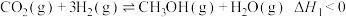
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的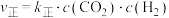 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为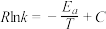 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
________  (用含
(用含 的代数式表示)。
的代数式表示)。
(1)下表是部分化学键的键能参数:
化学键 |
|
|
|
|
键能 |
|
|
|
|
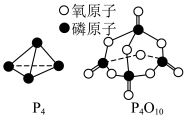
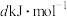 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
 的代数式表示)
的代数式表示)(2)
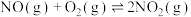 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:①
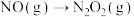
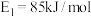
②

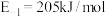
③
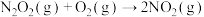
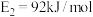
④
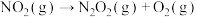
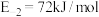
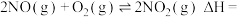
(3)已知在
 和
和 条件下,有如下反应:①
条件下,有如下反应:①
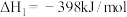
②

 ,若反应
,若反应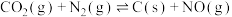 的活化能为
的活化能为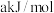 ,则反应
,则反应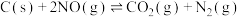 的活化能为
的活化能为(4)已知充分燃烧乙炔
 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量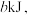 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为(5)I.
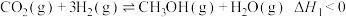
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的
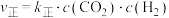 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为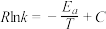 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
3 . 利用CH4与CO2进行催化重整,对温室气体的减排具有重要意义,催化重整时发生的反应: ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
(1)已知: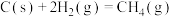
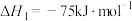

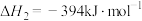
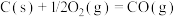
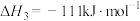
催化重整反应 的
的
______  。
。
(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为______ ;用H2表示的反应速率为______  。
。
(3)已知:常温下CH3COOH的电离常数 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、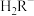 、
、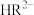 、
、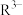 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显______ 性(选填“酸”或“碱”或“中”),常温下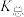 的数量级为
的数量级为______ 。 (
( 、
、 、
、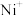 等)与O3反应可得
等)与O3反应可得 。
。 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: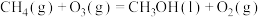 ;
;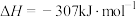 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应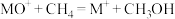 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是______ (填“a”或“b”)。300K、60 s时 的转化率为
的转化率为______ (列出算式)。 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(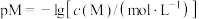 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
______ 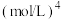 。
。
 ,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:
,得到合成气(CO和H2),为化工生产提供了廉价原料,同时,CH4、CO2的资源化利用也是实现“碳达峰”、“碳中和”的有效措施。请结合题意,回答下列问题:(1)已知:
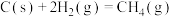
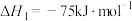

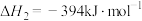
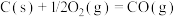
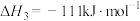
催化重整反应
 的
的
 。
。(2)某温度下,向1 L的密闭容器中充入0.2 mol CH4与0.2 mol CO2,发生
 催化重整反应,
催化重整反应, ;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为
;10 min时达到平衡,测得平衡混合物中CH4(g)的体积分数为12.5%,则CO2的平衡转化率为 。
。(3)已知:常温下CH3COOH的电离常数
 。常温下,在三元弱酸H3R的水溶液中H3R、
。常温下,在三元弱酸H3R的水溶液中H3R、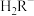 、
、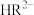 、
、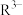 的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为:
的分布分数δ(含R元素微粒占全部含R粒子的物质的量分数)随pH的变化如下图所示,其三级电离常数分别表示为: 、
、 、
、 。则:Na2HR溶液显
。则:Na2HR溶液显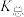 的数量级为
的数量级为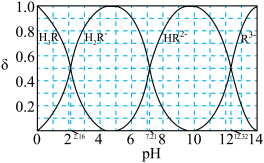
 (
( 、
、 、
、 等)与O3反应可得
等)与O3反应可得 。
。 与CH4反应能高选择性地生成甲醇。总反应为:
与CH4反应能高选择性地生成甲醇。总反应为: ;
; 。分别在300K和310K下(其他反应条件相同)进行反应
。分别在300K和310K下(其他反应条件相同)进行反应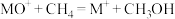 ,结果如下图(见下图1)所示。图中300K的曲线是
,结果如下图(见下图1)所示。图中300K的曲线是 的转化率为
的转化率为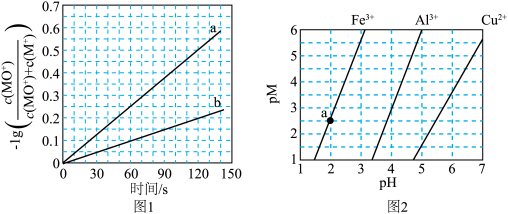
 、
、 和
和 在水中达沉淀溶解平衡时的
在水中达沉淀溶解平衡时的 关系图(见上图2)(
关系图(见上图2)(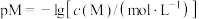 ;
; 可认为
可认为 离子沉淀完全)。则:
离子沉淀完全)。则:
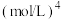 。
。
您最近一年使用:0次
解题方法
4 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和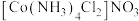 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,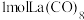 含
含_______  键。
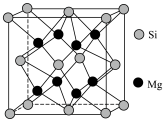
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和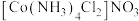 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是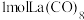 含
含 键。
键。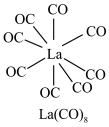
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)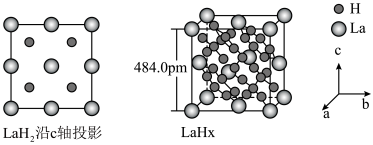
您最近一年使用:0次
解题方法
5 . 现代化学反应中,非常多的反应都需要在分散系中完成,其中因为水的分散能力很强,所以大部分反应需要在水中完成,那么就避免不了需要研究水中的各种平衡以及原理,在水中,我们会有酸碱性,温度,电离与水解,这些都是高中学习探索的重点。可能使用到的数据Ksp(AgCl)=2×10-10,Ksp(AgI)=8.5×10-17,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
(2)大量的碘富集在海藻中,用水浸取后浓缩。浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中 =
=_______ 。
(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=_______ mol/L。在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中 ,则溶液显
,则溶液显_______ 性(填“酸”或“碱”或“中”),计算出此时a的值_______ 。(保留两位有效数字)
(1)下列叙述中,能证明CH3COOH是弱酸的是_______。
| A.醋酸易溶于水 |
| B.醋酸溶液的导电能力比盐酸弱 |
| C.常温下,0.010 mol·L-1的醋酸溶液c(H+)=10-3.38 mol·L-1 |
| D.等体积、等浓度的醋酸溶液与NaOH溶液恰好完全反应 |
 =
=(3)已知25℃,若氨水的浓度为2.0 mol/L,溶液中的c(OH-)=
 ,则溶液显
,则溶液显
您最近一年使用:0次
解题方法
6 . 二氧化碳的捕集和利用是寻找双碳解决之策最重要的部分。
(1)室温下在
 的
的 溶液中通入
溶液中通入 ,溶液中含碳物种的浓度
,溶液中含碳物种的浓度
 (不考虑通入
(不考虑通入 所引起的溶液体积变化和
所引起的溶液体积变化和 的挥发)。已知:
的挥发)。已知: 电离常数分别为
电离常数分别为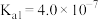 、
、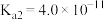 。
。
① 恰好完全转化为
恰好完全转化为 时,溶液中所含离子浓度由小到大的顺序为
时,溶液中所含离子浓度由小到大的顺序为___________ ,
___________ (用含碳微粒和氢离子浓度表示)。
②若吸收
 ,则溶液中
,则溶液中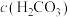
___________  (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是___________ (用必要的计算数据和文字说明)。
③常温下,
 溶液的
溶液的 ,则该溶液中
,则该溶液中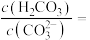
___________ 。
(2) 时,
时, 催化加氢法合成乙烯反应为:
催化加氢法合成乙烯反应为: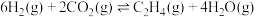
 。向2L的恒容密闭容器中加入
。向2L的恒容密闭容器中加入
 和
和
 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。___________ (填字母)。
② 下,自初始状态达到平衡时,放热为
下,自初始状态达到平衡时,放热为___________ kJ,该反应的化学平衡常数
___________ , 的平衡转化率为
的平衡转化率为___________ %。
(1)室温下在

 的
的 溶液中通入
溶液中通入 ,溶液中含碳物种的浓度
,溶液中含碳物种的浓度
 (不考虑通入
(不考虑通入 所引起的溶液体积变化和
所引起的溶液体积变化和 的挥发)。已知:
的挥发)。已知: 电离常数分别为
电离常数分别为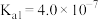 、
、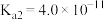 。
。①
 恰好完全转化为
恰好完全转化为 时,溶液中所含离子浓度由小到大的顺序为
时,溶液中所含离子浓度由小到大的顺序为
②若吸收

 ,则溶液中
,则溶液中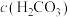
 (填“>”“<”或“=”),原因是
(填“>”“<”或“=”),原因是③常温下,

 溶液的
溶液的 ,则该溶液中
,则该溶液中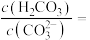
(2)
 时,
时, 催化加氢法合成乙烯反应为:
催化加氢法合成乙烯反应为: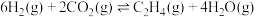
 。向2L的恒容密闭容器中加入
。向2L的恒容密闭容器中加入
 和
和
 ,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。
,在催化剂作用下发生反应,测得平衡时体系中各气体的物质的量随温度的变化关系如图所示。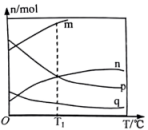
②
 下,自初始状态达到平衡时,放热为
下,自初始状态达到平衡时,放热为
 的平衡转化率为
的平衡转化率为
您最近一年使用:0次
解题方法
7 . 工业废弃物铬钒渣中含有价格相对较高且稀缺的钒(V)、铬(Cr)元素,铬钒渣中铬、钒均以低价含氧酸盐(不溶于水,也不溶于碱性溶液)形式存在,杂质的成分主要为 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: 与
与 固体能发生反应。
固体能发生反应。
②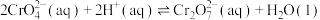 。
。
③25℃时, ,
,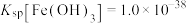 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。
(1)“煅烧”时为加快反应速率,可采取的措施为___________ ;“煅烧”时铬元素被氧化为相应的最高价含氧酸盐,则该最高价含氧酸盐中铬元素的化合价为___________ 价。
(2)写出“煅烧”时 与
与 固体反应的化学方程式:
固体反应的化学方程式:___________ 。
(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:___________ 。
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=___________ 。
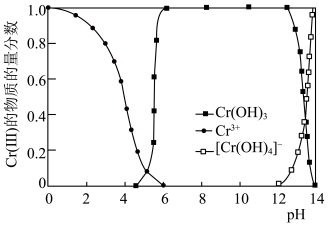
(5)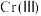 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于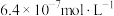 ,则调节pH的范围为
,则调节pH的范围为___________ {已知:25℃时,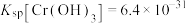 }。
}。 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ; 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为___________ 。
 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: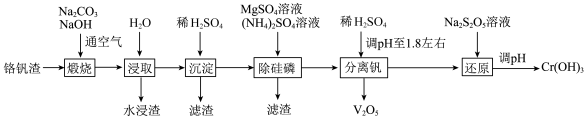
 与
与 固体能发生反应。
固体能发生反应。②
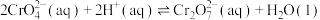 。
。③25℃时,
 ,
,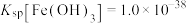 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。(1)“煅烧”时为加快反应速率,可采取的措施为
(2)写出“煅烧”时
 与
与 固体反应的化学方程式:
固体反应的化学方程式:(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=
(5)
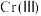 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于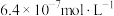 ,则调节pH的范围为
,则调节pH的范围为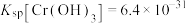 }。
}。
 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为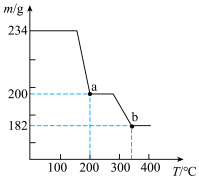
您最近一年使用:0次
8 . 连二亚硫酸钠( )俗称保险粉。传统工业制备连二亚硫酸钠的方法有三种:锌粉法、甲酸钠法、电解法。采用锌粉法制保险粉的部分装置如图(加热装置、夹持装置和搅拌装置已省略)。根据要求回答下列问题:
)俗称保险粉。传统工业制备连二亚硫酸钠的方法有三种:锌粉法、甲酸钠法、电解法。采用锌粉法制保险粉的部分装置如图(加热装置、夹持装置和搅拌装置已省略)。根据要求回答下列问题:___________ ;简述检查装置A的气密性的步骤:___________ 。
(2)写出装置A中生成 的离子方程式:
的离子方程式:___________ 。
(3)装置B中, 与锌粉和水的悬浊液在35~45℃下应生成
与锌粉和水的悬浊液在35~45℃下应生成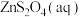 ,冷却至28~35℃,加入烧碱溶液,搅拌,生成
,冷却至28~35℃,加入烧碱溶液,搅拌,生成 和
和 的悬浊液,经过滤、冷却,边搅拌边向滤液中加入一定量的
的悬浊液,经过滤、冷却,边搅拌边向滤液中加入一定量的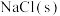 ,经静置后加热至58~60℃,脱水,再加乙醇醇洗,经干燥后制得连二亚硫酸钢成品。
,经静置后加热至58~60℃,脱水,再加乙醇醇洗,经干燥后制得连二亚硫酸钢成品。
①反应过程中“加热至58~60℃”的最佳加热方式为___________ ,采取此加热方式的优点为___________ 。
②向 的水溶液中加入锌粉时,水的电离平衡
的水溶液中加入锌粉时,水的电离平衡___________ (填“正向”或“逆向”)移动。
(4)用碘标准溶液(浓度为 )滴定由定量的样品及甲醛中性溶液配成的样品液,通过淀粉指示剂显色指示滴定终点,可得到连二亚硫酸钠样品的有效含量。
)滴定由定量的样品及甲醛中性溶液配成的样品液,通过淀粉指示剂显色指示滴定终点,可得到连二亚硫酸钠样品的有效含量。
准确称取2.1765g样品,加入预先盛有20mL甲醛中性溶液的烧杯中,搅拌至样品完全溶解,再准确配成250ml。溶液,移出25.00mL配得的溶液于250mL锥形瓶中,向锥形瓶中加入4mL稀盐酸,用碘标准溶液滴定至终点,共消耗碘标准溶液20.00mL。
[查阅资料]样品中 的质量分数
的质量分数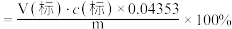 。
。
注:
V(标)——滴定时消耗的碘标准溶液的体积,单位:mL;
c(标)——碘标准溶液的物质的量浓度,单位: ;
;
m——样品的质量,单位:g;
0.04353——与1.000mmol碘标准溶液相当的 的质量,单位:g。
的质量,单位:g。
①达到滴定终点的实验现象为___________ 。
②样品中 的质量分数为
的质量分数为___________ %。若其他操作均正确,滴定结束时酸式滴定管的尖嘴处有气泡,则测得的结果会___________ (填“偏大”“偏小”或“无影响”)。
 )俗称保险粉。传统工业制备连二亚硫酸钠的方法有三种:锌粉法、甲酸钠法、电解法。采用锌粉法制保险粉的部分装置如图(加热装置、夹持装置和搅拌装置已省略)。根据要求回答下列问题:
)俗称保险粉。传统工业制备连二亚硫酸钠的方法有三种:锌粉法、甲酸钠法、电解法。采用锌粉法制保险粉的部分装置如图(加热装置、夹持装置和搅拌装置已省略)。根据要求回答下列问题:
(2)写出装置A中生成
 的离子方程式:
的离子方程式:(3)装置B中,
 与锌粉和水的悬浊液在35~45℃下应生成
与锌粉和水的悬浊液在35~45℃下应生成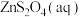 ,冷却至28~35℃,加入烧碱溶液,搅拌,生成
,冷却至28~35℃,加入烧碱溶液,搅拌,生成 和
和 的悬浊液,经过滤、冷却,边搅拌边向滤液中加入一定量的
的悬浊液,经过滤、冷却,边搅拌边向滤液中加入一定量的 ,经静置后加热至58~60℃,脱水,再加乙醇醇洗,经干燥后制得连二亚硫酸钢成品。
,经静置后加热至58~60℃,脱水,再加乙醇醇洗,经干燥后制得连二亚硫酸钢成品。①反应过程中“加热至58~60℃”的最佳加热方式为
②向
 的水溶液中加入锌粉时,水的电离平衡
的水溶液中加入锌粉时,水的电离平衡(4)用碘标准溶液(浓度为
 )滴定由定量的样品及甲醛中性溶液配成的样品液,通过淀粉指示剂显色指示滴定终点,可得到连二亚硫酸钠样品的有效含量。
)滴定由定量的样品及甲醛中性溶液配成的样品液,通过淀粉指示剂显色指示滴定终点,可得到连二亚硫酸钠样品的有效含量。准确称取2.1765g样品,加入预先盛有20mL甲醛中性溶液的烧杯中,搅拌至样品完全溶解,再准确配成250ml。溶液,移出25.00mL配得的溶液于250mL锥形瓶中,向锥形瓶中加入4mL稀盐酸,用碘标准溶液滴定至终点,共消耗碘标准溶液20.00mL。
[查阅资料]样品中
 的质量分数
的质量分数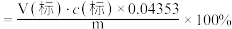 。
。注:
V(标)——滴定时消耗的碘标准溶液的体积,单位:mL;
c(标)——碘标准溶液的物质的量浓度,单位:
 ;
;m——样品的质量,单位:g;
0.04353——与1.000mmol碘标准溶液相当的
 的质量,单位:g。
的质量,单位:g。①达到滴定终点的实验现象为
②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
名校
9 . 氢氧化铬是一种两性氢氧化物,主要用于制备三价铬盐及三氧化二铬,也可用于油漆、颜料生产及羊毛处理等。利用铬渣(铬以低价态含氧酸盐的形式存在,主要杂质为铁、铝、硅、磷等的化合物)制备氢氧化铬的流程如图。已知:最高价铬酸根离子在酸性介质中以 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在,
形式存在, 在pH>12时开始溶解。下列说法错误的是
在pH>12时开始溶解。下列说法错误的是
 形式存在,在碱性介质中以
形式存在,在碱性介质中以 形式存在,
形式存在, 在pH>12时开始溶解。下列说法错误的是
在pH>12时开始溶解。下列说法错误的是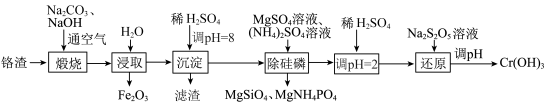
A. 常用作红色涂料 常用作红色涂料 |
B.滤渣中含有 |
C.“煅烧”后铬被氧化为 |
D.“还原”工序发生的反应为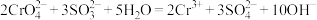 |
您最近一年使用:0次
名校
10 . 碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。___________ (从下列图中选择,写出名称)。___________ 。
(3)海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。
Ⅱ.测定反应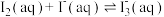 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。
(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
(4)Na2S2O3溶液也可以滴定 的原因是
的原因是___________ (用平衡移动原理回答);滴定终点的实验现象为___________ 。
(5)实验I中,c( )=
)=___________ mol/L(用含c1、c2、c3或c4的式子表示,下同),反应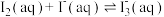 的平衡常数K=
的平衡常数K=___________ 。
(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将___________ (填“偏大”、“偏小”或“无影响”)。
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
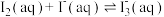 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=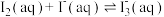 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
您最近一年使用:0次