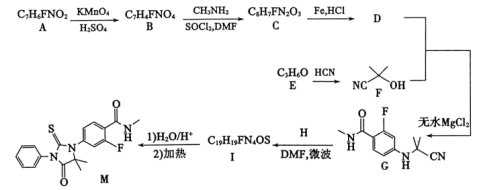
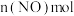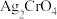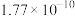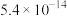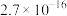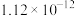1 . enzalutamide是一种治疗晚期前列腺癌的药品,其中间体M的合成路线如图。 。
。_______ ,F在酸性条件下生成羧酸类物质的名称为_______ (用系统命名法命名)。
(2)D→G的化学方程式为_______ 。
(3)H的结构简式为_______ ,I→M分两步完成,第二步反应类型为_______ 。
(4)W是比B多一个碳原子的同系物,写出符合下列条件的W的同分异构体的结构简式_______ (任写两种)。
①含有苯环,可与 溶液反应产生无色无味的气体。
溶液反应产生无色无味的气体。
②核磁共振氢谱表明:分子中共有3种不同化学环境的氢原子,且峰面积比为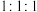 。
。
(5)根据上述信息,设计以 和
和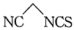 为原料制备
为原料制备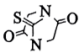 的合成路线
的合成路线_______ (无机试剂任选)。
 。
。②RNCS结构为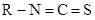 ,可发生反应:
,可发生反应:
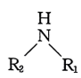

 。
。
(2)D→G的化学方程式为
(3)H的结构简式为
(4)W是比B多一个碳原子的同系物,写出符合下列条件的W的同分异构体的结构简式
①含有苯环,可与
 溶液反应产生无色无味的气体。
溶液反应产生无色无味的气体。②核磁共振氢谱表明:分子中共有3种不同化学环境的氢原子,且峰面积比为
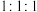 。
。(5)根据上述信息,设计以
 和
和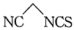 为原料制备
为原料制备 的合成路线
的合成路线
您最近一年使用:0次
2 . 丙烯腈(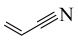 )是一种重要的化工原料,以
)是一种重要的化工原料,以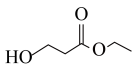 为原料合成丙烯腈的过程如下:
为原料合成丙烯腈的过程如下:

向密闭容器中通入一定量的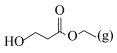 和
和 ,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数
,测得平衡时体系中含碳物质(乙醇除外)的物质的量分数[如:丙烯腈的物质的量分数 ]随温度的变化如图。下列说法错误的是
]随温度的变化如图。下列说法错误的是
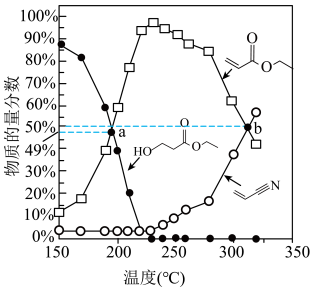
| A.“脱水”反应为吸热反应 |
| B.低于225℃时,“腈化”过程转化率低 |
C.a点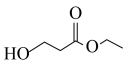 的转化率为51% 的转化率为51% |
D.b点 和 和 的物质的量之比为3:1 的物质的量之比为3:1 |
您最近一年使用:0次
今日更新
|
106次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
3 . 下列实验方案能达到实验目的的是
实验方案 | 实验目的 | |
A | 向 的 的 溶液中加入浓NaOH溶液,振荡、静置、分液,向水层中加入 溶液中加入浓NaOH溶液,振荡、静置、分液,向水层中加入 溶液,过滤 溶液,过滤 | 从 的 的 溶液中提取 溶液中提取 |
B | 向工业食盐中加入酸性 溶液 溶液 | 检验是否含有 |
C | 将含少量 的NaCl固体溶于水,蒸发浓缩至有晶膜析出,冷却结晶后过滤 的NaCl固体溶于水,蒸发浓缩至有晶膜析出,冷却结晶后过滤 | 除去NaCl中的 |
D | 室温下,用pH计分别测定 、 、 醋酸溶液的pH 醋酸溶液的pH | 测定弱电解质浓度大小与电离程度的关系 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
今日更新
|
88次组卷
|
2卷引用:山东省德州市2024届高三下学期高考适应性练习(二)化学试题
解题方法
4 . 某小组欲制备配离子 ,实验如下。
,实验如下。
已知: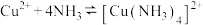
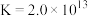
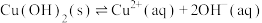
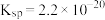
下列说法不正确的是
 ,实验如下。
,实验如下。| 序号 | 步骤 |
| Ⅰ | 向2mL 溶液中滴加0.5mL 溶液中滴加0.5mL 氨水,产生蓝色沉淀;继续滴加约1.5mL氨水,沉淀完全溶解,得到深蓝色溶液 氨水,产生蓝色沉淀;继续滴加约1.5mL氨水,沉淀完全溶解,得到深蓝色溶液 |
| Ⅱ | 分别向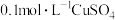 溶液和实验Ⅰ所得深蓝色溶液中加入光亮的铁钉;1min后,前者铁钉表面有红色物质析出,后者铁钉无现象 溶液和实验Ⅰ所得深蓝色溶液中加入光亮的铁钉;1min后,前者铁钉表面有红色物质析出,后者铁钉无现象 |
| Ⅲ | 取0.1g氢氧化铜固体于试管中,加入5mL 氨水,溶液略变为蓝色,固体未见明显溶解;滴加2滴饱和氯化铵溶液,固体完全溶解,得到深蓝色溶液 氨水,溶液略变为蓝色,固体未见明显溶解;滴加2滴饱和氯化铵溶液,固体完全溶解,得到深蓝色溶液 |
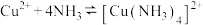
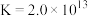
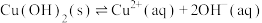
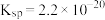
下列说法不正确的是
A.Ⅰ中产生蓝色沉淀的离子方程式为 |
B.加热蒸干Ⅰ中的深蓝色溶液,不能得到纯净的 固体 固体 |
C.Ⅱ中现象证明了 溶液和实验Ⅰ所得深蓝色溶液中,+2价铜的存在形式不同 溶液和实验Ⅰ所得深蓝色溶液中,+2价铜的存在形式不同 |
D.Ⅲ中固体完全溶解的离子方程式为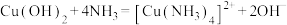 |
您最近一年使用:0次
5 . 四氮化四硫(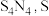 为
为 价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与
价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与 反应制备,反应装置如图所示(夹持和加热装置已省略)。
反应制备,反应装置如图所示(夹持和加热装置已省略)。
已知: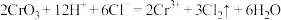 ;
;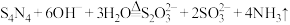
步骤如下: ,打开
,打开 和
和 ,先向装置C中通入干燥纯净的
,先向装置C中通入干燥纯净的 ,待装置C中充满黄绿色气体时,开始加热C,使
,待装置C中充满黄绿色气体时,开始加热C,使 与
与 在
在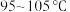 下反应生成
下反应生成 ;
;
②待装置C中的 全部反应后,关闭止水夹
全部反应后,关闭止水夹 ,撤掉装置A、B;
,撤掉装置A、B;
③ 处连接制
处连接制 的装置,关闭止水夹
的装置,关闭止水夹 ,打开
,打开 和
和 ,通入干燥纯净的
,通入干燥纯净的 ,反应制得
,反应制得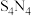 。
。
回答下列问题:
(1)装置A用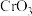 粉末与浓盐酸反应制取
粉末与浓盐酸反应制取 ,发生装置A可以选用
,发生装置A可以选用_________ 。(填选项) 时为使装置C受热均匀,可采用的最佳加热方式为
时为使装置C受热均匀,可采用的最佳加热方式为____________ ;
(3)制取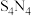 的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式_____________ ;
(4)装置E的作用是____________ 、_________ ;
(5)测定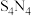 的纯度:称取
的纯度:称取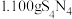 样品(杂质不参与反应),加入
样品(杂质不参与反应),加入 溶液,并加热,释放出的氨气用足量
溶液,并加热,释放出的氨气用足量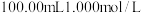 硼酸吸收[假定溶液体积不变,反应为:
硼酸吸收[假定溶液体积不变,反应为: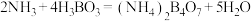 ].反应后的溶液再用
].反应后的溶液再用 的盐酸进行滴定[滴定反应为:
的盐酸进行滴定[滴定反应为: ],重复三次实验.实验数据记录如下表所示:
],重复三次实验.实验数据记录如下表所示:
____________ .(填选项)
A.滴定时应先快后慢滴入盐酸,且眼睛注视滴定管中液面变化
B.滴加最后半滴方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,使溶液流入锥形瓶,振荡摇匀
C.滴定终点装盐酸的滴定管液面如图所示,则读数为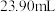
D.滴定管在滴定前有气泡,滴定后气泡消失,导致测定的结果偏高
②制得的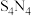 的纯度为
的纯度为____________ 。(保留四位有效数字)
(6)副产物 溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)
溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)
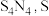 为
为 价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与
价)为橙黄色固体,易被氧化,难溶于水,易溶于四氯化碳,可用氨气与 反应制备,反应装置如图所示(夹持和加热装置已省略)。
反应制备,反应装置如图所示(夹持和加热装置已省略)。已知:
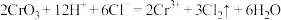 ;
;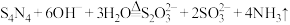
步骤如下:

 ,打开
,打开 和
和 ,先向装置C中通入干燥纯净的
,先向装置C中通入干燥纯净的 ,待装置C中充满黄绿色气体时,开始加热C,使
,待装置C中充满黄绿色气体时,开始加热C,使 与
与 在
在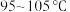 下反应生成
下反应生成 ;
;②待装置C中的
 全部反应后,关闭止水夹
全部反应后,关闭止水夹 ,撤掉装置A、B;
,撤掉装置A、B;③
 处连接制
处连接制 的装置,关闭止水夹
的装置,关闭止水夹 ,打开
,打开 和
和 ,通入干燥纯净的
,通入干燥纯净的 ,反应制得
,反应制得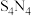 。
。回答下列问题:
(1)装置A用
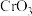 粉末与浓盐酸反应制取
粉末与浓盐酸反应制取 ,发生装置A可以选用
,发生装置A可以选用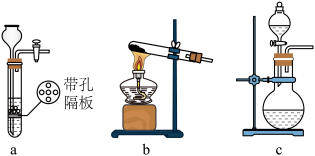
 时为使装置C受热均匀,可采用的最佳加热方式为
时为使装置C受热均匀,可采用的最佳加热方式为(3)制取
 的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式
的同时装置C中还生成一种常见固体单质和一种盐,写出反应的化学方程式(4)装置E的作用是
(5)测定
 的纯度:称取
的纯度:称取 样品(杂质不参与反应),加入
样品(杂质不参与反应),加入 溶液,并加热,释放出的氨气用足量
溶液,并加热,释放出的氨气用足量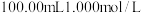 硼酸吸收[假定溶液体积不变,反应为:
硼酸吸收[假定溶液体积不变,反应为: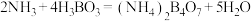 ].反应后的溶液再用
].反应后的溶液再用 的盐酸进行滴定[滴定反应为:
的盐酸进行滴定[滴定反应为: ],重复三次实验.实验数据记录如下表所示:
],重复三次实验.实验数据记录如下表所示:实验序号 | 初始读数 | 最终读数 |
Ⅰ | 0.20 | 20.42 |
Ⅱ | 0.40 | 24.85 |
Ⅲ | 1.00 | 21.18 |

A.滴定时应先快后慢滴入盐酸,且眼睛注视滴定管中液面变化
B.滴加最后半滴方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,再用洗瓶以少量蒸馏水吹洗锥形瓶内壁,使溶液流入锥形瓶,振荡摇匀
C.滴定终点装盐酸的滴定管液面如图所示,则读数为
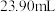
D.滴定管在滴定前有气泡,滴定后气泡消失,导致测定的结果偏高
②制得的
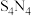 的纯度为
的纯度为(6)副产物
 溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)
溶于水加入硫酸铜溶液中先沉淀后溶解,再向溶解后的深蓝色溶液中加入乙醇后,析出深蓝色晶体,下列叙述正确的是____________.(填选项)A.析出的深蓝色晶体为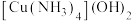 |
| B.深蓝色晶体中的阴阳离子构型都为正四面体形 |
C. 与 与 形成的配位键比 形成的配位键比 与 与 形成的配位键更稳定 形成的配位键更稳定 |
D.由配体 形成配离子 形成配离子 的过程中 的过程中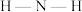 键角变大 键角变大 |
您最近一年使用:0次
6 . 绿色甲醇降碳效应显著,是实现“碳中和”目标的重要举措之一,2024年伊始,绿色甲醇项目被新纳入《产业结构调整指导目录》鼓励类,其推广和应用将迎来快速增长.绿色甲醇合成工艺包含二氧化碳捕集、甲醇合成等几个单元。
(1)二氧化碳捕集
目前有多种用于工业捕集 的方法,一种模拟脱除工业尾气中
的方法,一种模拟脱除工业尾气中 的示意图如图1所示:
的示意图如图1所示:
_________ .某温度下,吸收塔中 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的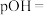
________ (该温度下 的
的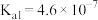 ,
,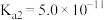 ,
,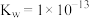 )
)
(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为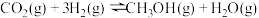 .
.
①向某一密闭容器中充入 和
和 ,在恒温恒压条件下发生反应,下列说法正确的是
,在恒温恒压条件下发生反应,下列说法正确的是_____________ (填选项标号);
A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,
D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入 和
和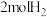 发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率).
发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率)._________ ;二氧化碳加氢制甲醇的速率方程可表示为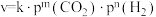 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用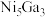 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数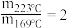 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比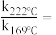
______ ;
③一定温度下,将体积分数为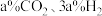 的进料气(含杂质气体),以
的进料气(含杂质气体),以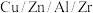 纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,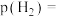
______ 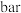 (用含a的代数式表示),该反应的平衡常数
(用含a的代数式表示),该反应的平衡常数
________  (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
④反应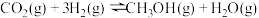 一般认为经过以下步骤:
一般认为经过以下步骤:
反应1: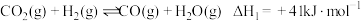
反应2:
若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图_______ ; 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为
的电极反应方程式为_____________ 。
(1)二氧化碳捕集
目前有多种用于工业捕集
 的方法,一种模拟脱除工业尾气中
的方法,一种模拟脱除工业尾气中 的示意图如图1所示:
的示意图如图1所示: 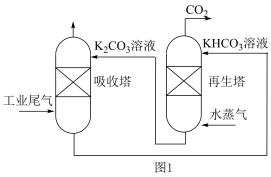
 溶液吸收一定量的
溶液吸收一定量的 后,
后, ,则该溶液的
,则该溶液的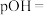
 的
的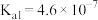 ,
,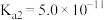 ,
,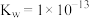 )
)(2)合成甲醇
二氧化碳加氢制甲醇是研究的热点,其反应方程式可表示为
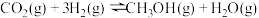 .
.①向某一密闭容器中充入
 和
和 ,在恒温恒压条件下发生反应,下列说法正确的是
,在恒温恒压条件下发生反应,下列说法正确的是A.达到平衡时,容器内混合气体的密度不再改变
B.反应物转化率的比值不再改变说明该反应已达到化学平衡
C.平衡时,

D.达到平衡后,充入惰性气体Ar,反应物的平衡转化率增大
②向恒压(3.0MPa)密闭装置中通入
 和
和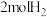 发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率).
发生反应,在不同催化剂下测定甲醇的时空收率随温度的变化曲线如图2所示(时空收率表示单位物质的量催化剂表面甲醇的平均生成速率). 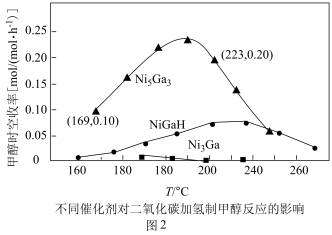
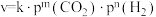 ,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用
,其中k为速率常数,各物质起始分压的指数为各物质的反应级数.实验结果表明,速率常数与反应级数均受反应温度的影响.使用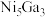 催化剂时,反应温度由169℃升高到223℃,若
催化剂时,反应温度由169℃升高到223℃,若 反应级数
反应级数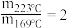 ,
, 反应级数不变,则速率常数之比
反应级数不变,则速率常数之比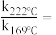
③一定温度下,将体积分数为
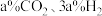 的进料气(含杂质气体),以
的进料气(含杂质气体),以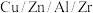 纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,
纳米纤维为催化剂,控制压强为50bar发生反应,进料气中杂质气体不反应,达到平衡时二氧化碳的转化率为90%,达到平衡时,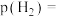
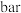 (用含a的代数式表示),该反应的平衡常数
(用含a的代数式表示),该反应的平衡常数
 (
( 为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);
为用分压表示的平衡常数,分压=总压×物质的量分数,用含a的代数式表示);④反应
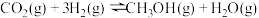 一般认为经过以下步骤:
一般认为经过以下步骤:反应1:
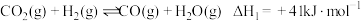
反应2:

若反应1为慢反应,请在下图中画出上述两步反应能量变化的示意图
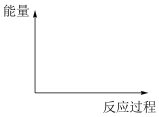
 直接转化为
直接转化为 ,则生成
,则生成 的电极反应方程式为
的电极反应方程式为
您最近一年使用:0次
名校
解题方法
7 . 道路千万条,安全第一条。当汽车在高速行驶中受到猛烈撞击时,会产生大量气体充满气囊,从而保护驾驶员和乘客的安全。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:______ (填“吸热”或“放热”)反应。
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为______ kJ(用含a、b的代数式表示)。
Ⅱ.汽车尾气中的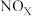 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应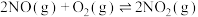 体系中,
体系中,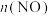 随时间的变化如表:
随时间的变化如表:
(3)下图表示 的变化的曲线是
的变化的曲线是______ ______ (选填序号,下同)。
a.容器内气体的颜色不再变化 b.
c. d.消耗
d.消耗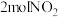 的同时生成
的同时生成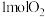
(5)为使该反应的反应速率增大,下列措施正确的是______ 。
a.增大 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示:______ 极(填写“正”或“负”),M处电极反应式是______ ;
(7)该电池产生11.2L(标况下) ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为______ 。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:
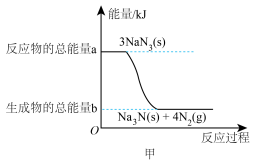
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为
Ⅱ.汽车尾气中的
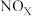 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应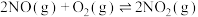 体系中,
体系中,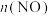 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)下图表示
 的变化的曲线是
的变化的曲线是 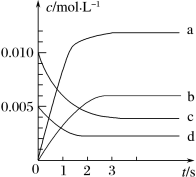
a.容器内气体的颜色不再变化 b.

c.
 d.消耗
d.消耗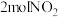 的同时生成
的同时生成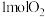
(5)为使该反应的反应速率增大,下列措施正确的是
a.增大
 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应
 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示: 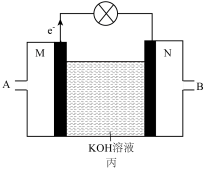
(7)该电池产生11.2L(标况下)
 ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为
您最近一年使用:0次
解题方法
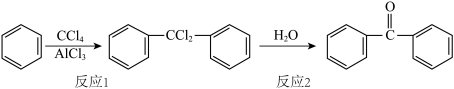
8 . 二苯酮是紫外线吸收剂、有机颜料等的中间体,某小组设计实验并合成二苯酮反应原理及实验装置如下:
实验步骤
步骤一:按图示安装仪器,并检验装置的气密性
步骤二:称取m g无水氯化铝,置于三颈烧瓶中,再加入4.7mL(0.05mol)四氯化碳。
将三颈烧瓶在冷水浴中冷却到10~15℃,缓慢滴加2.7mL(0.03mol)无水苯及2.3mL四氯化碳混合液,维持反应温度在5~10℃之间。
步骤三:在10℃左右继续搅拌1小时。然后将三颈烧瓶没入冰水浴,在搅拌下慢慢滴加30mL水。改为蒸馏装置,蒸去四氯化碳及少量未反应的苯,在加热套上蒸馏0.5h,并促使二苯二氯甲烷水解完全。
步骤四:分出下层粗产品,水层用蒸出的四氯化碳萃取一次,合并后用无水硫酸镁干燥。先在常压下蒸出四氯化碳,温度升至90℃左右时停止加热,再减压蒸馏出二苯酮。
(1)球形干燥管的作用______ 。
(2)一般要称取高于催化剂量的氯化铝,原因______ 。
(3)图乙中毛细管的作用______ 。
(4)需减压蒸出二苯酮的原因______ 。
(5)①若步骤三、四操作忽略水体积的变化,则萃取完成后,为了测定二苯酮水解后溶液中 浓度,取10mL水层溶液,选用
浓度,取10mL水层溶液,选用______ (填序号)做指示剂,用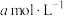 的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为
的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为______ 。
A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D. 溶液
溶液
②若步骤四蒸馏出的产品不纯,需用______ (填标号)进行重结晶进一步提纯得到n克二苯酮;
A.NaOH溶液 B.乙醇 C.盐酸 D.水 E.石油醚
通过计算可知,步骤三、四操作过程中产品的损耗率为______ (列出计算式,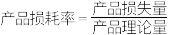
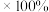 )。
)。
名称 | 分子量 | 性状 | 熔/沸点 | 溶解性 |
苯 | 78 | 无色透明液体 | 5.5/80.1℃ | 不溶于水,易溶于醇和醚 |
| 154 | 无色液体 | -22.6/76.8℃ | 微溶于水,易溶于醇和醚 |
无水 | 133.5 | 白色粉末 | 197/180(升华)℃ | 溶于水并强烈水解,溶于醇、醚并放热 |
二苯酮 | 182 | 白色晶体 | 48.5/305.4℃ | 不溶于水,易溶于醇和醚 |
步骤一:按图示安装仪器,并检验装置的气密性
步骤二:称取m g无水氯化铝,置于三颈烧瓶中,再加入4.7mL(0.05mol)四氯化碳。
将三颈烧瓶在冷水浴中冷却到10~15℃,缓慢滴加2.7mL(0.03mol)无水苯及2.3mL四氯化碳混合液,维持反应温度在5~10℃之间。
步骤三:在10℃左右继续搅拌1小时。然后将三颈烧瓶没入冰水浴,在搅拌下慢慢滴加30mL水。改为蒸馏装置,蒸去四氯化碳及少量未反应的苯,在加热套上蒸馏0.5h,并促使二苯二氯甲烷水解完全。
步骤四:分出下层粗产品,水层用蒸出的四氯化碳萃取一次,合并后用无水硫酸镁干燥。先在常压下蒸出四氯化碳,温度升至90℃左右时停止加热,再减压蒸馏出二苯酮。
(1)球形干燥管的作用
(2)一般要称取高于催化剂量的氯化铝,原因
(3)图乙中毛细管的作用
(4)需减压蒸出二苯酮的原因
(5)①若步骤三、四操作忽略水体积的变化,则萃取完成后,为了测定二苯酮水解后溶液中
 浓度,取10mL水层溶液,选用
浓度,取10mL水层溶液,选用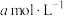 的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为
的硝酸银溶液进行滴定,滴定终点消耗V mL,达到滴定终点的现象为A.NaCl溶液 B.NaBr溶液 C.NaCN溶液 D.
 溶液
溶液难溶物 | AgCl | AgBr | AgCN |
|
颜色 | 白色 | 浅黄色 | 白色 | 砖红色 |
|
|
|
|
|
A.NaOH溶液 B.乙醇 C.盐酸 D.水 E.石油醚
通过计算可知,步骤三、四操作过程中产品的损耗率为
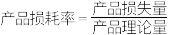
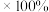 )。
)。
您最近一年使用:0次
9 . 近日,厦门大学固体表面物理化学国家重点实验室教授王野、傅钢和中国科学技术大学教授姜政等,创制出超高稳定性In/Rh@S-1催化剂,高选择性催化丙烷等低碳烷烃直接脱氢制取对应烯烃:C3H8(g) C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。
回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
上述反应中,△H=______ kJ•mol-1。
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是______ (填标号)。
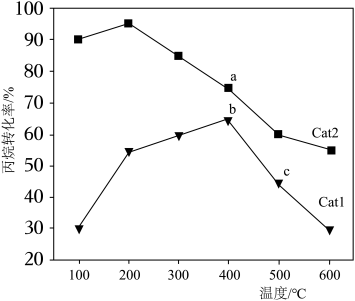
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。______ (填“Cat1”或“Cat2”);b点______ (填“是”或“不是”)平衡点;b→c变化的原因可能是______ 。
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η=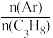 ]关系如图所示。
]关系如图所示。______ n(填“>”“<”或“=”);T1温度下,压强平衡常数Kp=______ kPa(用含p的代数式表示)。[提示:用分压计算的平衡常数叫做压强平衡常数(Kp),分压=总压×物质的量分数。]
(5)以熔融K2CO3(不含O2-和HCO )为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
)为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为_______ 。为了使电池长时间稳定运行,必须确保电解质组成稳定,即在通入的空气中添加_______ (填化学式)。
 C3H6(g)+H2(g) △H。
C3H6(g)+H2(g) △H。回答下列问题:
(1)已知:几种可燃物的燃烧热如表所示。
| 可燃物 | C3H8(g) | C3H6(g) | H2(g) |
| 燃烧热△H/(kJ•mol-1) | -2220 | -2051 | -285.8 |
(2)一定温度下,在恒容密闭容器中充入1mol丙烷发生上述反应。下列叙述中,正确的是
| A.混合气体中H2体积分数最大值为50% |
| B.升高温度,丙烷脱氢反应的平衡常数增大 |
| C.混合气体密度不变时,反应一定达到平衡状态 |
| D.平衡时再充C3H8,丙烷平衡转化率减小 |
(3)单位时间内,丙烷在不同催化剂Cat1、Cat2作用下的转化率与温度关系如图所示。
(4)保持总压强恒定为pkPa,向反应器充入丙烷和氩气(Ar)混合气体,仅发生上述反应,丙烷的平衡转化率与温度、起始投料比[η=
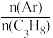 ]关系如图所示。
]关系如图所示。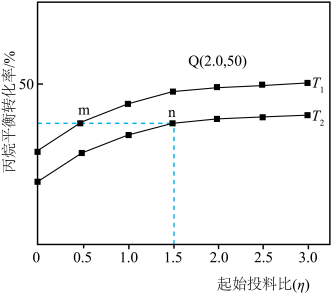
(5)以熔融K2CO3(不含O2-和HCO
 )为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
)为电解质的丙烷-空气燃料电池的放电效率高,该电池放电时,负极反应式为
您最近一年使用:0次
名校
10 . 五氧化二饥广泛用于冶金、化工等行业。某废钒催化剂主要含有 、
、 、CaO、
、CaO、 、
、 、
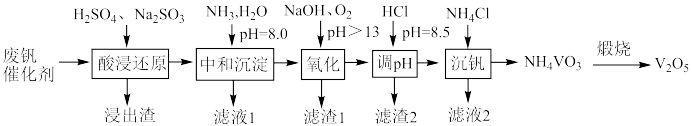
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
回答下列问题:
(1)基态V原子的价电子轨道表示式为________ 。
(2)浸出渣的主要成分是________ ,“酸浸还原”中 ;和
;和 均转化为
均转化为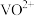 ,写出
,写出 转化为
转化为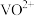 反应的离子方程式为
反应的离子方程式为________ 。
(3)“氧化”中被氧化的元素主要有________ (填元素符号)。
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式________ 。
(5)“沉钒”中需要加入过量 ,其原因是
,其原因是________ 。 ,晶体未经洗涤直接进行“煅烧”,将导致
,晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有________ 杂质。
(6)工艺中可循环利用的物质有________ 。
(7)一定温度下, 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。________ 。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为________ 。
③若碳化钒合金的密度为 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数________ nm。
 、
、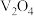 、CaO、
、CaO、 、
、 、
、 等,采取如下工艺流程回收其中的钒制备
等,采取如下工艺流程回收其中的钒制备 ;
;
| 金属离子 |  |  | 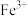 |  |
开始沉淀时( )的pH )的pH | 12.4 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 13.8 | 4.7 | 3.2 | 9.0 |
(1)基态V原子的价电子轨道表示式为
(2)浸出渣的主要成分是
 ;和
;和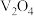 均转化为
均转化为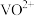 ,写出
,写出 转化为
转化为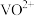 反应的离子方程式为
反应的离子方程式为(3)“氧化”中被氧化的元素主要有
(4)“调pH”中有沉淀生成,写出生成沉淀反应的离子方程式
(5)“沉钒”中需要加入过量
 ,其原因是
,其原因是 ,晶体未经洗涤直接进行“煅烧”,将导致
,晶体未经洗涤直接进行“煅烧”,将导致 产品中混有
产品中混有(6)工艺中可循环利用的物质有
(7)一定温度下,
 溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
溶解在NaOH溶液中,可得到偏钒酸钠。偏钒酸钠阴离子呈现如图1所示的无限链状结构。碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图2所示。
②碳化钒晶胞中与碳原子距离最近且相等的碳原子个数为
③若碳化钒合金的密度为
 ,阿伏加德罗常数值为
,阿伏加德罗常数值为 ,则晶胞参数
,则晶胞参数
您最近一年使用:0次