1 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: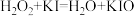 ;
;
反应②: 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。

4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为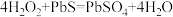 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
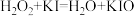 ;
;反应②:
 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.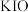 | D. |
A.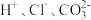 | B.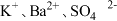 |
C. | D.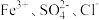 |

4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为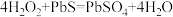 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.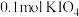 | B.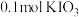 | C.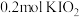 | D.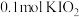 |
您最近一年使用:0次
名校
2 . 回答下列问题
(1)利用 与
与 反应可制得碳化硅晶体,其晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,其晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
________ (填“大于”“小于”或“等于”) 。
。
②碳化硅晶体中每个Si原子周围距离最近的C原子数目为________ 。
③碳化硅的晶胞参数为a pm,晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______ (用含a和ρ的计算式表示)
④碳化硅的硬度_________ (填“大于”“小于”或“等于”)氮化硅的硬度,原因是_____________ 。
(2)氮化碳比氮化硅的硬度更大,其中β—氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知氮化碳的二维晶体结构如图,图中线框内表示晶胞结构。______________ 晶体。
②氮化碳的化学式为______________ 。
(3)三氧化铼 晶胞如图所示,其中O原子的配位数为
晶胞如图所示,其中O原子的配位数为________ ,已知该晶胞的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Re与O的最近距离为
,则Re与O的最近距离为________ cm。
(1)利用
 与
与 反应可制得碳化硅晶体,其晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,其晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。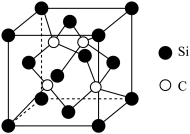

 。
。②碳化硅晶体中每个Si原子周围距离最近的C原子数目为
③碳化硅的晶胞参数为a pm,晶胞密度为
 ,则阿伏加德罗常数
,则阿伏加德罗常数
④碳化硅的硬度
(2)氮化碳比氮化硅的硬度更大,其中β—氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知氮化碳的二维晶体结构如图,图中线框内表示晶胞结构。
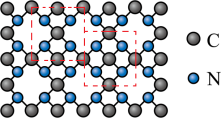
②氮化碳的化学式为
(3)三氧化铼
 晶胞如图所示,其中O原子的配位数为
晶胞如图所示,其中O原子的配位数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Re与O的最近距离为
,则Re与O的最近距离为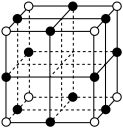
您最近一年使用:0次
7日内更新
|
76次组卷
|
2卷引用:河南省百师联盟2023-2024学年高二下学期五月大联考化学试卷
名校
3 . 电池在人们的生产生活中起着重要的作用,请回答下列问题:
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为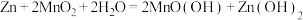 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为:___________ 。___________ ;
②写出a电极上发生的电极反应___________ 。
(3)钴酸锂电池的正极采用钴酸锂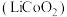 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: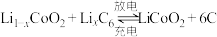 ,写出放电时负极的电极反应
,写出放电时负极的电极反应___________ 。
(4)利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
①烧渣是LiCl、 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为___________ ;
②“滤饼2”的主要成分是___________ ,常温下, 的溶解度比LiOH
的溶解度比LiOH___________ (填“大”或“小”);
③“850℃煅烧”时的化学方程式为:___________ ;
④在实验室检查滤饼2是否洗涤干净的具体操作是:___________ 。
(1)碱性锌锰电池适合需要大电流供电的设备使用如照相机、野外摄像机、无线电控制的航模与海模、电动工具、电动玩具、收录机等,其结构如图所示,放电时的总反应为
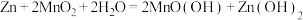 。该电池的正极为
。该电池的正极为 ,其电极反应式为:
,其电极反应式为: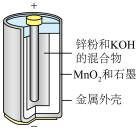
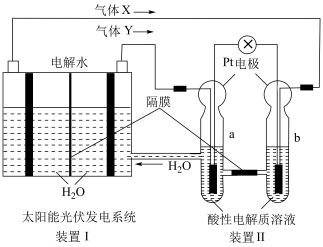
②写出a电极上发生的电极反应
(3)钴酸锂电池的正极采用钴酸锂
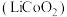 ,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式:
,负极采用金属锂和碳的复合材料,该电池充放电时的总反应式: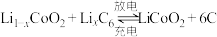 ,写出放电时负极的电极反应
,写出放电时负极的电极反应(4)利用
 对废弃的锂电池正极材料
对废弃的锂电池正极材料 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: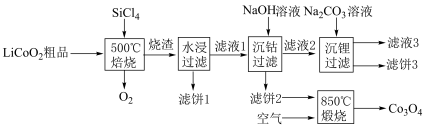
①烧渣是LiCl、
 和
和 的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为
的混合物,则500℃焙烧反应的氧化产物与还原产物的物质的量之比为②“滤饼2”的主要成分是
 的溶解度比LiOH
的溶解度比LiOH③“850℃煅烧”时的化学方程式为:
④在实验室检查滤饼2是否洗涤干净的具体操作是:
您最近一年使用:0次
4 .  是一种锂离子电池的正极材料。用
是一种锂离子电池的正极材料。用 在一定条件下可制得
在一定条件下可制得 。回答下列问题:
。回答下列问题:
(1)写出 在周期表中的位置
在周期表中的位置___________ 。
(2)将 进行热分解,在
进行热分解,在 时,固体残留率为
时,固体残留率为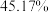 ,写出残留固体(
,写出残留固体( )的化学式
)的化学式___________ (已知:固体残留率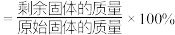 )。
)。
(3)将固体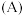 与
与 混合并在空气中煅烧,反应生成
混合并在空气中煅烧,反应生成 ,写出该反应中氧化剂与还原剂物质的之比
,写出该反应中氧化剂与还原剂物质的之比___________ 。
(4)该正极材料充电一段时间后变为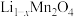 ,为测定
,为测定 的值。称取
的值。称取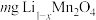 固体,经一系列化学处理,将锂全部转化为
固体,经一系列化学处理,将锂全部转化为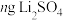 ,写出
,写出 的表达式
的表达式___________ 。
 是一种锂离子电池的正极材料。用
是一种锂离子电池的正极材料。用 在一定条件下可制得
在一定条件下可制得 。回答下列问题:
。回答下列问题:(1)写出
 在周期表中的位置
在周期表中的位置(2)将
 进行热分解,在
进行热分解,在 时,固体残留率为
时,固体残留率为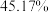 ,写出残留固体(
,写出残留固体( )的化学式
)的化学式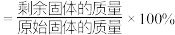 )。
)。(3)将固体
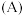 与
与 混合并在空气中煅烧,反应生成
混合并在空气中煅烧,反应生成 ,写出该反应中氧化剂与还原剂物质的之比
,写出该反应中氧化剂与还原剂物质的之比(4)该正极材料充电一段时间后变为
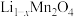 ,为测定
,为测定 的值。称取
的值。称取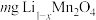 固体,经一系列化学处理,将锂全部转化为
固体,经一系列化学处理,将锂全部转化为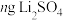 ,写出
,写出 的表达式
的表达式
您最近一年使用:0次
名校
解题方法
5 . 工业合成氮是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,已知反应为
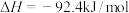 ,
,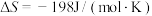 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
1.已知: 下合成氨反应的平衡常数
下合成氨反应的平衡常数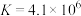 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。
2.只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述正确的是 。
3. 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为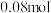 、
、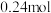 、
、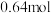 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行_______ 。
4.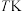 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为_______ (答案保留2位有效数字);其他条件不变,若向此平衡体系中再充入 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数_______ 40%(填“<”“>”或“=”)
5.合成氨反应的正反应活化能_______ 逆反应活化能(填“大于”、“小于”或“等于”),加入催化剂比不加催化剂时,正反应活化能_______ (填“增高”或“降低”或“不变”),逆反应活化能_______ (填“增高”或“降低”或“不变”),催化剂改变了反应历程,同等程度提高了正、逆反应的速率。

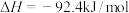 ,
,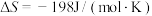 ,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:
,该反应的焓变和熵变随温度变化很小,可视为常数。回答下列问题:1.已知:
 下合成氨反应的平衡常数
下合成氨反应的平衡常数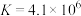 ,可判断下列关于合成氨反应的说法正确的是 。
,可判断下列关于合成氨反应的说法正确的是 。| A.在该温度下反应速率较快 |
| B.在该温度下正反应进行得比较完全 |
| C.在该温度下加入催化剂,平衡常数将发生变化 |
| D.仅从K值可得知该反应的平衡转化率 |
| A.K值变化,平衡不一定移动 | B.K值不变,平衡可能移动 |
| C.平衡移动,K值可能不变 | D.平衡移动,K值一定变化 |
 时,若测得某一时刻,在
时,若测得某一时刻,在 的恒容密闭容器中,
的恒容密闭容器中, 、
、 、
、 的物质的量分别为
的物质的量分别为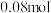 、
、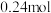 、
、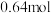 ,请通过列式计算判断此时该反应向哪个方向进行
,请通过列式计算判断此时该反应向哪个方向进行4.
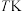 时,在2L的恒容密闭容器中,投入
时,在2L的恒容密闭容器中,投入 和
和 发生合成氨反应,平衡时
发生合成氨反应,平衡时 的体积分数为40%,则该温度下的
的体积分数为40%,则该温度下的 的平衡转化率为
的平衡转化率为 和
和 ,则平衡时
,则平衡时 的体积分数
的体积分数5.合成氨反应的正反应活化能
您最近一年使用:0次
6 . 乙烯是重要的有机化工基础原料,主要由石油裂解获得,随着石油资源的不断消耗,研究人员已开发出利用天然气替代石油生产乙烯的方法:
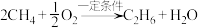
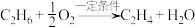
1. 的空间构型为
的空间构型为_______ 。
A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于_______ 。
A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用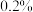 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。_______
3.乙烯发生_______ 反应得到聚乙烯。
A.取代 B.聚合 C.氧化
聚乙烯可用于制造_______ 。
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和_______ 在浓硫酸催化作用下反应生成乙酸乙酯。有研究表明上述反应也可使用甘氨酸 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势_______ 。
5.自然界中也存在酯类化合物,如_______ 。
A.蛋白质 B.淀粉 C.油脂 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。
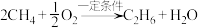
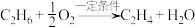
1.
 的空间构型为
的空间构型为A.平面正方形 B.三角锥形 C.正四面体
 与
与 属于
属于A.同系物 B.同分异构体 C.同素异形体 D.同位素
2.水果成熟后会释放出乙烯,在水果箱中放入一些用
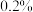 的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。
的高锰酸钾溶液浸泡过的纸张可以延长水果的保质期,解释其原因。3.乙烯发生
A.取代 B.聚合 C.氧化
聚乙烯可用于制造
A.汽车轮胎 B.塑料大棚薄膜 C.食品保鲜袋 D.棉质内衣
4.乙烯水合制得乙醇。乙醇和
 作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势
作催化剂。甘氨酸广泛存在于人体内。从设备腐蚀和保护环境两个角度说明使用甘氨酸代替浓硫酸作催化剂的优势5.自然界中也存在酯类化合物,如
A.蛋白质 B.淀粉 C.油脂
很多药物中含有酯的结构,如医药史上三大经典药物之一的解热镇痛药阿司匹林,其主要成分是乙酰水杨酸(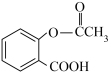 )。写出乙酰水杨酸分子中含有的官能团
)。写出乙酰水杨酸分子中含有的官能团
 是由_______种氨基酸通过分子间脱水形成的。
是由_______种氨基酸通过分子间脱水形成的。| A.1 | B.2 | C.3 | D.4 |
您最近一年使用:0次
名校
解题方法
7 . 有机物的同分异构现象广泛存在。按要求回答下列问题。
(1)正丁烷的一氯代物有两种,其中一种的名称为1-氯丁烷,另一种的结构简式为_______ 。
(2)分子式为C5H10的烯烃结构有_______ 种;相对分子质量为68的炔烃的结构有_______ 种。分子式为C9H12的苯的同系物的结构有_______ 种。
(3)联苯 的一溴代物有
的一溴代物有_______ 种,二溴代物有_______ 种。
(4)分子式为C10H14的苯的同系物。
①若与酸性KMnO4氧化时生成对苯二甲酸,则其可能的结构有_______ 种。
②若有三种化学环境不同的氢原子,其结构简式为_______ 。
③若有两种化学环境不同的氢原子,其名称为_______ 。
(1)正丁烷的一氯代物有两种,其中一种的名称为1-氯丁烷,另一种的结构简式为
(2)分子式为C5H10的烯烃结构有
(3)联苯
 的一溴代物有
的一溴代物有(4)分子式为C10H14的苯的同系物。
①若与酸性KMnO4氧化时生成对苯二甲酸,则其可能的结构有
②若有三种化学环境不同的氢原子,其结构简式为
③若有两种化学环境不同的氢原子,其名称为
您最近一年使用:0次
解题方法
8 .  是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。_______ 。
(2)N、O、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为_______ , 的空间结构为
的空间结构为_______ 。
(3)固态硒代蛋氨酸晶体类型为_______ ,硒代蛋氨酸分子中 的杂化方式为
的杂化方式为_______ 。
(4)比较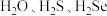 的沸点大小:
的沸点大小:_______ ,原因是_______ 。
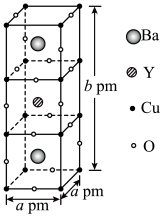
(5)某种具有氧原子缺陷的超导材料的长方体晶胞结构如图所示。晶胞参数分别为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。已知该晶体中
。已知该晶体中 为
为 价,Y为
价,Y为 价,O为
价,O为 价,则
价,则
_______ ,该晶体的密度为_______  。
。
 是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
是人体必需微量元素之一、研究表明硒代蛋氨酸(结构简式如下图)有抗氧化作用,对肿瘤细胞增殖有显著抑制作用。
(2)N、O、
 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为 的空间结构为
的空间结构为(3)固态硒代蛋氨酸晶体类型为
 的杂化方式为
的杂化方式为(4)比较
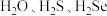 的沸点大小:
的沸点大小:(5)某种具有氧原子缺陷的超导材料的长方体晶胞结构如图所示。晶胞参数分别为
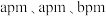 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 。已知该晶体中
。已知该晶体中 为
为 价,Y为
价,Y为 价,O为
价,O为 价,则
价,则
 。
。
您最近一年使用:0次
9 . 氢能是应用前景广阔的新能源。
(1)制氢。工业上电解碱性尿素水溶液制氢。
①阳极活性物质Ni(OH)2首先放电生成NiOOH,该过程的电极反应式为___________ 。
②CO(NH2)2吸附在NiOOH上被氧化生成N2.根据电负性规则,CO(NH2)2分子中能被Ni吸附的原子是___________ (填元素符号)。
(2)储氢。部分H2和Mg一定条件下化合生成MgH2以储氢;部分H2和N2在催化剂表面合成氨以储氢,其反应机理的部分过程如图-1所示。______ 。
②研究发现,使用Ru系催化剂时,N2在催化剂表面的吸附活化是整个反应过程的控速步骤,实际工业生产时,将n(H2)/n(N2)控制在1.8~2.2之间,比理论值3小,其原因是___________ 。
(3)释氢。MgH2可通过热分解和水解两种方法制得H2。相较于热分解,从物质转化和能量利用的角度分析,MgH2水解释氢方法的优点有___________ 。
(4)储氢物质NH3的运用。NH3常用于烟气(主要成分NO、NO2)脱硝。以N2为载气,将含一定量NO、NH3及O2的模拟烟气以一定流速通过装有催化剂CeO2的反应管,研究温度、SO2(g)、H2O(g)对脱硝反应的影响。___________ 。
②如图-3所示,温度高于350℃时,和不含水蒸气的烟气相比,含10%水蒸气的烟气的NO转化率更高,其原因是___________ 。
③实验证明,烟气中含SO2会导致催化剂不可逆的中毒(Ce4+氧化SO2生成SO 覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因___________ 。
(1)制氢。工业上电解碱性尿素水溶液制氢。
①阳极活性物质Ni(OH)2首先放电生成NiOOH,该过程的电极反应式为
②CO(NH2)2吸附在NiOOH上被氧化生成N2.根据电负性规则,CO(NH2)2分子中能被Ni吸附的原子是
(2)储氢。部分H2和Mg一定条件下化合生成MgH2以储氢;部分H2和N2在催化剂表面合成氨以储氢,其反应机理的部分过程如图-1所示。

②研究发现,使用Ru系催化剂时,N2在催化剂表面的吸附活化是整个反应过程的控速步骤,实际工业生产时,将n(H2)/n(N2)控制在1.8~2.2之间,比理论值3小,其原因是
(3)释氢。MgH2可通过热分解和水解两种方法制得H2。相较于热分解,从物质转化和能量利用的角度分析,MgH2水解释氢方法的优点有
(4)储氢物质NH3的运用。NH3常用于烟气(主要成分NO、NO2)脱硝。以N2为载气,将含一定量NO、NH3及O2的模拟烟气以一定流速通过装有催化剂CeO2的反应管,研究温度、SO2(g)、H2O(g)对脱硝反应的影响。

②如图-3所示,温度高于350℃时,和不含水蒸气的烟气相比,含10%水蒸气的烟气的NO转化率更高,其原因是
③实验证明,烟气中含SO2会导致催化剂不可逆的中毒(Ce4+氧化SO2生成SO
 覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
覆盖在生成的Ce3+表面,阻止了O2氧化Ce3+)。而添加CuO后抗硫能力显著增强,请结合图-4机理,说明抗硫能力增强的原因
您最近一年使用:0次
10 . 某化工厂制取硝酸铜有以下两种途径:
A.铜与稀硝酸反应,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
B.铜与浓硝酸反应,反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2X↑+2H2O
(1)试确定X的化学式_______ ,硝酸铜中氮元素化合价为_______ 。
(2)对比A、B两个反应可得到的结论是_______ 。
(3)一氧化氮,二氧化氮是大气污染物,在生产中要尽可能减少排放,判断:若要制得等质量的硝酸铜,以上的_______ 途径较好?说明理由_______ ,_______ 。(两条)
(4)根据所学知识,设计制取硝酸铜的最佳途径(用化学方程式表示)。______________ 。
A.铜与稀硝酸反应,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
B.铜与浓硝酸反应,反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2X↑+2H2O
(1)试确定X的化学式
(2)对比A、B两个反应可得到的结论是
(3)一氧化氮,二氧化氮是大气污染物,在生产中要尽可能减少排放,判断:若要制得等质量的硝酸铜,以上的
(4)根据所学知识,设计制取硝酸铜的最佳途径(用化学方程式表示)。
您最近一年使用:0次



