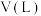名校
解题方法
1 . 近年来,“氮排放”逐渐引起人们的重视。氮及其化合物与生产生活及环境息息相关,请回答下列问题:
(1)下列环境问题与氮的氧化物排放无关的是___________。
(2)汽车尾气中存在NO和CO,通过在排气管处加装催化剂,可以使其转化为对环境友好的物质,请写出发生反应的化学方程式___________ 。
(3)硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
①工业生产中为了盛装大量浓硝酸,可选择___________ 作为罐体材料。
A.Mg B.Al C.Fe D.Cu
②为避免硝酸生产尾气中的NO2污染环境,可以使用具有碱性的碳酸钠溶液吸收,发生反应的离子方程式为___________ 。
③硝酸与金属反应会产生氮氧化物。在含有agHNO3的稀硝酸中,加入bg铁粉充分反应, 铁全部溶解并生成NO,有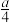 gHNO3被还原,则a:b可能为
gHNO3被还原,则a:b可能为___________ 。
A.2:1 B.3:1 C.4:1 D.8:3
(4)氮化硅(Si3N4)陶瓷材料可用于高温工程的部件、冶金工业等方面的高级耐火材料,可由石英与焦炭在高温的氮气流中制备,反应的化学方程式为___________ 。
(5)氮的同族元素锑(Sb)可形成比纯硫酸更强的酸——氟锑酸(HSbF6),称为超酸。为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为:CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为___________ 。
(1)下列环境问题与氮的氧化物排放无关的是___________。
| A.酸雨 | B.光化学烟雾 | C.臭氧层空洞 | D.白色污染 |
(3)硝酸是重要的化工原料,用于制化肥、农药、炸药、染料等。
①工业生产中为了盛装大量浓硝酸,可选择
A.Mg B.Al C.Fe D.Cu
②为避免硝酸生产尾气中的NO2污染环境,可以使用具有碱性的碳酸钠溶液吸收,发生反应的离子方程式为
③硝酸与金属反应会产生氮氧化物。在含有agHNO3的稀硝酸中,加入bg铁粉充分反应, 铁全部溶解并生成NO,有
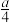 gHNO3被还原,则a:b可能为
gHNO3被还原,则a:b可能为A.2:1 B.3:1 C.4:1 D.8:3
(4)氮化硅(Si3N4)陶瓷材料可用于高温工程的部件、冶金工业等方面的高级耐火材料,可由石英与焦炭在高温的氮气流中制备,反应的化学方程式为
(5)氮的同族元素锑(Sb)可形成比纯硫酸更强的酸——氟锑酸(HSbF6),称为超酸。为更好地理解超酸的强酸性,实验小组查阅相关资料了解到:弱酸在强酸性溶剂中表现出碱的性质,如冰醋酸与纯硫酸之间的化学反应方程式为:CH3COOH+H2SO4=[CH3C(OH)2]+[HSO4]-。以此类推,H2SO4与HSbF6之间的化学反应方程式为
您最近一年使用:0次
2024-04-30更新
|
126次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期期中考试化学试题(A)
名校
解题方法
2 . 用氨水吸收 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
___________ 。(已知: 时,电离常数
时,电离常数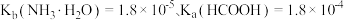 )
)
 ,得到
,得到 氨水和
氨水和 甲酸铵的混合溶液,
甲酸铵的混合溶液, 时该混合溶液的
时该混合溶液的
 时,电离常数
时,电离常数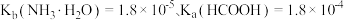 )
)
您最近一年使用:0次
名校
解题方法
3 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)存贮时,Na应保存在___________ 中;实验室取用少量金属钠需要用到的实验用品有玻璃片、小刀、___________ 和___________ 等。
(2)工业上采用电解熔融NaCl(熔点为 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: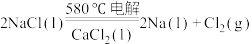 ,加入
,加入 的目的是
的目的是___________ (填序号)。
a.作催化剂,加块电解反应的速率
b.作还原剂,将 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。
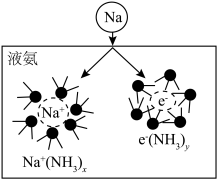
①生成的气体为___________ (填分子式)
②当 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过___________ 。(填序号)
a.无水 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液
(5)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为___________ g。
(6)为确定 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸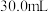 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:
①样品中物质的量之比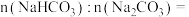
___________ 。
②稀盐酸的物质的量浓度
___________ mol/L。
(1)存贮时,Na应保存在
(2)工业上采用电解熔融NaCl(熔点为
 )制备金属Na,电解反应方程式:
)制备金属Na,电解反应方程式: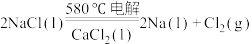 ,加入
,加入 的目的是
的目的是a.作催化剂,加块电解反应的速率
b.作还原剂,将
 还原为
还原为
c.作助熔剂,降低生产过程的能耗
d.作氧化剂,将
 氧化为
氧化为
(3)钠能与液氨反应,生成氨基钠(NaNH2)和一种气体单质。将钠投入液氨中,会快速得到深蓝色溶液(生成蓝色的溶剂合电子,如图所示),后慢慢产生气泡。

①生成的气体为
②当
 钠投入液氨生成
钠投入液氨生成 气体时,Na共失去的电子
气体时,Na共失去的电子 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)采用空气和Na为原料可直接制备Na2O2。为防止空气中的某些成分与Na2O2反应,空气与熔融金属Na反应前需依次通过
a.无水
 b.饱和食盐水 c.饱和
b.饱和食盐水 c.饱和 溶液 d.
溶液 d. 溶液 e.
溶液 e. 溶液
溶液(5)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体
充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.28g,则固体 的质量为
的质量为(6)为确定
 和
和 混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸
混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度的稀盐酸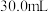 ,充分反应,产生
,充分反应,产生 的体积(已折算成标准状况下的体积,不考虑
的体积(已折算成标准状况下的体积,不考虑 在水中的溶解)如下表:
在水中的溶解)如下表:| 实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
| 样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
 体积(mL) 体积(mL) | 672 | 840 | 896 | 672 |
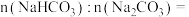
②稀盐酸的物质的量浓度

您最近一年使用:0次
名校
解题方法
4 . 为确定某一铁铜样品中各成份的含量,某同学进行了如下实验:准确称取一份质量为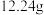 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:
根据以上实验数据,请回答:
(1)上述实验当加入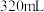 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为______ 。
(2)稀硝酸的物质的量浓度为______  。
。
(3)样品中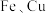 的物质的量之比为
的物质的量之比为______ 。
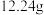 铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成
铁铜样品,逐渐加入一定体积某浓度的稀硝酸,每次实验充分反应后,测得生成 气体的体积为
气体的体积为 (已换成标准状况,假设生成的
(已换成标准状况,假设生成的 全部逸出),并测得剩余固体质量为
全部逸出),并测得剩余固体质量为 。各次实验的数据如下表:
。各次实验的数据如下表:稀硝酸体积 | 0 | 80 | 160 | 240 | 320 | 400 |
| 0 | 0.896 | 1.792 | 2.688 | 3.584 | 4.48 |
剩余固体质量 | 12.24 | 8.88 | 5.52 | 1.92 | 0 | 0 |
(1)上述实验当加入
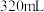 稀硝酸后,所发生反应的离子方程式为
稀硝酸后,所发生反应的离子方程式为(2)稀硝酸的物质的量浓度为
 。
。(3)样品中
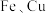 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
5 . 已知Fe2O3在高炉中有下列反应:Fe2O3+CO→2FeO+CO2。反应形成的固体混合物(含Fe2O3和FeO)中,元素铁和氧的质量比用m(Fe)∶m(O)表示。
(1)上述固体混合物中,m(Fe)∶m(O)不可能是___________ (选填a、b、c)。
a.21∶9 b.21∶7.5 c.21∶6
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率___________ 。
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%=___________ ;请在下图中画出A%和m(Fe)∶m(O)关系的图形___________ 。
(1)上述固体混合物中,m(Fe)∶m(O)不可能是
a.21∶9 b.21∶7.5 c.21∶6
(2)若m(Fe)∶m(O)=21∶8,计算Fe2O3被CO还原的百分率
(3)设Fe2O3被CO还原的百分率为A%,则A%和混合物中m(Fe)∶m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]A%=

| 混合物组成(用化学式表示) | a的取值范围 |
您最近一年使用:0次
2024高三·全国·专题练习
6 . 一定条件下, 和
和 可以发生如下两个平行反应:
可以发生如下两个平行反应:
I.

II.

保持温度恒定,向一定体积的密闭容器中按体积比1:3充入 和
和 ,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时
,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时 的选择性为75%(反应中转化的
的选择性为75%(反应中转化的 中生成
中生成 的百分比)。则:
的百分比)。则: 的转化率为
的转化率为___________ ;该条件下反应II的压强平衡常数 为
为___________ 。(用分压表示,分压=总压×物质的量分数)
 和
和 可以发生如下两个平行反应:
可以发生如下两个平行反应:I.


II.


保持温度恒定,向一定体积的密闭容器中按体积比1:3充入
 和
和 ,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时
,起始压强为4MPa.发生上述平行反应,达到平衡后压强为2.8MPa.已知达到平衡时 的选择性为75%(反应中转化的
的选择性为75%(反应中转化的 中生成
中生成 的百分比)。则:
的百分比)。则: 的转化率为
的转化率为 为
为
您最近一年使用:0次
名校
解题方法
7 . 填写下列空白:
(1)工业上湿法制备高铁酸钾( )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式___________ ;若反应过程中转移了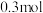 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为___________  。
。
(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)___________ 。
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是___________ g。
(4)将 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)等质量的铝分别与 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:___________ ;铝的质量为___________ g。
(6)将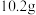 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入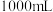 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为___________  。
。
(1)工业上湿法制备高铁酸钾(
 )的反应体系中有六种微粒:
)的反应体系中有六种微粒: 、
、 、
、 、
、 、
、 、
、 。写出并配平该反应的离子方程式
。写出并配平该反应的离子方程式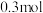 电子,则还原产物的物质的量为
电子,则还原产物的物质的量为 。
。(2)一定条件下,下列物质可以通过化合反应制得的有(写序号)
①小苏打 ②硫酸铝 ③氯化亚铁 ④磁性氧化铁 ⑤铜绿(碱式碳酸铜) ⑥氢氧化铁
(3)向一定量的
 的混合物中加入
的混合物中加入 的盐酸,恰好使混合物完全溶解,放出
的盐酸,恰好使混合物完全溶解,放出 (标准状况)的气体,在所得溶液中加入
(标准状况)的气体,在所得溶液中加入 溶液无血红色出现。若用足量的
溶液无血红色出现。若用足量的 在高温下还原相同质量的此混合物,能得到铁的质量是
在高温下还原相同质量的此混合物,能得到铁的质量是(4)将
 铁粉与含有
铁粉与含有 的
的 溶液完全反应,铁粉全部溶解,并得到
溶液完全反应,铁粉全部溶解,并得到 铜,则参加反应的
铜,则参加反应的 与
与 的物质的量之比为
的物质的量之比为(5)等质量的铝分别与
 浓度均为
浓度均为 的盐酸和氢氧化钠溶液反应,生成气体体积比为
的盐酸和氢氧化钠溶液反应,生成气体体积比为 ,铝与氢氧化钠溶液反应的离子方程式:
,铝与氢氧化钠溶液反应的离子方程式:(6)将
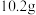 镁铝合金置于
镁铝合金置于 的盐酸中充分反应,无金属剩余,向反应后的溶液中加入
的盐酸中充分反应,无金属剩余,向反应后的溶液中加入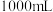 烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为
烧碱溶液,沉淀达到最大值,加入的烧碱的物质的量浓度为 。
。
您最近一年使用:0次
8 . 氧化还原反应原理及物质的量的相关计算在生产、生活中应用广泛。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)_______ 。
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式_______ 。
(4)一定条件下,当溶液中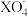 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中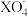 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为_______ 。
(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是_______ g/L(保留一位小数);
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数_______ 。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式
(4)一定条件下,当溶液中
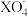 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中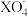 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数
您最近一年使用:0次
名校
解题方法
9 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: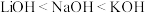 |
C.还原性: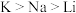 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: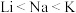 |
您最近一年使用:0次
2023-12-23更新
|
145次组卷
|
3卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
解题方法
10 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)用空气和 可直接制备
可直接制备 。空气与熔融
。空气与熔融 反应前需依次通过填
反应前需依次通过填_______ 、_______ (填标号)
a.浓硫酸 b.饱和食盐水 c. 溶液 d.
溶液 d. 溶液
溶液
(2)将 和
和 的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为
的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为 和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为
和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为_______ ,其物质的量之比为_______ ,原混合物中 的质量为
的质量为_______ 。
(3)为探究 的某些化学性质进行如下实验:向锥形瓶内加入饱和
的某些化学性质进行如下实验:向锥形瓶内加入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 分压(
分压( 的分压
的分压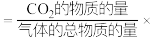 气体总压强),测得
气体总压强),测得 分压与温度的变化关系如图所示。温度在50℃之前,装置中
分压与温度的变化关系如图所示。温度在50℃之前,装置中 分压增大的主要原因是
分压增大的主要原因是_______ ;温度升高到50℃之后,装置中 分压急剧增大的原因是
分压急剧增大的原因是_______ 。
(1)用空气和
 可直接制备
可直接制备 。空气与熔融
。空气与熔融 反应前需依次通过填
反应前需依次通过填a.浓硫酸 b.饱和食盐水 c.
 溶液 d.
溶液 d. 溶液
溶液(2)将
 和
和 的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为
的混合物置于真空密闭容器中加热,充分反应后经检测气体产物为 和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为
和水蒸气,其总质量为33g,冷却至标准状况下的体积为16.8L。则剩余固体的成分为 的质量为
的质量为(3)为探究
 的某些化学性质进行如下实验:向锥形瓶内加入饱和
的某些化学性质进行如下实验:向锥形瓶内加入饱和 溶液,用
溶液,用 传感器测定密闭装置中
传感器测定密闭装置中 分压(
分压( 的分压
的分压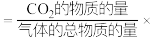 气体总压强),测得
气体总压强),测得 分压与温度的变化关系如图所示。温度在50℃之前,装置中
分压与温度的变化关系如图所示。温度在50℃之前,装置中 分压增大的主要原因是
分压增大的主要原因是 分压急剧增大的原因是
分压急剧增大的原因是
您最近一年使用:0次