氧化还原反应原理及物质的量的相关计算在生产、生活中应用广泛。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)_______ 。
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为 ,此反应的离子方程式为
,此反应的离子方程式为_______ 。
(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式_______ 。
(4)一定条件下,当溶液中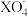 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中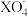 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为_______ 。
(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______ 。
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是_______ g/L(保留一位小数);
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数_______ 。
(1)某同学写出以下化学反应方程式(未配平):①NH3+NO→HNO2+H2O,②NO+HNO3→N2O3+H2O,③N2O4+H2O→HNO2+HNO3,其中一定不可能实现的是(填序号)
(2)ClO2可用于污水的杀菌和饮用水的净化。KClO3与SO2在强酸性溶液中反应可制得ClO2,SO2被氧化为
 ,此反应的离子方程式为
,此反应的离子方程式为(3)已知亚硝酸钠(NaNO2)可以与氯化铵(NH4Cl)反应生成氮气、氯化钠及其它产物,写出该反应的化学反应方程式
(4)一定条件下,当溶液中
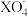 与H2O2物质的量比恰好为2:5时,溶液中
与H2O2物质的量比恰好为2:5时,溶液中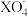 离子被还原为较低价态,则X元素的化合价变为
离子被还原为较低价态,则X元素的化合价变为(5)将不纯的NaOH样品2g(含少量Na2CO3和水),放入50mL2mol/L的盐酸中,充分反应后,溶液呈酸性,中和剩余的酸又用去40mLlmol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为
(6)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压,放电管来制取臭氧:
①在臭氧发生装置中装入氧气100mL,经反应最后气体体积变为95mL(体积均在标准状况下测定),则混合气体的密度是
②实验室将氧气和臭氧的混合气体0.896L(标准状况),通入盛有20.0g铜粉的反应容器中,充分加热后,粉末的质量最终变为21.6g。则原混合气中臭氧的体积分数
更新时间:2024-01-06 08:14:21
|
相似题推荐
计算题
|
较难
(0.4)
【推荐1】现有标准状况下V L 气体AB3,它的摩尔质量为M g·mol-1。则:
(1)该气体所含原子总数为________________ 个(列出计算式即可,下同)。
(2)该气体的质量为_____________ g。
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________ 。
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为_______________ mol·L-1。
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度为_____________________ mol·L-1
(1)该气体所含原子总数为
(2)该气体的质量为
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度为
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】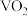 是一种光、电、磁性能优异的热敏相变材料。可由氧矾(Ⅳ)碱式碳酸铵{化学组成可表示为
是一种光、电、磁性能优异的热敏相变材料。可由氧矾(Ⅳ)碱式碳酸铵{化学组成可表示为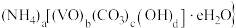 热分解得到。回答下列问题:
热分解得到。回答下列问题:
(1)氧矾(Ⅳ)碱式碳酸铵可由 、联氨的盐酸盐及
、联氨的盐酸盐及 等反应制得。
等反应制得。
①联氨 是一种二元弱碱,联氨的盐酸盐的正盐的化学式为
是一种二元弱碱,联氨的盐酸盐的正盐的化学式为__________ 。
② 在水溶液中电离方程式为
在水溶液中电离方程式为______________________ 。
(2)已知氧矾(Ⅳ)碱式碳酸铵的摩尔质量为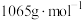 ,通过热重曲线可确定其化学式。取一定量样品在氮气气氛中加热,样品的固体残留率(
,通过热重曲线可确定其化学式。取一定量样品在氮气气氛中加热,样品的固体残留率(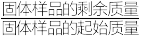 ×100%)随温度的变化如下图所示(在热重分析过程各元素的化合价不变)。
×100%)随温度的变化如下图所示(在热重分析过程各元素的化合价不变)。
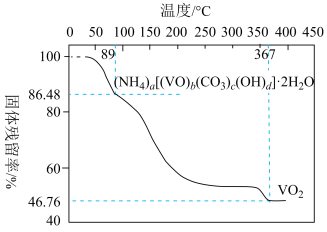
①加热到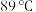 时,只失去结晶水且失去的结晶水刚好占整个结晶水的
时,只失去结晶水且失去的结晶水刚好占整个结晶水的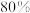 ,则
,则
________  保留整数
保留整数 。
。
②称取 样品与足量NaOH充分反应,生成
样品与足量NaOH充分反应,生成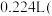 标准状况下
标准状况下 。则
。则
____ 。
③结合①、②的计算结果和图中数据确定氧矾(Ⅳ)碱式碳酸铵的化学式(写出计算过程)。________
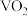 是一种光、电、磁性能优异的热敏相变材料。可由氧矾(Ⅳ)碱式碳酸铵{化学组成可表示为
是一种光、电、磁性能优异的热敏相变材料。可由氧矾(Ⅳ)碱式碳酸铵{化学组成可表示为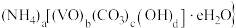 热分解得到。回答下列问题:
热分解得到。回答下列问题: (1)氧矾(Ⅳ)碱式碳酸铵可由
 、联氨的盐酸盐及
、联氨的盐酸盐及 等反应制得。
等反应制得。①联氨
 是一种二元弱碱,联氨的盐酸盐的正盐的化学式为
是一种二元弱碱,联氨的盐酸盐的正盐的化学式为②
 在水溶液中电离方程式为
在水溶液中电离方程式为(2)已知氧矾(Ⅳ)碱式碳酸铵的摩尔质量为
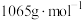 ,通过热重曲线可确定其化学式。取一定量样品在氮气气氛中加热,样品的固体残留率(
,通过热重曲线可确定其化学式。取一定量样品在氮气气氛中加热,样品的固体残留率(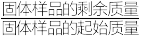 ×100%)随温度的变化如下图所示(在热重分析过程各元素的化合价不变)。
×100%)随温度的变化如下图所示(在热重分析过程各元素的化合价不变)。
①加热到
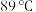 时,只失去结晶水且失去的结晶水刚好占整个结晶水的
时,只失去结晶水且失去的结晶水刚好占整个结晶水的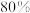 ,则
,则
 保留整数
保留整数 。
。②称取
 样品与足量NaOH充分反应,生成
样品与足量NaOH充分反应,生成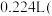 标准状况下
标准状况下 。则
。则
③结合①、②的计算结果和图中数据确定氧矾(Ⅳ)碱式碳酸铵的化学式(写出计算过程)。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】一定量氢气在氯气中燃烧,所得混合物用100 mL3. 00 mol/L的NaOH溶液恰好完全吸收,检测到反应后溶液中有NaCl、NaClO和NaClO3。测得溶液中含有NaCl的物质的量0.250 mol,NaClO的物质的量为0.0300 mol。
(1)所得溶液中NaClO3的物质的量为_______ 。
(2)所得混合物中氯气与NaOH溶液反应的总离子方程式_______ 。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =_______ 。
(1)所得溶液中NaClO3的物质的量为
(2)所得混合物中氯气与NaOH溶液反应的总离子方程式
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2) : n(H2) =
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐1】移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】为探究化合物A(仅含三种元素,摩尔质量为198g/mol)的组成与性质,设计并完成以下实验:取3.96g化合物A溶于水中,一段时间后全部转化为B(红褐色沉淀)、C(一种碱)和气体单质D(可使带火星的木条复燃),向溶液中加入100mL0.6mol/L稀硫酸,再加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将沉淀洗涤后充分灼烧,得到红棕色固体粉末1.60g;将所得溶液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)化合物A所含的元素为____ ,化合物A与H2O反应的离子方程式为:____ 。
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:____ 。
(1)化合物A所含的元素为
(2)化合物A可由FeCl3和KClO在强碱性条件下制得,其反应的离子方程式为:
您最近一年使用:0次
【推荐3】按要求完成下列填空:
(1)由CH4和O2组成的混合气体在标准状况下的密度为l g·L-1,则该混合气体中CH4和O2的体积比为________ 。
(2)用98%(密度为1.84g/mL )的浓硫酸配制500mL 2.5mol/L的稀硫酸,需用量筒量取浓硫酸的体积为________ mL。
(3)向100mL 0.2mol/L 的NaAlO2溶液与300mL 0.1mol/L的HCl溶液混合,反应的离子方程式:_________________ 。
(4)某混合溶液中仅含有离子:Fe2+、Cl-、Br-、I-,测得Cl-、Br-、I-的物质的量之比为2:3:4,往溶液中通入一定量的氯气,充分反应后溶液中Cl-和Br-的物质的量之比为3:1,则通入的氯气的物质的量与溶液中剩余Fe2+的物质的量之比为=_________________ 。(假设溶液的体积在反应前后不变)
(5)酸性条件下,向FeI2的淀粉溶液中加入H2O2溶液后变蓝。当有1mol Fe2+被氧化成Fe3+时,转移电子4mol。写出该反应的离子方程式:_________ 。
(1)由CH4和O2组成的混合气体在标准状况下的密度为l g·L-1,则该混合气体中CH4和O2的体积比为
(2)用98%(密度为1.84g/mL )的浓硫酸配制500mL 2.5mol/L的稀硫酸,需用量筒量取浓硫酸的体积为
(3)向100mL 0.2mol/L 的NaAlO2溶液与300mL 0.1mol/L的HCl溶液混合,反应的离子方程式:
(4)某混合溶液中仅含有离子:Fe2+、Cl-、Br-、I-,测得Cl-、Br-、I-的物质的量之比为2:3:4,往溶液中通入一定量的氯气,充分反应后溶液中Cl-和Br-的物质的量之比为3:1,则通入的氯气的物质的量与溶液中剩余Fe2+的物质的量之比为=
(5)酸性条件下,向FeI2的淀粉溶液中加入H2O2溶液后变蓝。当有1mol Fe2+被氧化成Fe3+时,转移电子4mol。写出该反应的离子方程式:
您最近一年使用:0次
【推荐1】亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的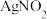 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____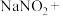 ___
___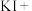 ___=___
___=___ ___
___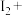 ___
___ ___
___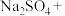 ___
___ 。
。
(1)请完成该离子方程式并配平___________ 。
(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理 开不是最佳方法,其原因是
开不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ 填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列:___________ (填序号)反应中 表现出的性质相同。
表现出的性质相同。
A.
B.
C.
(6) 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:___________ 。
____ _____
_____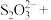 _____
_____ ____
____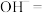 ____
____ ______
______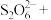 _____
_____
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性,能与
,其水溶液呈碱性,能与 溶液反应生成难溶于水、易溶于酸的
溶液反应生成难溶于水、易溶于酸的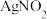 。由于
。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:____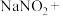 ___
___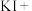 ___=___
___=___ ___
___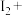 ___
___ ___
___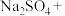 ___
___ 。
。(1)请完成该离子方程式并配平
(2)从物质分类角度来看,
 是
是a.酸 b.酸式盐 c.碱 d.非电解质 e.电解质 f.钠盐
(3)用上述反应来处理
 开不是最佳方法,其原因是
开不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是___________(填序号)
和NaCl的是___________(填序号)| A.分别溶于水,滴加酚酞试液 | B.分别溶于水并滴加 酸化的 酸化的 溶液 溶液 |
| C.分别加强热并收集气体检验 | D.用筷子分别蘸取固体品尝味道 |
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 车转化为
车转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列:
表现出的性质与下列: 表现出的性质相同。
表现出的性质相同。A.

B.

C.

(6)
 可以与
可以与 反应制备
反应制备 纳米颗粒。若
纳米颗粒。若 与
与 的系数之比为1∶2,配平该反应的离子方程式:
的系数之比为1∶2,配平该反应的离子方程式:____
 _____
_____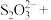 _____
_____ ____
____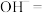 ____
____ ______
______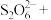 _____
_____
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是___________________ (填化学式),被2molFeSO4还原的过氧化钠为_________ mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是____________ ,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为_____________ (用含a、b的代数式表示)。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是
(2)若向含amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Fe2+被氧化时,c为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】按要求填空:
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4 +4H+
+4H+

(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:___________ 。
②反应Ⅱ:___________ 。
(2)NO在总反应中的作用是___________ 。
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:___________ 。
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:___________ 。
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是___________ 。
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是___________ 。
情境一:在酸性条件下,黄铁矿(FeS2,其中S为-1价)催化氧化的反应转化如图所示。
总反应:2FeS2+7O2+2H2O=2Fe2++4
 +4H+
+4H+
(1)已知Ⅲ为非氧化还原反应,分别写出反应Ⅰ、Ⅱ的离子方程式:
①反应Ⅰ:
②反应Ⅱ:
(2)NO在总反应中的作用是
情境二:高纯度LiMn2O4(Li元素的化合价为+1价,O元素的化合价为-2价)是锂电池重要的正极材料。
(3)工业上有一种制取高纯度LiMn2O4的方法如下:
①由硫酸锰与K2S2O8溶液常温下混合一周,慢慢得到球形二氧化锰(MnO2)、硫酸钾和硫酸,发生反应的化学方程式为:
②过滤、干燥得到球形二氧化锰,再与氢氧化锂750℃共热5小时得到LiMn2O4、H2O和一种气体。请写出该反应的化学方程式:
(4)氢氧化锂容易与二氧化碳反应,工业上常用碳酸锂代替。把分析纯碳酸锂与球形二氧化锰两种粉末,按个数比1:4混合均匀加热。
①升温到515℃时,开始有CO2产生,同时生成固体Li2O。
②升温到566℃时,MnO2分解产生O2,O2的个数恰好与CO2的个数相等,同时得到固体X,固体X的化学式是
③升温到720℃时,Li2O、X参加反应,固体质量逐渐增加,当质量不再增加时,得到高纯度的LiMn2O4.,该反应中氧化剂是
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐1】已知MnO2与浓盐酸反应的化学方程式为MnO2+ 4HCl(浓) MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:
(1)该反应的离子方程式为___________ 。
(2)被氧化的HCl占HCl总量的___________ 。
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为___________ (设NA为阿伏加德罗常数的值)。
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成___________ g沉淀。
 MnCl2+Cl2↑+2H2O,回答下列问题:
MnCl2+Cl2↑+2H2O,回答下列问题:(1)该反应的离子方程式为
(2)被氧化的HCl占HCl总量的
(3)当标准状况下有11.2 L氯气生成时,该反应转移的电子数为
(4)1.74 g MnO2与100 mL 12 mol·L-1的过量浓盐酸完全反应(假设HCl无挥发),在反应后的溶液中加入足量的AgNO3溶液,可生成
您最近一年使用:0次
计算题
|
较难
(0.4)
【推荐2】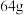 铜被一定浓度的硝酸完全溶解,产生的气体的体积为
铜被一定浓度的硝酸完全溶解,产生的气体的体积为 ,若将所得气体中混合
,若将所得气体中混合 ,则恰好能被水完全转化为硝酸;若将所得气体完全被氢氧化钠溶液吸收,会生成硝酸钠与亚硝酸钠(气体体积均在标准状况下测定),请回答:
,则恰好能被水完全转化为硝酸;若将所得气体完全被氢氧化钠溶液吸收,会生成硝酸钠与亚硝酸钠(气体体积均在标准状况下测定),请回答:
(1)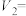
_____ L。
(2)亚硝酸钠的物质的量为______  。
。
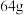 铜被一定浓度的硝酸完全溶解,产生的气体的体积为
铜被一定浓度的硝酸完全溶解,产生的气体的体积为 ,若将所得气体中混合
,若将所得气体中混合 ,则恰好能被水完全转化为硝酸;若将所得气体完全被氢氧化钠溶液吸收,会生成硝酸钠与亚硝酸钠(气体体积均在标准状况下测定),请回答:
,则恰好能被水完全转化为硝酸;若将所得气体完全被氢氧化钠溶液吸收,会生成硝酸钠与亚硝酸钠(气体体积均在标准状况下测定),请回答:(1)
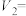
(2)亚硝酸钠的物质的量为
 。
。
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
解题方法
【推荐3】物质的量是高中化学常用的物理量,请完成以下问题:
(1)在9.5g某二价金属的氯化物中含有 ,该金属元素的相对原子质量为
,该金属元素的相对原子质量为_______ 。
(2)若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是_____ (设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(3)在80g密度为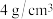 的硫酸铁溶液中,含有
的硫酸铁溶液中,含有 离子,则此溶液中
离子,则此溶液中 的物质的量浓度为
的物质的量浓度为________ 。
(4)实验室中需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,应选用容量瓶的规格是_____ ,用托盘天平称取 晶体的质量是
晶体的质量是_______ g。
(5)我国古代四大发明之一的黑火药,是由硫黄粉,硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为: (未配平),该反应的氧化剂是
(未配平),该反应的氧化剂是______ ,当有2mol气体生成时,反应转移的电子数为______ 。
(6) 是一种优良的饮用水消毒剂,高效低毒且具有很强的氧化性,已逐渐取代传统的净水消毒剂
是一种优良的饮用水消毒剂,高效低毒且具有很强的氧化性,已逐渐取代传统的净水消毒剂 ,这两种消毒剂使用时还原产物都是
,这两种消毒剂使用时还原产物都是 ,则
,则 的消毒效率(以单位质量得到电子的物质的量表示)是
的消毒效率(以单位质量得到电子的物质的量表示)是 的
的_______ 倍。(结果保留两位小数)
(1)在9.5g某二价金属的氯化物中含有
 ,该金属元素的相对原子质量为
,该金属元素的相对原子质量为(2)若ag某气体中含有的分子数为b,则c g该气体在标准状况下的体积是
 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。(3)在80g密度为
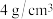 的硫酸铁溶液中,含有
的硫酸铁溶液中,含有 离子,则此溶液中
离子,则此溶液中 的物质的量浓度为
的物质的量浓度为(4)实验室中需要0.2mol/L的CuSO4溶液480mL,现配制该溶液,应选用容量瓶的规格是
 晶体的质量是
晶体的质量是(5)我国古代四大发明之一的黑火药,是由硫黄粉,硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:
 (未配平),该反应的氧化剂是
(未配平),该反应的氧化剂是(6)
 是一种优良的饮用水消毒剂,高效低毒且具有很强的氧化性,已逐渐取代传统的净水消毒剂
是一种优良的饮用水消毒剂,高效低毒且具有很强的氧化性,已逐渐取代传统的净水消毒剂 ,这两种消毒剂使用时还原产物都是
,这两种消毒剂使用时还原产物都是 ,则
,则 的消毒效率(以单位质量得到电子的物质的量表示)是
的消毒效率(以单位质量得到电子的物质的量表示)是 的
的
您最近一年使用:0次



