名校
解题方法
1 . 二氧化硫是最常见、最简单、有刺激性的硫氧化物,大气主要污染物之一,火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。SO2在生活、生产中有重要用途,使用不当会造成环境污染。
(1)某同学利用如图所示装置研究二氧化硫的性质。___________ ,加入药品前需要___________ 。
②实验开始前先通入一段时间N2,此操作的目的是___________ 。
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有___________ 性。
④装置c中的溶液___________ (填能或不能)用澄清石灰水替换,理由是___________ 。
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。___________ 。该空气中二氧化硫的体积分数为___________ 。
(1)某同学利用如图所示装置研究二氧化硫的性质。

②实验开始前先通入一段时间N2,此操作的目的是
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有
④装置c中的溶液
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。

您最近半年使用:0次
名校
解题方法
2 . V2O5(五氧化二钒)可作化学工业中的催化剂。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
②部分含钒物质常温下在水中的溶解性如表所示:
③ +2OH-
+2OH-
 +H2O
+H2O
回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为___________ 。
(2)在第Ⅱ步中需要加入氨水,请结合 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为___________ 。
(3)需在流动空气中加热NH4VO3的原因可能是___________ 。
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___________ (保留4位有效数字)。(已知:I2+2 Na2S2O3= Na2S4O6+2NaI,写出计算过程)

②部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 +2OH-
+2OH-
 +H2O
+H2O回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为
(2)在第Ⅱ步中需要加入氨水,请结合
 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为(3)需在流动空气中加热NH4VO3的原因可能是
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为
您最近半年使用:0次
解题方法
3 . 已知:将 通入适量的浓
通入适量的浓 溶液中,反应会放热,当温度升高后会发生如下反应:
溶液中,反应会放热,当温度升高后会发生如下反应: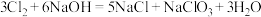 。则
。则 通入浓
通入浓 溶液的产物中可能有
溶液的产物中可能有 、
、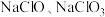 中的两种或三种,且
中的两种或三种,且 的值与温度高低有关。当参与反应的
的值与温度高低有关。当参与反应的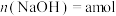 时,下列说法错误的是
时,下列说法错误的是
 通入适量的浓
通入适量的浓 溶液中,反应会放热,当温度升高后会发生如下反应:
溶液中,反应会放热,当温度升高后会发生如下反应: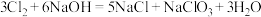 。则
。则 通入浓
通入浓 溶液的产物中可能有
溶液的产物中可能有 、
、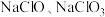 中的两种或三种,且
中的两种或三种,且 的值与温度高低有关。当参与反应的
的值与温度高低有关。当参与反应的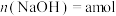 时,下列说法错误的是
时,下列说法错误的是A.与碱的反应中, 既是氧化剂又是还原剂 既是氧化剂又是还原剂 |
B.参加反应的 物质的量为 物质的量为 |
C.若某温度下,反应后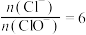 ,则溶液中 ,则溶液中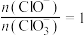 |
D.改变温度,反应中转移电子的物质的量可能为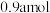 |
您最近半年使用:0次
名校
4 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含 、
、 、
、 )和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为氧化铅PbO,同时放出 ,该转化过程的化学方程式为
,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”步骤加入过氧化氢溶液发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因___________ 。
(6)处理含 的废水时,Cr(VI)被还原成Cr(Ⅲ)。若投入
的废水时,Cr(VI)被还原成Cr(Ⅲ)。若投入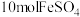 ,使金属阳离子恰好完全形成铁铬氧体(
,使金属阳离子恰好完全形成铁铬氧体( )沉淀,理论上还需要
)沉淀,理论上还需要 的物质的量为
的物质的量为___________ mol。
 、
、 、
、 )和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下: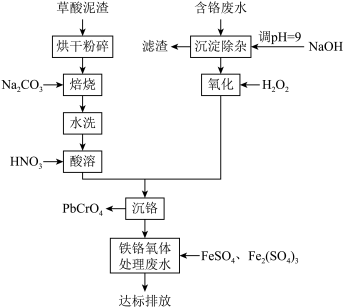

(1)草酸泥渣“粉碎”的目的是
 ,该转化过程的化学方程式为
,该转化过程的化学方程式为(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”步骤加入过氧化氢溶液发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因
(6)处理含
 的废水时,Cr(VI)被还原成Cr(Ⅲ)。若投入
的废水时,Cr(VI)被还原成Cr(Ⅲ)。若投入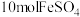 ,使金属阳离子恰好完全形成铁铬氧体(
,使金属阳离子恰好完全形成铁铬氧体( )沉淀,理论上还需要
)沉淀,理论上还需要 的物质的量为
的物质的量为
您最近半年使用:0次
昨日更新
|
109次组卷
|
2卷引用:东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
5 . 向10.95g铜铝混合物(除铜、铝外无其他物质)中加入2 稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
 稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是| A.V约为3.36 |
| B.混合物中铜与铝的物质的量之比为2∶1 |
| C.至少需要400mL稀硝酸 |
| D.滴加NaOH溶液的过程中,固体质量最大为18.2g |
您最近半年使用:0次
解题方法
6 . 已知某物质的XO(OH) 与Na2SO3反应时, XO(OH)
与Na2SO3反应时, XO(OH) 作氧化剂,Na2SO3被氧化为Na2SO4。经测得4分子XO(OH)
作氧化剂,Na2SO3被氧化为Na2SO4。经测得4分子XO(OH) 与2分子的Na2SO3恰好完全作用。试问XO(OH)
与2分子的Na2SO3恰好完全作用。试问XO(OH) 还原后X的最终价态是
还原后X的最终价态是
 与Na2SO3反应时, XO(OH)
与Na2SO3反应时, XO(OH) 作氧化剂,Na2SO3被氧化为Na2SO4。经测得4分子XO(OH)
作氧化剂,Na2SO3被氧化为Na2SO4。经测得4分子XO(OH) 与2分子的Na2SO3恰好完全作用。试问XO(OH)
与2分子的Na2SO3恰好完全作用。试问XO(OH) 还原后X的最终价态是
还原后X的最终价态是| A.+3 | B.+4 | C.+5 | D.0 |
您最近半年使用:0次
名校
7 . 二氧化碳、甲烷的捕集、转化与利用对环境和能源具有重要意义。
Ⅰ. 的捕集
的捕集
(1)地球上最高效的碳捕捉过程是绿色植物的______ ,该过程中能量的转化形式为______ 。
(2)用碱液吸收 。
。
①用足量NaOH溶液吸收 ,该过程中溶液的温度
,该过程中溶液的温度______ (填“上升”或“下降”)。
②若用100 mL 5 mol⋅L 的NaOH溶液吸收
的NaOH溶液吸收 后,测得吸收液中的
后,测得吸收液中的 ,则吸收的
,则吸收的 在标准状况下的体积为
在标准状况下的体积为______ L。
Ⅱ. 、
、 的转化
的转化
(3)在一定条件下,在催化剂表面将 转化为
转化为 ,其原理如图所示:
,其原理如图所示: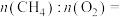
______ 。
Ⅲ. 、
、 的利用
的利用
(4)一种将 转化为合成气(
转化为合成气( 和CO)的原理如图所示:
和CO)的原理如图所示:____________ 。
②理论上,2.24 L (标准状况)通过以上两步反应最多可制得
(标准状况)通过以上两步反应最多可制得 的物质的量为
的物质的量为______ 。
(5)通过人工光合作用可实现对 的再利用,以
的再利用,以 和
和 为原料制备甲酸(HCOOH),工作原理如图所示:
为原料制备甲酸(HCOOH),工作原理如图所示: 的移动方向是左
的移动方向是左______ 右(填“→”或“←”)。
②电极b上的电极反应式为____________ 。
Ⅰ.
 的捕集
的捕集(1)地球上最高效的碳捕捉过程是绿色植物的
(2)用碱液吸收
 。
。①用足量NaOH溶液吸收
 ,该过程中溶液的温度
,该过程中溶液的温度②若用100 mL 5 mol⋅L
 的NaOH溶液吸收
的NaOH溶液吸收 后,测得吸收液中的
后,测得吸收液中的 ,则吸收的
,则吸收的 在标准状况下的体积为
在标准状况下的体积为Ⅱ.
 、
、 的转化
的转化(3)在一定条件下,在催化剂表面将
 转化为
转化为 ,其原理如图所示:
,其原理如图所示: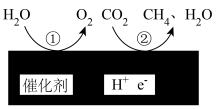
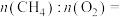
Ⅲ.
 、
、 的利用
的利用(4)一种将
 转化为合成气(
转化为合成气( 和CO)的原理如图所示:
和CO)的原理如图所示: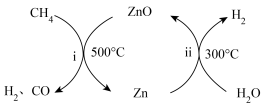
②理论上,2.24 L
 (标准状况)通过以上两步反应最多可制得
(标准状况)通过以上两步反应最多可制得 的物质的量为
的物质的量为(5)通过人工光合作用可实现对
 的再利用,以
的再利用,以 和
和 为原料制备甲酸(HCOOH),工作原理如图所示:
为原料制备甲酸(HCOOH),工作原理如图所示: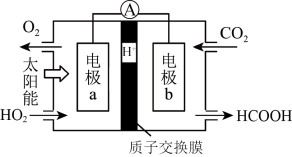
 的移动方向是左
的移动方向是左②电极b上的电极反应式为
您最近半年使用:0次
8 .  铜锌合金完全溶解于
铜锌合金完全溶解于 的浓硝酸(密度为
的浓硝酸(密度为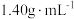 )中,得到
)中,得到 和
和 混合气体
混合气体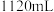 (换算为标准状况),(忽略反应前后溶液体积变化)。向反应后的溶液中逐滴加入
(换算为标准状况),(忽略反应前后溶液体积变化)。向反应后的溶液中逐滴加入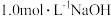 溶液,当金属离子刚好全部沉淀,得到
溶液,当金属离子刚好全部沉淀,得到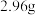 沉淀。下列说法正确的是
沉淀。下列说法正确的是
 铜锌合金完全溶解于
铜锌合金完全溶解于 的浓硝酸(密度为
的浓硝酸(密度为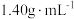 )中,得到
)中,得到 和
和 混合气体
混合气体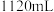 (换算为标准状况),(忽略反应前后溶液体积变化)。向反应后的溶液中逐滴加入
(换算为标准状况),(忽略反应前后溶液体积变化)。向反应后的溶液中逐滴加入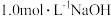 溶液,当金属离子刚好全部沉淀,得到
溶液,当金属离子刚好全部沉淀,得到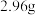 沉淀。下列说法正确的是
沉淀。下列说法正确的是A.该合金中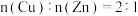 |
B.合金完全溶解时,溶液中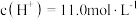 |
C. 和 和 的混合气体中, 的混合气体中, 的体积分数是 的体积分数是 |
D.刚好得到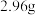 沉淀时,加入 沉淀时,加入 溶液的体积是 溶液的体积是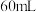 |
您最近半年使用:0次
名校
9 . 将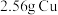 投入
投入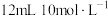 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入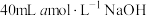 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与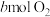 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成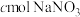 。下列判断正确的是
。下列判断正确的是
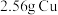 投入
投入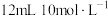 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入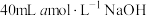 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与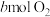 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成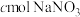 。下列判断正确的是
。下列判断正确的是| A.生成的气体中只有NO | B. |
C. | D.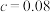 |
您最近半年使用:0次
名校
解题方法
10 . 为了测定镁铜合金的组成,将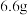 镁、铜合金加入
镁、铜合金加入 某浓度的稀硝酸中,将合金完全溶解后,共收集到
某浓度的稀硝酸中,将合金完全溶解后,共收集到 气体
气体 (标准状况下),并测得溶液中
(标准状况下),并测得溶液中 的浓度为
的浓度为 ,若反应前后溶液的体积变化忽略不计,则下列判断不正确的是
,若反应前后溶液的体积变化忽略不计,则下列判断不正确的是
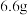 镁、铜合金加入
镁、铜合金加入 某浓度的稀硝酸中,将合金完全溶解后,共收集到
某浓度的稀硝酸中,将合金完全溶解后,共收集到 气体
气体 (标准状况下),并测得溶液中
(标准状况下),并测得溶液中 的浓度为
的浓度为 ,若反应前后溶液的体积变化忽略不计,则下列判断不正确的是
,若反应前后溶液的体积变化忽略不计,则下列判断不正确的是A.上述反应中金属共失去电子 |
B.合金中,铜的质量为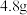 |
C.原硝酸的浓度: |
D.要使溶液中的金属离子完全沉淀,需加 的 的 溶液 溶液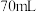 |
您最近半年使用:0次



