名校
解题方法
1 . 下列反应的离子方程式书写正确的是
A.碘化亚铁溶液中通入足量的氯气: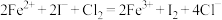 |
B.加碘盐与药物碘化钾片尽量不要同时服用: |
C.向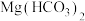 溶液中加入过量的NaOH溶液: 溶液中加入过量的NaOH溶液: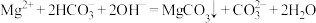 |
D.向 溶液中滴入 溶液中滴入 使 使 反应完全: 反应完全: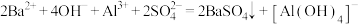 |
您最近半年使用:0次
今日更新
|
614次组卷
|
4卷引用:湖南省“一起考”大联考2023-2024学年高三下学期3月模拟考试(模拟一)化学试题
湖南省“一起考”大联考2023-2024学年高三下学期3月模拟考试(模拟一)化学试题江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷 (已下线)题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届江西省吉安市第一中学高三下学期一模化学试题
2 . 向10.95g铜铝混合物(除铜、铝外无其他物质)中加入2 稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
 稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是
稀硝酸,充分反应后固体完全溶解,收集到V L(已换算成标准状况下的体积)NO气体(无其他气体生成),继续向反应后的混合溶液中滴加NaOH溶液至过量,经过滤﹑洗涤、干燥,得到14.7g固体。下列说法正确的是| A.V约为3.36 |
| B.混合物中铜与铝的物质的量之比为2∶1 |
| C.至少需要400mL稀硝酸 |
| D.滴加NaOH溶液的过程中,固体质量最大为18.2g |
您最近半年使用:0次
名校
解题方法
3 . 用铁铝合金片制造的铁心,涡流损耗小,重量较轻,有良好的耐中子辐射性能。下列关于铁、铝两种元素的说法中错误的是
| A.Fe(OH)3和Al(OH)3都不溶于氨水 |
| B.常温下,浓硫酸可用铝制或者铁制容器贮存、运输 |
| C.控制发生条件,可将铁盐和铝盐转化为Fe(OH)3和Al(OH)3胶体 |
| D.两金属与稀硫酸反应,若消耗金属的物质的量相等,则产生气体的量一定相等 |
您最近半年使用:0次
4 . 根据下列实验操作和现象,所得结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向某溶液中加入CaCl2溶液 | 产生自色沉淀 | 白色沉淀是CaCO3 |
| B | 常温下将铝片分别插入稀硫酸和浓硫酸中 | 前者产生无色气体,后者无明显现象 | 稀硫酸的氧化性比浓硫酸强 |
| C | 取一定量某样品,溶解后加入足量的NaOH溶液 | 先产生白色沉淀,后沉淀消失 | 该样品中可能含有Al3+ |
| D | 将丁烷的裂解产物通入溴水中 | 溴水褪色 | 丁烷裂解只生成丙烯和甲烷 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
5 . 下列实验操作和现象与结论或目的对应错误的是
| 选项 | 操作和现象 | 结论或目的 |
| A | 用红色激光笔照射烧杯中的液体,在与光束垂直的方向观察到一条光亮的“通路” | 验证液体为胶体 |
| B | 将 分装在两支试管中,向一支试管中滴加足量盐酸,向另一支试管中滴加足量 分装在两支试管中,向一支试管中滴加足量盐酸,向另一支试管中滴加足量 溶液,边滴边振荡,最终沉淀消失 溶液,边滴边振荡,最终沉淀消失 | 验证 为两性氢氧化物 为两性氢氧化物 |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 将浓硫酸加入蔗糖中形成多孔炭并有刺激性气味 | 浓硫酸具有氧化性和脱水性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
6 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近半年使用:0次
名校
7 . 铝土矿的主要成分是 ,还有部分
,还有部分 、
、 ,以及少量不溶于酸碱溶液的其它杂质,工业上从铝土矿中提取铝可采取如下工艺流程:
,以及少量不溶于酸碱溶液的其它杂质,工业上从铝土矿中提取铝可采取如下工艺流程:
 ,还有部分
,还有部分 、
、 ,以及少量不溶于酸碱溶液的其它杂质,工业上从铝土矿中提取铝可采取如下工艺流程:
,以及少量不溶于酸碱溶液的其它杂质,工业上从铝土矿中提取铝可采取如下工艺流程: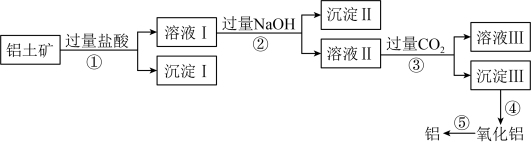
A.沉淀Ⅰ是 和 和 |
| B.①-⑤中,属于氧化还原反应的是⑤ |
C.溶液Ⅱ中含有的阴离子只有 |
D.生成沉淀Ⅲ的离子方程式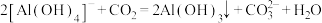 |
您最近半年使用:0次
解题方法
8 . 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是
| A.盐酸 | B.烧碱溶液 | C.氨水 | D.KSCN溶液 |
您最近半年使用:0次
名校
9 . 已知A、B、C、D、E、F、G、H是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和G分别为同一主族元素,B原子的最外层电子数比次外层多3,F的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,G的单质常出现在火山口。
(1)C在元素周期表中的位置是_______ 。
(2)C、D分别形成的简单离子中,半径较大的是______ (填离子符号)。
(3)G和H的最高价氧化物的水化物酸性较强的是______ (填化学式)。
(4)由A、C、D形成的化合物中化学键的类型为_______ ,C、D形成摩尔质量为 的化合物的电子式为
的化合物的电子式为______ ,由A、B形成 化合物的结构式为
化合物的结构式为______ 。
(5)甲烷可与 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式_______ 。
(6)D、F的最高价氧化物的水化物相互反应的离子方程式为_______ 。
(7)可用湿润的______ 试纸检验H对应单质,涉及反应的离子方程式为_______ 。
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:________ 。
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是______ (用含m、a、b的式子表示)。
(1)C在元素周期表中的位置是
(2)C、D分别形成的简单离子中,半径较大的是
(3)G和H的最高价氧化物的水化物酸性较强的是
(4)由A、C、D形成的化合物中化学键的类型为
 的化合物的电子式为
的化合物的电子式为 化合物的结构式为
化合物的结构式为(5)甲烷可与
 组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式
组成燃料电池,写出用KOH溶液作电解质溶液时正极的电极反应式(6)D、F的最高价氧化物的水化物相互反应的离子方程式为
(7)可用湿润的
(8)由B、H形成的化合物分子中,B和H原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:
(9)E与F形成的合金是重要的工业材料。某同学仅使用天平和下图所示的装置,粗略测定某些数据即可求出该合金中E元素的含量。(装置中因空气质量引起的误差忽略不计)实验需要测定三个物理量:合金的质量m,反应前装置和药品的总质量a以及反应后装置和药品的总质量b,合金中E元素的质量分数是
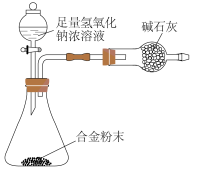
您最近半年使用:0次
7日内更新
|
95次组卷
|
2卷引用:福建省厦门双十中学2023-2024学年高一下学期4月月考化学试题
名校
10 . 表中是元素周期表的一部分,请参照元素①~③在表中的位置,回答下列问题:
(1)②与氢气化合产物的电子式是______________ 。
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为_____________ 。
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程____________ 。
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为____________ 。
(5)下列事实能判断①和②的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是__________ 。
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为_________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ |
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为
(5)下列事实能判断①和②的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为
您最近半年使用:0次



