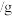1 . 下列说法中,正确的是
A. 的摩尔质量是 的摩尔质量是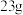 |
B.标准状况下, 的体积是 的体积是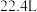 |
C.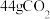 中含有的氧原子数约为 中含有的氧原子数约为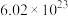 |
D.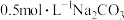 溶液中 溶液中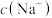 是 是 |
您最近半年使用:0次
2 . 利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2mol氨气的体积是___________ ,其中含有的NH3分子数是___________ (用NA来表示),含氢原子数是___________ (用NA来表示)。
(2)H2SO4的摩尔质量是___________ ,49g的H2SO4中含有___________ mol氧原子。
(3)将0.5mol Na2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是___________ 。
(1)标准状况下,0.2mol氨气的体积是
(2)H2SO4的摩尔质量是
(3)将0.5mol Na2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是
您最近半年使用:0次
解题方法
3 . 向一定量的饱和石灰水中加入少量CaO固体,恢复到原来温度时,下列说法正确的是
| A.溶液中的Ca2+总数不变 | B.溶液中OH-数目增加 |
| C.溶质的物质的量浓度不变 | D.溶液的质量不变 |
您最近半年使用:0次
解题方法
4 . 某水培植物的营养液中各离子的物质的量浓度如表所示(不考虑其他离子):
则x的值为
| 离子 |  |  |  |  |
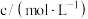 |  | 0.016 | 0.02 | 0.05 |
| A.0.014 | B.0.018 | C.0.054 | D.0.086 |
您最近半年使用:0次
5 . 请按照要求填写:
(1)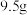 某二价金属氯化物
某二价金属氯化物 中含有
中含有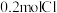 ,则
,则 的摩尔质量是
的摩尔质量是___________ 。
(2)除去镁粉中的铝粉,所选试剂为___________ ,相关的离子反应方程式为___________ 。
(3)配平离子方程式:___________ 。
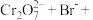 ___________=___________
___________=___________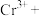 ___________
___________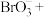 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂 的一种制备方法如下。
的一种制备方法如下。___________ ;
② 的结构式是
的结构式是___________ ;
③反应Ⅰ的离子方程式是___________ 。
(1)
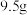 某二价金属氯化物
某二价金属氯化物 中含有
中含有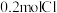 ,则
,则 的摩尔质量是
的摩尔质量是(2)除去镁粉中的铝粉,所选试剂为
(3)配平离子方程式:
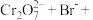 ___________=___________
___________=___________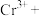 ___________
___________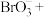 ___________
___________
(4)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂
 的一种制备方法如下。
的一种制备方法如下。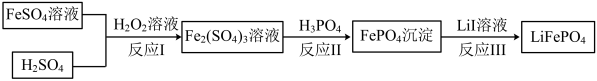
②
 的结构式是
的结构式是③反应Ⅰ的离子方程式是
您最近半年使用:0次
解题方法
6 . 用8.4g的NaHCO3固体配成100mL溶液,所得溶液的物质的量浓度是
| A.1.0mol·L-1 | B.2.0mol·L-1 | C.3.0mol·L-1 | D.4.0mol·L-1 |
您最近半年使用:0次
解题方法
7 . 如图是某学校实验室从化学试剂商店买回来的氢氧化钠试剂标签上的部分内容。某同学从该试剂瓶中取出24.0 g固体,配成1 L溶液,请计算:
(1)所得氢氧化钠溶液的物质的量浓度为___________ 。
(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入2.7 g的金属铝,产生的气体在标准状况下的体积为___________ 。(写出解答步骤)
| 氢氧化钠 化学纯(CP) 500 g 品名:氢氧化钠 化学式:NaOH 相对分子质量:40 |
(2)从所得氢氧化钠溶液中取出200 mL于一烧杯中,投入2.7 g的金属铝,产生的气体在标准状况下的体积为
您最近半年使用:0次
8 . 氯及其化合物的价类二维图如图,回答下列问题: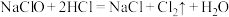 。写出反应①离子方程式
。写出反应①离子方程式___________ ;反应②中HCl体现的性质是___________ 。
(2)溶质质量分数为36.5%、密度为1.2g/cm3的浓盐酸中,盐酸的物质的量浓度为___________ mol/L,取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是___________ 。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)若用(2)中浓盐酸配制500 mL0.3mol/L稀盐酸。该学生需要用量筒量取___________ mL上述浓盐酸进行配制。完成此实验需用到的玻璃仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要___________ 。
(4)现将200 mL0.3 mol/L盐酸与300 mL0.4 mol/LCuCl2溶液混合,溶液体积变化忽略不计,所得溶液中Cl-的物质的量浓度是___________ mol/L。
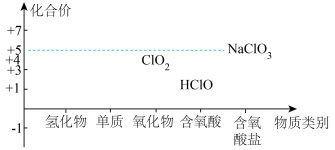
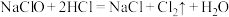 。写出反应①离子方程式
。写出反应①离子方程式(2)溶质质量分数为36.5%、密度为1.2g/cm3的浓盐酸中,盐酸的物质的量浓度为
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)若用(2)中浓盐酸配制500 mL0.3mol/L稀盐酸。该学生需要用量筒量取
(4)现将200 mL0.3 mol/L盐酸与300 mL0.4 mol/LCuCl2溶液混合,溶液体积变化忽略不计,所得溶液中Cl-的物质的量浓度是
您最近半年使用:0次
解题方法
9 . 将50mL0.6mol/L氯化钠溶液加水稀释到300mL,稀释后溶液中氯化钠的物质的量浓度为
| A.0.1mol/L | B.0.1mol | C.0.3mol/L | D.0.4mol/L |
您最近半年使用:0次
名校
解题方法
10 . 实验室利用以铜为电极电解稀 溶液的方法测定
溶液的方法测定 的值。
的值。
Ⅰ.电解液的配制:
(1)将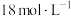
 溶液配制为
溶液配制为
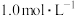
 溶液。
溶液。
①量取浓 时,适宜的量筒规格为
时,适宜的量筒规格为________ (填标号)。
A.10 mL B.25 mL C.50 mL D.100 mL
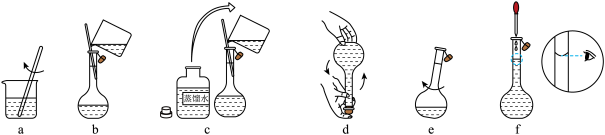
②配制溶液时,进行如下操作:
溶解→冷却→操作ⅰ→洗涤→注入一混匀→定容→操作ⅱ→装瓶贴标签
下图________ 、________ (填标号)所示操作依次为操作ⅰ、操作ⅱ。 值的测定:通过测定阳极铜片质量的变化量和通过电路的电量
值的测定:通过测定阳极铜片质量的变化量和通过电路的电量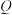 ,结合两者之间的关系进行计算(已知:一个电子的电量为
,结合两者之间的关系进行计算(已知:一个电子的电量为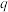 ,
, )。
)。
(2)在20℃、101 kPa下,电流为0.2 A,以精铜片为电极,电解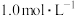
 溶液,10 min后关闭电源。观察和测量结果如下:
溶液,10 min后关闭电源。观察和测量结果如下:
a.阳极上有少量气泡产生,且铜片质量减少 ;
;
b.阴极上有大量气泡产生;
c.电解质溶液变蓝。
①为准确测量,电解前需将已除去油污的铜片________ ,并用蒸馏水洗净擦干后再称重。
②经检验,阳极上产生的气体为 ,电极反应为
,电极反应为________ ;该副反应的发生,可能导致 的测定值比其理论值
的测定值比其理论值________ (填“偏大”或“偏小”)。
(3)为避免阳极副反应的发生,探究实验条件的影响。
查阅资料:电解过程中,电解电压低将导致反应速率慢,电压高则易引发电极副反应。电流强度相同时,电压与电解质溶液的浓度成反比。
提出猜想:猜想ⅰ:电流强度越大,越容易引发电极副反应。
猜想ⅱ:硫酸浓度越低,越容易引发电极副反应。
进行实验:其他条件相同时,进行如下表实验,利用电流传感器测定通过电路的电量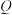 ,并测算3 min内阳极铜片质量的减少量。
,并测算3 min内阳极铜片质量的减少量。
①根据表中信息,补充数据:
________ ,
________ 。
②由实验2、3和4可知,猜想ⅰ成立,结合表中数据,给出判断理由:________ 。
③根据实验1~4相关数据,由实验________ (填实验编号)测算的 值误差最小。
值误差最小。
实验结论:
④根据最优实验条件的数据计算,
________  (已知:
(已知: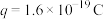 )。
)。
 溶液的方法测定
溶液的方法测定 的值。
的值。Ⅰ.电解液的配制:
(1)将
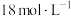
 溶液配制为
溶液配制为
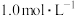
 溶液。
溶液。①量取浓
 时,适宜的量筒规格为
时,适宜的量筒规格为A.10 mL B.25 mL C.50 mL D.100 mL
②配制溶液时,进行如下操作:
溶解→冷却→操作ⅰ→洗涤→注入一混匀→定容→操作ⅱ→装瓶贴标签
下图
 值的测定:通过测定阳极铜片质量的变化量和通过电路的电量
值的测定:通过测定阳极铜片质量的变化量和通过电路的电量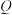 ,结合两者之间的关系进行计算(已知:一个电子的电量为
,结合两者之间的关系进行计算(已知:一个电子的电量为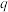 ,
, )。
)。(2)在20℃、101 kPa下,电流为0.2 A,以精铜片为电极,电解
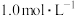
 溶液,10 min后关闭电源。观察和测量结果如下:
溶液,10 min后关闭电源。观察和测量结果如下:a.阳极上有少量气泡产生,且铜片质量减少
 ;
;b.阴极上有大量气泡产生;
c.电解质溶液变蓝。
①为准确测量,电解前需将已除去油污的铜片
②经检验,阳极上产生的气体为
 ,电极反应为
,电极反应为 的测定值比其理论值
的测定值比其理论值(3)为避免阳极副反应的发生,探究实验条件的影响。
查阅资料:电解过程中,电解电压低将导致反应速率慢,电压高则易引发电极副反应。电流强度相同时,电压与电解质溶液的浓度成反比。
提出猜想:猜想ⅰ:电流强度越大,越容易引发电极副反应。
猜想ⅱ:硫酸浓度越低,越容易引发电极副反应。
进行实验:其他条件相同时,进行如下表实验,利用电流传感器测定通过电路的电量
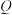 ,并测算3 min内阳极铜片质量的减少量。
,并测算3 min内阳极铜片质量的减少量。实验编号 | 理论电流
| 实测电量
|
溶液的体积 | 蒸馏水的体积 | 阳极铜片减少的质量 |
1 | 0.1 | 18.33 |
| 0 | 0.0060 |
2 | 0.1 | 18.34 | 20 | 180 | 0.0055 |
3 | 0.2 | 36.70 |
|
| 0.0095 |
4 | 0.3 | 55.02 | 20 | 180 | 0.0130 |


②由实验2、3和4可知,猜想ⅰ成立,结合表中数据,给出判断理由:
③根据实验1~4相关数据,由实验
 值误差最小。
值误差最小。实验结论:
④根据最优实验条件的数据计算,

 (已知:
(已知: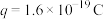 )。
)。
您最近半年使用:0次
2024-04-18更新
|
565次组卷
|
3卷引用:2024届广东省深圳市高三下学期一模考试化学试卷
2024届广东省深圳市高三下学期一模考试化学试卷(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)广东省潮州市饶平县第二中学2023-2024学年高二下学期第一次月考化学试题