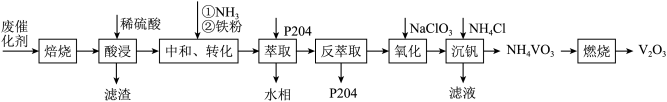
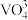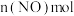1 . 某石油炼化厂废弃的 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
: 、
、 。
。
②不同pH下,五价钒在溶液中的主要存在形式见下表:
③萃取剂P204对 、
、 具有高选择性。
具有高选择性。
④25℃时,
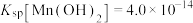


回答下列问题:
(1)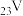 位于元素周期表的第
位于元素周期表的第__________ 周期、第__________ 族。
(2)“中和、转化”时,铁粉的作用除将 还原为
还原为 外,还有
外,还有__________ ;“氧化”时发生反应的离子方程式为______________________________ 。
(3)除萃取剂P204外,流程中可循环使用的物质还有____________________ 。
(4)“沉钒”时需加入过量 ,原因是
,原因是______________________________ ;25℃时,测得“氧化”后滤液中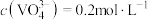 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为__________  。
。
(5)“萃取”后的水相经三道工序可回收 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整__________ 。(可供选用的试剂:铁粉、稀硫酸、 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
 催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的
催化剂主要含金属Ca、Fe、Mn及其氧化物。采用如下工艺流程回收其中的 :
:
 、
、 。
。②不同pH下,五价钒在溶液中的主要存在形式见下表:
| 4-6 | 6-8 | 8-10 | 10-12 |
主要离子 |
|
|
|
|
 、
、 具有高选择性。
具有高选择性。④25℃时,

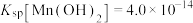


回答下列问题:
(1)
 位于元素周期表的第
位于元素周期表的第(2)“中和、转化”时,铁粉的作用除将
 还原为
还原为 外,还有
外,还有(3)除萃取剂P204外,流程中可循环使用的物质还有
(4)“沉钒”时需加入过量
 ,原因是
,原因是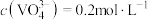 ,为使“沉钒”时,钒元素的沉降率达到
,为使“沉钒”时,钒元素的沉降率达到 ,应使溶液中
,应使溶液中 至少为
至少为 。
。(5)“萃取”后的水相经三道工序可回收
 溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整
溶液。常温下,若溶液中金属离子浓度相同,参照上述工艺流程,将以下工序补充完整 溶液、NaClO溶液、MnO、
溶液、NaClO溶液、MnO、 溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。
溶液;可供选择的操作工序:浸取、氧化、还原、调pH、浓缩)。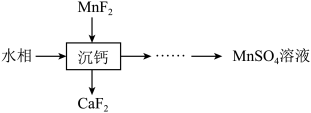
您最近一年使用:0次
2 . 工业上以磷矿石[主要成分: 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏( ),流程示意图如下:
),流程示意图如下:
回答下列问题:
(1)为提高酸浸速率,可采取的措施有_______ 。(写出1条即可)
(2)生成的HF与 反应,生成二元强酸
反应,生成二元强酸 的离子方程式是:
的离子方程式是:_______ 。
(3)酸浸时 与
与 反应的化学方程式是:
反应的化学方程式是:_______ 。
(4)粗磷酸中的有机碳被 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:_______ 。
(5)脱氟过程中发生的化学反应方程式是:_______ ,若按物质的量之比 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,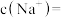
_______  ;
;
(6)脱硫过程中,分批加入一定量的 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是_______ 。
(7)该工艺中通常使用一定浓度的 溶液洗涤磷石膏(
溶液洗涤磷石膏(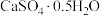 ),原因是
),原因是_____ 。
(8) 浓度(以
浓度(以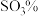 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和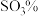 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现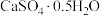 转化为
转化为 的是
的是_______ (填字母)。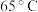 、
、 、
、
B. 、
、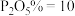 、
、
C.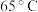 、
、 、
、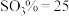
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液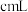 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是_______ 。
 、
、 、
、 和有机碳等]为原料生产磷酸和石膏(
和有机碳等]为原料生产磷酸和石膏( ),流程示意图如下:
),流程示意图如下:
| 物质 | 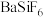 |  |  |  |  |
 |  |  |  | 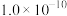 |  |
(1)为提高酸浸速率,可采取的措施有
(2)生成的HF与
 反应,生成二元强酸
反应,生成二元强酸 的离子方程式是:
的离子方程式是:(3)酸浸时
 与
与 反应的化学方程式是:
反应的化学方程式是:(4)粗磷酸中的有机碳被
 氧化为
氧化为 脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析
脱除。相同投料比、相同反应时间,不同温度下的有机碳脱除率如下表所示。分析 时有机碳脱除率最高的原因:
时有机碳脱除率最高的原因:温度 | 40 | 50 | 60 | 70 | 80 | 85 | 90 |
有机碳脱出率约为 | 72 | 75 | 78 | 80 | 82 | 78 | 75 |
 加入
加入 脱氟,充分反应后,
脱氟,充分反应后,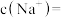
 ;
;(6)脱硫过程中,分批加入一定量的
 达到脱硫的目的,其反应离子方程式是
达到脱硫的目的,其反应离子方程式是(7)该工艺中通常使用一定浓度的
 溶液洗涤磷石膏(
溶液洗涤磷石膏(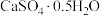 ),原因是
),原因是(8)
 浓度(以
浓度(以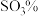 计)、
计)、 浓度(以
浓度(以 计)。一定温度下,石膏存在形式与溶液中
计)。一定温度下,石膏存在形式与溶液中 和
和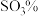 的关系如图所示,下列条件能实现
的关系如图所示,下列条件能实现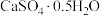 转化为
转化为 的是
的是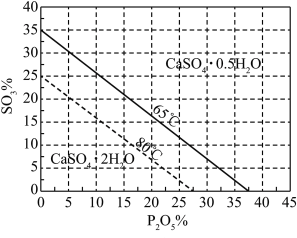
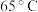 、
、 、
、
B.
 、
、 、
、
C.
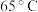 、
、 、
、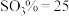
(9)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用
 溶液滴定至终点时生成
溶液滴定至终点时生成 ,消耗
,消耗 溶液
溶液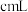 ,精制磷酸中
,精制磷酸中 的质量分数是
的质量分数是
您最近一年使用:0次
名校
3 . 镍及其化合物在工业生产中有重要的用途, (二氯六氨合镍)是一种重要的配合物,实验室以
(二氯六氨合镍)是一种重要的配合物,实验室以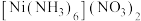 为原料制备
为原料制备 的装置如下:
的装置如下: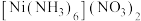 于装置c中,加入
于装置c中,加入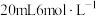 的
的 溶液至固体完全溶解,慢慢加入
溶液至固体完全溶解,慢慢加入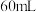 浓氨水和氯化铵的混合溶液,静置至沉淀完全。
浓氨水和氯化铵的混合溶液,静置至沉淀完全。
已知:①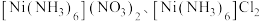 均为可溶于水、不溶于浓氨水和乙醇的蓝紫色水溶液均显碱性。
均为可溶于水、不溶于浓氨水和乙醇的蓝紫色水溶液均显碱性。
② 在热水中分解。
在热水中分解。
请回答:
(1)仪器a的名称为___________ ,装置c需置于冰水浴中的原因是___________ 。
(2) 可降低浓氨水的
可降低浓氨水的 ,利用平衡理论解释原因
,利用平衡理论解释原因___________ 。
(3)将装置c中的沉淀过滤,依次用___________ ,___________ 洗涤,室温真空干燥,即可获得纯净的蓝色晶体。
(4)实验室常用镍试剂检验 ,可观察到鲜红色沉淀。该沉淀的结构如图所示:
,可观察到鲜红色沉淀。该沉淀的结构如图所示:___________ ;
②该沉淀中不存在的作用力类型为___________ (填选项字母);
A.配位键 B.氢键 C.金属键 D. 键 E.
键 E. 键
键
③该沉淀中 的配位数为
的配位数为___________ 。
(5)为测定样品中氯的含量,称量 产品于锥形瓶中,用
产品于锥形瓶中,用 水溶解,加入稀硝酸至溶液呈弱酸性,滴入
水溶解,加入稀硝酸至溶液呈弱酸性,滴入 滴
滴 溶液作指示剂,用
溶液作指示剂,用 的
的 标准溶液滴定至终点,记录读数,重复操作
标准溶液滴定至终点,记录读数,重复操作 次,平均消耗
次,平均消耗 的体积为
的体积为 。计算该样品中氯的百分含量为
。计算该样品中氯的百分含量为___________ (保留三位有效数字)。
 (二氯六氨合镍)是一种重要的配合物,实验室以
(二氯六氨合镍)是一种重要的配合物,实验室以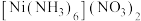 为原料制备
为原料制备 的装置如下:
的装置如下:
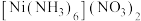 于装置c中,加入
于装置c中,加入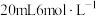 的
的 溶液至固体完全溶解,慢慢加入
溶液至固体完全溶解,慢慢加入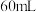 浓氨水和氯化铵的混合溶液,静置至沉淀完全。
浓氨水和氯化铵的混合溶液,静置至沉淀完全。已知:①
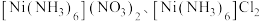 均为可溶于水、不溶于浓氨水和乙醇的蓝紫色水溶液均显碱性。
均为可溶于水、不溶于浓氨水和乙醇的蓝紫色水溶液均显碱性。②
 在热水中分解。
在热水中分解。请回答:
(1)仪器a的名称为
(2)
 可降低浓氨水的
可降低浓氨水的 ,利用平衡理论解释原因
,利用平衡理论解释原因(3)将装置c中的沉淀过滤,依次用
(4)实验室常用镍试剂检验
 ,可观察到鲜红色沉淀。该沉淀的结构如图所示:
,可观察到鲜红色沉淀。该沉淀的结构如图所示:
②该沉淀中不存在的作用力类型为
A.配位键 B.氢键 C.金属键 D.
 键 E.
键 E. 键
键③该沉淀中
 的配位数为
的配位数为(5)为测定样品中氯的含量,称量
 产品于锥形瓶中,用
产品于锥形瓶中,用 水溶解,加入稀硝酸至溶液呈弱酸性,滴入
水溶解,加入稀硝酸至溶液呈弱酸性,滴入 滴
滴 溶液作指示剂,用
溶液作指示剂,用 的
的 标准溶液滴定至终点,记录读数,重复操作
标准溶液滴定至终点,记录读数,重复操作 次,平均消耗
次,平均消耗 的体积为
的体积为 。计算该样品中氯的百分含量为
。计算该样品中氯的百分含量为
您最近一年使用:0次
名校
解题方法
4 . 尼龙、聚丙烯(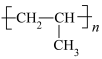 )、聚乙烯(
)、聚乙烯( )、聚异戊二烯(
)、聚异戊二烯(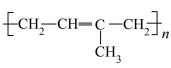 )均为有机高分子化合物。下列说法中正确的是
)均为有机高分子化合物。下列说法中正确的是
| A.尼龙属于天然有机高分子材料 | B.聚丙烯的链节为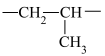 |
C.聚乙烯能使酸性 溶液褪色 溶液褪色 | D.聚异戊二烯的单体是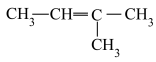 |
您最近一年使用:0次
名校
5 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。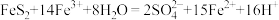 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为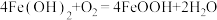 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。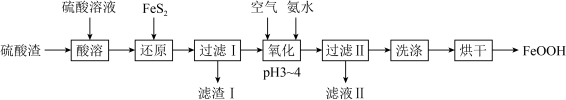
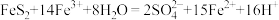 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
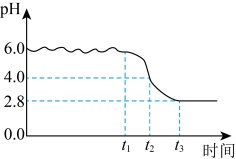
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为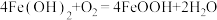 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
7日内更新
|
44次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
名校
6 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级 。用锆石
。用锆石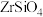 (含少量
(含少量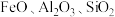 和
和 )制备纳米级
)制备纳米级 的流程设计如图:
的流程设计如图:
(1)在空气中焙烧 可以得到纳米
可以得到纳米 ,反应使用的主要陶瓷仪器是
,反应使用的主要陶瓷仪器是___________ 。
(2)锆石杂质中含铜、铁等元素, 与
与 的第二电离能分别为
的第二电离能分别为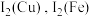 ,则
,则
___________ 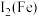 (填“>”或“<”),原因是
(填“>”或“<”),原因是___________ (从原子结构角度解释)。
(3)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(4)“酸浸”时,得到的溶质主要是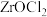 ,而不是预想中的
,而不是预想中的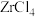 ,说明
,说明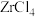 很容易水解,则
很容易水解,则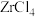 水解产生
水解产生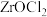 的化学方程式是
的化学方程式是___________ ,滤渣2的主要成分是___________ 。
(5) 的晶胞结构如图所示。
的晶胞结构如图所示。___________ (填 或
或 );
);
②假设 的密度为
的密度为 ,摩尔质量为
,摩尔质量为 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 和O原子的最短距离为
和O原子的最短距离为___________  (列出算式即可);
(列出算式即可);
③将该晶体沿体对角线的方向投影如图所示,请将 涂黑
涂黑___________ 。
 。用锆石
。用锆石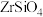 (含少量
(含少量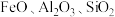 和
和 )制备纳米级
)制备纳米级 的流程设计如图:
的流程设计如图:
(1)在空气中焙烧
 可以得到纳米
可以得到纳米 ,反应使用的主要陶瓷仪器是
,反应使用的主要陶瓷仪器是(2)锆石杂质中含铜、铁等元素,
 与
与 的第二电离能分别为
的第二电离能分别为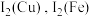 ,则
,则
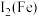 (填“>”或“<”),原因是
(填“>”或“<”),原因是(3)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(4)“酸浸”时,得到的溶质主要是
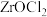 ,而不是预想中的
,而不是预想中的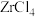 ,说明
,说明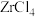 很容易水解,则
很容易水解,则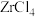 水解产生
水解产生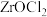 的化学方程式是
的化学方程式是(5)
 的晶胞结构如图所示。
的晶胞结构如图所示。
 或
或 );
);②假设
 的密度为
的密度为 ,摩尔质量为
,摩尔质量为 表示阿伏加德罗常数的值,则晶胞中
表示阿伏加德罗常数的值,则晶胞中 和O原子的最短距离为
和O原子的最短距离为 (列出算式即可);
(列出算式即可);③将该晶体沿体对角线的方向投影如图所示,请将
 涂黑
涂黑
您最近一年使用:0次
名校
7 . 下列说法不正确 的是
| A.天然气、沼气、煤层气的主要成分都是甲烷 |
| B.在测量水蒸气的相对分子质量时,其数值大于18,这与分子间的氢键有关 |
C. 露置于潮湿的空气中既有离子键和共价键的断裂,又有离子键和共价键的形成 露置于潮湿的空气中既有离子键和共价键的断裂,又有离子键和共价键的形成 |
D.在火山口地表的附近,硫化物会转化为盐,如石膏( )、芒硝( )、芒硝(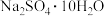 ) ) |
您最近一年使用:0次
名校
解题方法
8 . 道路千万条,安全第一条。当汽车在高速行驶中受到猛烈撞击时,会产生大量气体充满气囊,从而保护驾驶员和乘客的安全。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:______ (填“吸热”或“放热”)反应。
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为______ kJ(用含a、b的代数式表示)。
Ⅱ.汽车尾气中的 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应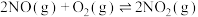 体系中,
体系中,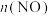 随时间的变化如表:
随时间的变化如表:
(3)下图表示 的变化的曲线是
的变化的曲线是______ ______ (选填序号,下同)。
a.容器内气体的颜色不再变化 b.
c. d.消耗
d.消耗 的同时生成
的同时生成
(5)为使该反应的反应速率增大,下列措施正确的是______ 。
a.增大 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体
Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示:______ 极(填写“正”或“负”),M处电极反应式是______ ;
(7)该电池产生11.2L(标况下) ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为______ 。
Ⅰ.安全气囊内叠氮化钠爆炸过程中的能量变化如图甲所示:
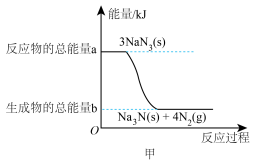
(2)若爆炸过程中有24mol非极性键生成(计算时将一对共用电子对作为一个化学键计量),则反应吸收(或释放)的能量为
Ⅱ.汽车尾气中的
 是常见的一种大气污染物,在2L密闭容器内,800℃时反应
是常见的一种大气污染物,在2L密闭容器内,800℃时反应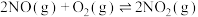 体系中,
体系中,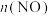 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(3)下图表示
 的变化的曲线是
的变化的曲线是 
a.容器内气体的颜色不再变化 b.

c.
 d.消耗
d.消耗 的同时生成
的同时生成
(5)为使该反应的反应速率增大,下列措施正确的是
a.增大
 的浓度 b.适当升高温度 c.及时分离出
的浓度 b.适当升高温度 c.及时分离出 气体
气体Ⅲ.化学能与其他能量间的转换在生活中处处可见,以反应
 为原理设计成利用率高的燃料电池,装置如图所示:
为原理设计成利用率高的燃料电池,装置如图所示: 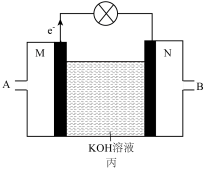
(7)该电池产生11.2L(标况下)
 ,则外电路中转移的电子数目为
,则外电路中转移的电子数目为
您最近一年使用:0次
名校
解题方法
9 . 某柔性屏手机的柔性电池以碳纳米管作电极材料,以吸收 溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为
溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为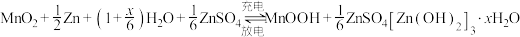 ,电池结构如图所示。
,电池结构如图所示。
(1)如图所示的几种含碳物质中,不与碳纳米管互为同素异形体的是___________ (填名称,下同),存在分子间作用力的是___________ ;属于共价晶体的是___________ 。 中
中 的化合价是
的化合价是_________ ,有机高聚物中C的杂化方式为__________ 。
(3) 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是___________ 。 的第二电离能
的第二电离能___________ (填“大于”或“小于”) 。
。
(4)一种新型稀磁半导体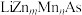 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。___________ ,n=___________ 。
②已知 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,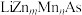 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为 。该晶体中
。该晶体中 原子与
原子与 原子之间的最短距离为
原子之间的最短距离为___________ nm(列出计算式)。
 溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为
溶液的有机高聚物(结构片段如图所示)作固态电解质,其电池总反应为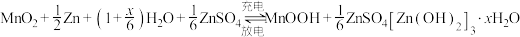 ,电池结构如图所示。
,电池结构如图所示。
(1)如图所示的几种含碳物质中,不与碳纳米管互为同素异形体的是

 中
中 的化合价是
的化合价是(3)
 键中离子键成分的百分数小于
键中离子键成分的百分数小于 键,原因是
键,原因是 的第二电离能
的第二电离能 。
。(4)一种新型稀磁半导体
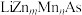 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。
②已知
 为阿伏加德罗常数的值,
为阿伏加德罗常数的值,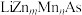 的摩尔质量为
的摩尔质量为 ,晶体密度为
,晶体密度为 。该晶体中
。该晶体中 原子与
原子与 原子之间的最短距离为
原子之间的最短距离为
您最近一年使用:0次
名校
解题方法
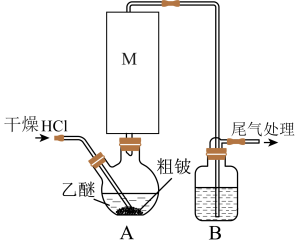
10 . 某实验小组以粗铍(含少量的Mg、Fe、Al、Cu、Si等)为原料制备、提纯BeCl2,并测定产品中BeCl2的含量。利用如图所示装置(夹持装置略)制BeCl2,实验开始前先通入一段时间的氩气。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④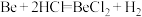 为放热反应。
为放热反应。
请回答下列问题:
(1)装置A中方框内的仪器M应为________ (填“直形冷凝管”或“球形冷凝管”),实验中装置A需置于温度15℃左右的水浴中,其主要目的是________ 。
(2)装置B中盛放的试剂为________ 。
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质________ ,再蒸馏滤液将乙醚蒸出得“固体”。为了除去“固体”中的其余杂质,可采取的操作为________ 。
(4)取 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: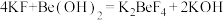 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为________ %(用含 、
、 和
和 的字母表示)。
的字母表示)。
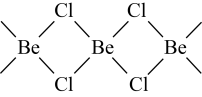
(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。____ 。
②BeCl2溶于乙醚,不溶于苯,易发生水解;
③AlCl3溶于乙醚且溶于苯,FeCl2、MgCl2不溶于乙醚和苯;
④
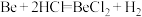 为放热反应。
为放热反应。请回答下列问题:
(1)装置A中方框内的仪器M应为
(2)装置B中盛放的试剂为
(3)反应后,装置A中BeCl2的乙醚溶液先经过滤除去杂质
(4)取
 g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用
g产品溶于盐酸配成100 mL溶液;每次取20.00 mL溶液,加入EDTA掩蔽杂质离子,调节pH,过滤、洗涤,得Be(OH)2固体,加入40 mL30% KF溶液溶解固体,滴加酚酞作指示剂,用 mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸
mol · L-1盐酸溶液滴定其中的KOH,重复三次平均消耗盐酸 mL(已知:
mL(已知: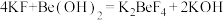 ;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为
;滴定过程中KF、K2BeF4不与盐酸反应),BeCl2的纯度为 、
、 和
和 的字母表示)。
的字母表示)。(5)氯化铍在气态时存在BeCl2分子(a)和二聚分子[(BeCl2)2](b),固态时则具有如下图所示的链状结构(c)。
您最近一年使用:0次