名校
解题方法
1 . 一定条件下,在密闭容器中利用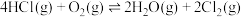 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是
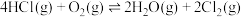 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是A.若断开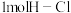 键的同时有 键的同时有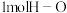 键断开,则表明该反应达到平衡状态 键断开,则表明该反应达到平衡状态 |
B.提高 ,该反应的平衡常数增大 ,该反应的平衡常数增大 |
C.使用催化剂,可以提高 的平衡转化率 的平衡转化率 |
D.该反应在一定条件下可自发进行,则该反应 |
您最近半年使用:0次
名校
2 . 习近平总书记在浙江湖州市安吉县考察时提出了一个科学论断“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。请回答下列问题:
(1)硫酸工业排出的尾气(主要含 )可用软锰矿浆(
)可用软锰矿浆( )吸收,写出如图所示“反应”的化学方程式为
)吸收,写出如图所示“反应”的化学方程式为________ 。 和CO的方法之一是在汽车的排气管上装一个催化转化装置,使
和CO的方法之一是在汽车的排气管上装一个催化转化装置,使 和CO在催化剂作用下转化为无毒物质,发生反应
和CO在催化剂作用下转化为无毒物质,发生反应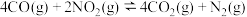 .一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和
.一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。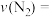
________ 。
②从11min起其他条件不变,压缩容器的容积变为1L,则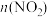 的变化曲线可能为图中的
的变化曲线可能为图中的________ (填字母)。
③恒温恒容条件下,不能说明该反应已经达到平衡状态的是________ (填标号)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
(3)利用反应 构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:________ (填“正极”或“负极”),发生________ (填“氧化反应”或“还原反应”),电极B上发生的电极反应为________ 。
(1)硫酸工业排出的尾气(主要含
 )可用软锰矿浆(
)可用软锰矿浆( )吸收,写出如图所示“反应”的化学方程式为
)吸收,写出如图所示“反应”的化学方程式为
 和CO的方法之一是在汽车的排气管上装一个催化转化装置,使
和CO的方法之一是在汽车的排气管上装一个催化转化装置,使 和CO在催化剂作用下转化为无毒物质,发生反应
和CO在催化剂作用下转化为无毒物质,发生反应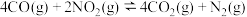 .一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和
.一定温度下,向容积固定的2L的密闭容器中充入一定量的CO和 ,
, 的物质的量随时间的变化曲线如图所示。
的物质的量随时间的变化曲线如图所示。
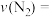
②从11min起其他条件不变,压缩容器的容积变为1L,则
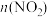 的变化曲线可能为图中的
的变化曲线可能为图中的③恒温恒容条件下,不能说明该反应已经达到平衡状态的是
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.容器内混合气体密度保持不变
D.容器内混合气体平均相对分子质量保持不变
(3)利用反应
 构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
构成原电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能,回答下列问题:
您最近半年使用:0次
名校
解题方法
3 . 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应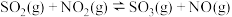 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④ ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
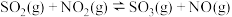 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为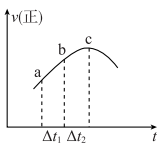
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④
 ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近半年使用:0次
名校
4 . 煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:
反应Ⅰ: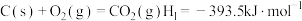
反应Ⅱ: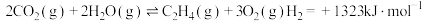
反应Ⅲ: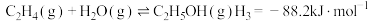
1.已知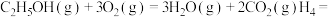
___________ 。
2.反应Ⅰ中属于共价化合物的电子式:___________ 。
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在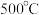 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
4.如图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线 表示的物质是
表示的物质是___________ ,原因是___________ 。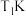 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和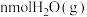 ,同时加入了
,同时加入了 和
和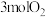 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
___________ (用含 的代数式表示)。
的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:反应Ⅰ:
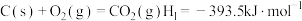
反应Ⅱ:
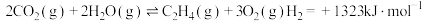
反应Ⅲ:
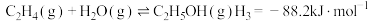
1.已知
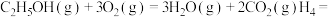
2.反应Ⅰ中属于共价化合物的电子式:
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在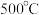 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
A. 的体积分数不再改变 的体积分数不再改变 | B.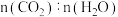 不再改变 不再改变 |
| C.容器的总压不再改变 | D.容器中气体的密度不再改变 |
 表示的物质是
表示的物质是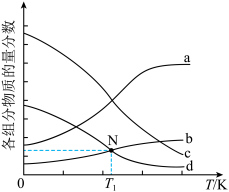
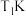 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和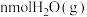 ,同时加入了
,同时加入了 和
和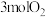 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
5 . “液态阳光”,即“清洁甲醇”,指生产过程中碳排放量极低或为零时制得的甲醇。 加氢的实际化学过程包括下面三个主要的平衡反应:
加氢的实际化学过程包括下面三个主要的平衡反应:
反应1:
反应2:
反应3:
(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是 (填标号)。
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是 (填标号)。
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
反应1中,每生成1mol  (g),会
(g),会________ (填“吸收”或“放出”)________ kJ能量。
(4)一定条件下,向1L密闭容器中加入1mol 和3mol
和3mol  发生上述三个反应,t s后达到平衡,容器中各物质浓度如表所示:
发生上述三个反应,t s后达到平衡,容器中各物质浓度如表所示:
①a=________ 。
②t s时, 的转化率为
的转化率为________ (保留三位有效数字)%。
③0~t s内,用CO表示的反应速率
________ 。
 加氢的实际化学过程包括下面三个主要的平衡反应:
加氢的实际化学过程包括下面三个主要的平衡反应:反应1:

反应2:

反应3:

(1)已知反应3的反应体系能量变化如图所示,下列说法正确的是 (填标号)。
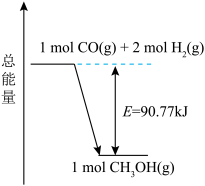
| A.该反应涉及极性键和非极性键的断裂和形成 |
B.若反应生成的 为液态,则放出的能量大于90.77kJ 为液态,则放出的能量大于90.77kJ |
C.1mol CO(g)和2mol  (g)的总键能低于1mol (g)的总键能低于1mol  (g)的总键能 (g)的总键能 |
D.1mol CO(g)和2mol  (g)在容器中充分反应,放出的能量为90.77kJ (g)在容器中充分反应,放出的能量为90.77kJ |
(2)恒容绝热密闭容器中进行反应2,下列说法表明反应达到了平衡的是 (填标号)。
| A.体系压强不再发生变化 |
B. 的转化率不再变化 的转化率不再变化 |
| C.混合气体的密度不再发生变化 |
| D.每断裂n mol的H—H键时,形成2n mol H—O键 |
(3)相关化学键的键能(常温常压下,断裂或形成1mol化学键需要吸收或放出的能量)数据如表所示:
化学键 | C=O( | H—H | C—H | C—O | H—O |
键能E/( | 803 | 436 | 414 | 326 | 464 |
 (g),会
(g),会(4)一定条件下,向1L密闭容器中加入1mol
 和3mol
和3mol  发生上述三个反应,t s后达到平衡,容器中各物质浓度如表所示:
发生上述三个反应,t s后达到平衡,容器中各物质浓度如表所示:物质 |
|
|
|
| CO |
浓度( | a | b | 0.48 | 0.8 | c |
②t s时,
 的转化率为
的转化率为③0~t s内,用CO表示的反应速率

您最近半年使用:0次
解题方法
6 . I.甲醇(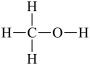 )是重要的化工原料,又可作为燃料。利用合成气(主要成分为
)是重要的化工原料,又可作为燃料。利用合成气(主要成分为 、
、 和
和 )在催化剂的作用下合成甲醇,涉及的反应有:
)在催化剂的作用下合成甲醇,涉及的反应有:
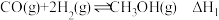
②

③
 与
与 反应生成
反应生成 和
和
已知反应①中的相关的化学键键能数据如下:(
 为
为 )
)| 化学键 |  |  |  |  |  |
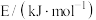 | 436 | 343 | 1076 | 465 | 413 |
(1)

 。
。(2)反应③的热化学方程式为
 用含
用含 和
和 的式子表示)
的式子表示)Ⅱ.亚硝酰氯(
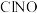 )是有机合成中的重要试剂,可通过反应:
)是有机合成中的重要试剂,可通过反应: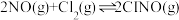 获得。
获得。(3)在恒温恒容的密闭容器中,氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
①
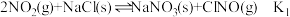
②

③

则

 、
、 的式子表示)。
的式子表示)。下列事实不能说明上述体系中反应③已达平衡状态的是
a.容器内气体的颜色不再变化 b.容器中气体的密度不再变化 c.
 不再发生变化
不再发生变化(4)300℃时,
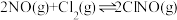 的正反应速率表达式为
的正反应速率表达式为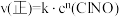 ,测得速率和浓度的关系如表所示:
,测得速率和浓度的关系如表所示:| 序号 | 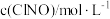 | 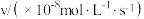 |
| ① | 0.30 | 0.36 |
| ② | 0.60 | 1.44 |
| ③ | 0.90 | 3.24 |
(5)对于反应③按投料比
 把
把 和
和 加入到压强恒为p的密闭容器中发生反应,平衡时
加入到压强恒为p的密闭容器中发生反应,平衡时 的转化率与温度T的关系如图所示:
的转化率与温度T的关系如图所示: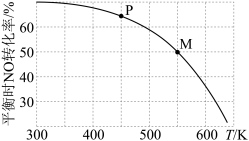
 的体积分数为
的体积分数为②M点的分压平衡常数

(6)一定条件下,在恒温恒容的密闭容器中按一定比例充入
 和
和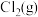 ,平衡时
,平衡时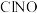 的体积分数随
的体积分数随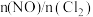 的变化图像如图所示,则A、B、C三状态中,
的变化图像如图所示,则A、B、C三状态中, 的转化率最大的是
的转化率最大的是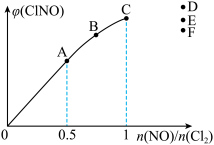
您最近半年使用:0次
名校
解题方法
7 . 可逆反应 ,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
①单位时间内生成n mol 的同时生成2n mol
的同时生成2n mol
②单位时间内生成n mol 的同时生成2n mol
的同时生成2n mol
③用 、
、 、
、 表示的反应速率的比为2∶2∶1的状态
表示的反应速率的比为2∶2∶1的状态
④各气体的浓度不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
 ,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是①单位时间内生成n mol
 的同时生成2n mol
的同时生成2n mol
②单位时间内生成n mol
 的同时生成2n mol
的同时生成2n mol
③用
 、
、 、
、 表示的反应速率的比为2∶2∶1的状态
表示的反应速率的比为2∶2∶1的状态④各气体的浓度不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①③④⑤ | B.②③⑤⑦ | C.①④⑥⑦ | D.①②③④⑤⑥⑦ |
您最近半年使用:0次
名校
8 . 下列说法正确的是
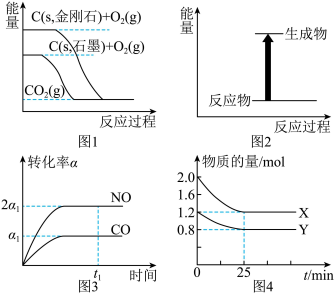
| A.由图1可知,金刚石比石墨稳定 |
| B.图2可表示碳酸氢钠和盐酸反应的能量变化 |
C.由图3可知,对于反应 ,当NO和CO转化率之比为2∶1时,可判断该反应已达到平衡状态 ,当NO和CO转化率之比为2∶1时,可判断该反应已达到平衡状态 |
D.由图4可知,对于反应 ,在0~25min内,用X表示的平均反应速率为0.032 ,在0~25min内,用X表示的平均反应速率为0.032 |
您最近半年使用:0次
9 . 乙烯是合成多种塑料的单体。我国科学家开发的特殊催化剂用 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。
主反应: 放热反应
放热反应
(1)在容积为2L的恒容密闭容器中充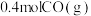 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内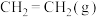 的平均反应速率为
的平均反应速率为___________ 。
(2)在一定温度下,向恒容密闭容器中充入 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是___________ (填编号)。
A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高 平衡转化率的措施是
平衡转化率的措施是___________ (任填一条)。
(3)下列事实中,不能用勒夏特列原理解释的是_______。
(4)下图表示反应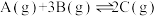 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。主反应:
 放热反应
放热反应(1)在容积为2L的恒容密闭容器中充
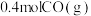 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内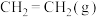 的平均反应速率为
的平均反应速率为(2)在一定温度下,向恒容密闭容器中充入
 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高
 平衡转化率的措施是
平衡转化率的措施是(3)下列事实中,不能用勒夏特列原理解释的是_______。
A.反应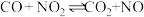 (放热反应),升高温度平衡向逆反应方向移动 (放热反应),升高温度平衡向逆反应方向移动 |
B.采用高压有利于合成氨反应: |
C.使用催化剂有利于合成氨反应: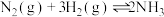 |
D.氯水中有下列平衡: ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
(4)下图表示反应
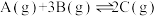 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。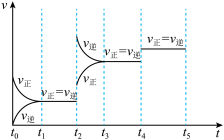
A. | B. | C. | D. |
您最近半年使用:0次
10 . Ⅰ肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:__________ 。
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是________ kJ。
Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_______ v逆 (CO2 )(填“>”“<”或“=”)。
(4)0~4min内,CO2的转化率为____________ ,CO的平均反应速率为_________________ 。
(5)下列选项能说明上述反应已达平衡状态的是_______(填字母)。
(6)燃料电池因具有发电效率高。环境污染少等优点而备受人们关注。用于笔记本电脑的甲醇(CH3OH)燃料电池示意图如下,d是_______ 极,此电极反应为_______ 。
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是
Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g)
 FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。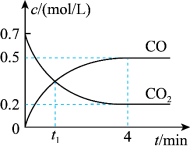
(4)0~4min内,CO2的转化率为
(5)下列选项能说明上述反应已达平衡状态的是_______(填字母)。
| A.v(CO2)=v(CO) |
| B.单位时间内生成n mol Fe的同时生成n mol FeO |
| C.容器中气体压强不随时间的变化而变化 |
| D.容器中CO2浓度不随时间的变化而变化 |

您最近半年使用:0次

 )
)

