1 . 大气中 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: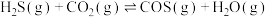 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。
(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
(2)在573K下,向2L恒容密闭容器中通入2mol 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。
①上述条件下 的平衡转化率
的平衡转化率
___________ %。
②在上述平衡体系中再加2mol 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向___________ 。
(3)在不同温度下,向密闭容器甲、乙中分别充入2mol 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。___________ 。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是___________ 。
 能通过高温下与
能通过高温下与 反应进行协同转化处理。反应原理为:
反应进行协同转化处理。反应原理为: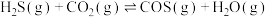 ,工业中测得的产物中有
,工业中测得的产物中有 、
、 、CO等副产物。
、CO等副产物。(1)一定温度下,在恒容密闭容器中发生以上反应,下列条件能判断反应达到平衡状态的是___________。
A.容器内 不再生成 不再生成 | B.容器内压强不再发生变化 |
| C.容器内气体密度不再发生变化 | D. |
(2)在573K下,向2L恒容密闭容器中通入2mol
 和1mol
和1mol  ,反应达到平衡后水蒸气的物质的量分数为0.2。
,反应达到平衡后水蒸气的物质的量分数为0.2。①上述条件下
 的平衡转化率
的平衡转化率
②在上述平衡体系中再加2mol
 和2mol
和2mol  ,通过数据说明平衡移动的方向
,通过数据说明平衡移动的方向(3)在不同温度下,向密闭容器甲、乙中分别充入2mol
 和1mol
和1mol  ,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的
,它们分别在有水分子筛(只允许水分子透过)和无水分子筛条件下反应,测得的 平衡转化率随温度变化关系如图所示。
平衡转化率随温度变化关系如图所示。
A.甲 B.乙 C.甲、乙中任一个
②1173K以后平衡转化率变化的原因可能是
您最近半年使用:0次
2 .  时,将
时,将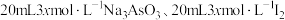 和
和 溶液混合,发生反应:
溶液混合,发生反应: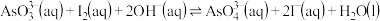 。溶液中
。溶液中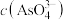 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
2.比较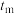 和
和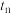 时的化学反应速率,其中
时的化学反应速率,其中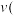 逆)较大的时刻为___________。
逆)较大的时刻为___________。
3.若平衡时溶液的 ,则该反应的平衡常数
,则该反应的平衡常数
___________ 。(用含 和
和 的代数式表示)
的代数式表示)
 时,将
时,将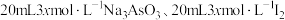 和
和 溶液混合,发生反应:
溶液混合,发生反应: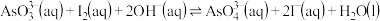 。溶液中
。溶液中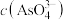 与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)
与反应时间(t)的关系如图所示。(忽略混合前后溶液体积的变化)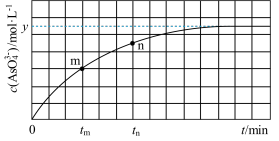
A.溶液的 不再变化 不再变化 | B.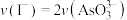 |
C.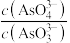 不再变化 不再变化 | D.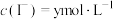 |
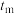 和
和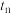 时的化学反应速率,其中
时的化学反应速率,其中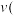 逆)较大的时刻为___________。
逆)较大的时刻为___________。A. | B.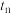 | C.两者相等 | D.无法比较 |
 ,则该反应的平衡常数
,则该反应的平衡常数
 和
和 的代数式表示)
的代数式表示)
您最近半年使用:0次
名校
3 . 已知:相关化学键的键能数据
回答下列问题:
1.合成氨反应

___________  。已知该反应的
。已知该反应的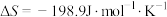 ,在下列温度下反应不能自发进行的是
,在下列温度下反应不能自发进行的是___________ 。
A.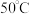 B.
B.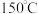 C.
C.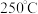
2.在合成氨过程中,需要不断分离出氨的原因为___________。
3.恒温恒容下进行的合成氨反应,以下说法中,一定能说明反应达到平衡状态的是___________。
4.针对反应速率与平衡产率的矛盾,我国科学家提出了双温—双控—双催化剂的解决方案。使用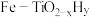 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为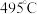 时,
时, 的温度为
的温度为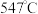 ,而
,而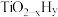 的温度为
的温度为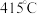 )。
)。
5.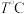 ,以
,以 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: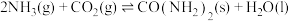 ;在
;在 的密闭容器中,通入
的密闭容器中,通入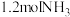 和
和
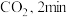 时反应刚好达到平衡。此时,
时反应刚好达到平衡。此时,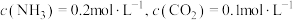 。
。
①写出该反应的平衡常数表达式___________ ;计算得 值为:
值为:___________ 。
②若 时保持
时保持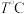 和平衡时容器的压强不变,再向体积可变的容器中充入
和平衡时容器的压强不变,再向体积可变的容器中充入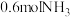 ,判断平衡移动的方向,并写出你的推理过程:
,判断平衡移动的方向,并写出你的推理过程:___________ 。
| 化学键 |  |  |  |
键能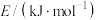 | 946 | 436.0 | 390.8 |
1.合成氨反应


 。已知该反应的
。已知该反应的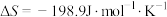 ,在下列温度下反应不能自发进行的是
,在下列温度下反应不能自发进行的是A.
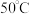 B.
B.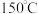 C.
C.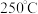
2.在合成氨过程中,需要不断分离出氨的原因为___________。
| A.有利于平衡正向移动 | B.防止催化剂中毒 |
| C.提高正反应速率 | D.提高逆反应速率 |
| A.混合气体密度不变 | B.混合气体的平均相对分子质量不变 |
C.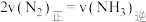 | D.化学平衡常数 不变 不变 |
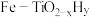 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为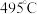 时,
时, 的温度为
的温度为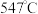 ,而
,而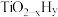 的温度为
的温度为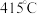 )。
)。
A.氨气在“冷 ”表面生成,有利于提高氨的平衡产率 ”表面生成,有利于提高氨的平衡产率 |
B. 在“热 在“热 ”表面断裂,有利于提高合成氨反应速率 ”表面断裂,有利于提高合成氨反应速率 |
C.“热 ”高于体系温度,有利于提高氨的平衡产率 ”高于体系温度,有利于提高氨的平衡产率 |
| D.“冷Ti”低于体系温度,有利于提高合成氨反应速率 |
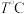 ,以
,以 和
和 为原料可合成化肥尿素:
为原料可合成化肥尿素: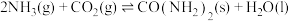 ;在
;在 的密闭容器中,通入
的密闭容器中,通入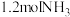 和
和
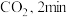 时反应刚好达到平衡。此时,
时反应刚好达到平衡。此时,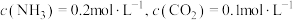 。
。①写出该反应的平衡常数表达式
 值为:
值为:②若
 时保持
时保持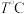 和平衡时容器的压强不变,再向体积可变的容器中充入
和平衡时容器的压强不变,再向体积可变的容器中充入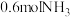 ,判断平衡移动的方向,并写出你的推理过程:
,判断平衡移动的方向,并写出你的推理过程:
您最近半年使用:0次
名校
4 . 甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。
已知, 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入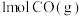 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。
(2)在 恒温密闭容器中充入
恒温密闭容器中充入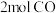 和
和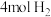 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
___________  。
。
(3)为了提高CO的转化率,可采取的措施是(写出两条):___________ 。
 ,再与
,再与 转化为甲醇,以实现碳中和。
转化为甲醇,以实现碳中和。已知,
 生产甲醇过程中涉及反应:
生产甲醇过程中涉及反应:
(1)向某恒温恒压密闭容器中充入
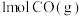 和
和 ,下列能说明反应达到平衡的是___________。
,下列能说明反应达到平衡的是___________。| A.混合气体的密度不再改变 | B.混合气体的平均相对分子质量不再改变 |
| C.两种反应物转化率的比值不再改变 | D.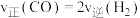 |
 恒温密闭容器中充入
恒温密闭容器中充入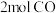 和
和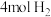 ,在一定条件下经
,在一定条件下经 ,
, 的物质的量为
的物质的量为 。在该条件下,
。在该条件下,
 。
。(3)为了提高CO的转化率,可采取的措施是(写出两条):
您最近半年使用:0次
名校
解题方法
5 . 一定温度下,在容积为 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示:
2.根据图上信息,从反应开始到第一次达到平衡状态时, 的平均反应速率为
的平均反应速率为___________ 。
3.在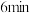 时,可能改变的条件是___________。
时,可能改变的条件是___________。
4.对于该反应,能否通过改变条件使 完全转化为
完全转化为 ?
?___________ (选填“能”或“不能”,原因是___________ 。
 的密闭容器内,通入一定量的
的密闭容器内,通入一定量的 和空气,在给定条件下发生反应生成
和空气,在给定条件下发生反应生成 的物质的量浓度变化如下图所示:
的物质的量浓度变化如下图所示: 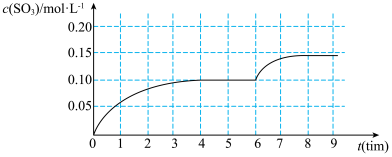
A. | B.压强不变 |
C. 浓度不再发生变化 浓度不再发生变化 | D.密度不变 |
 的平均反应速率为
的平均反应速率为3.在
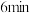 时,可能改变的条件是___________。
时,可能改变的条件是___________。| A.降低温度 | B.增加 浓度 浓度 | C.减小压强 | D.增加 浓度 浓度 |
 完全转化为
完全转化为 ?
?
您最近半年使用:0次
名校
6 . 尿素 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ: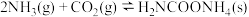 (氨基甲酸铵)
(氨基甲酸铵)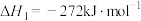
反应Ⅱ: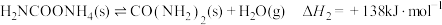
总反应Ⅲ: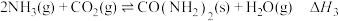
1. 的电子式为
的电子式为___________ ;
2.反应 的熵变
的熵变
___________  (填“>”“=”"或“<”),反应Ⅲ的
(填“>”“=”"或“<”),反应Ⅲ的
___________ 。
3.下列关于尿素合成的说法正确的是__________
研究反应I的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为 的密闭容器中,在
的密闭容器中,在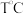 下分解:
下分解: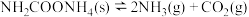 ,
, 时达到化学平衡。
时达到化学平衡。 随时间
随时间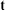 变化曲线如图所示。
变化曲线如图所示。
5.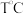 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为___________ 。
6.在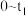 时间内该化学反应速率
时间内该化学反应速率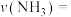
___________ 。
7.若其他条件不变, 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出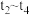 时间内
时间内 随时间
随时间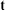 变化的曲线
变化的曲线___________ 。
 是一种重要的氮肥。工业上以
是一种重要的氮肥。工业上以 和
和 为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
为原料合成尿素,在尿素合成塔中的主要反应可表示如下:反应Ⅰ:
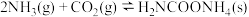 (氨基甲酸铵)
(氨基甲酸铵)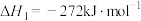
反应Ⅱ:
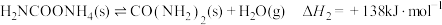
总反应Ⅲ:
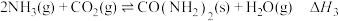
1.
 的电子式为
的电子式为2.反应
 的熵变
的熵变
 (填“>”“=”"或“<”),反应Ⅲ的
(填“>”“=”"或“<”),反应Ⅲ的
3.下列关于尿素合成的说法正确的是__________
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
D.保持压强不变,降低氨碳比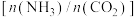 可提高反应 可提高反应 中 中 的平衡转化率 的平衡转化率 |
 的密闭容器中,在
的密闭容器中,在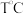 下分解:
下分解: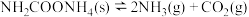 ,
, 时达到化学平衡。
时达到化学平衡。 随时间
随时间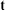 变化曲线如图所示。
变化曲线如图所示。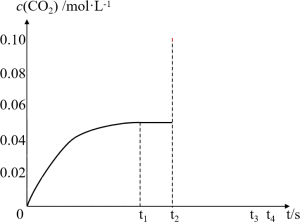
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
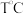 时,该反应的化学平衡常数
时,该反应的化学平衡常数 的值为
的值为6.在
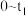 时间内该化学反应速率
时间内该化学反应速率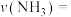
7.若其他条件不变,
 时将容器体积压缩到1L,
时将容器体积压缩到1L, 时达到新的平衡。请在图中画出
时达到新的平衡。请在图中画出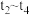 时间内
时间内 随时间
随时间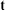 变化的曲线
变化的曲线
您最近半年使用:0次
名校
7 . 煤的间接液化是煤的综合利用的一种重要方法。首先是煤燃烧生成 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:
反应Ⅰ: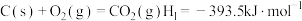
反应Ⅱ: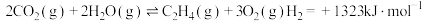
反应Ⅲ: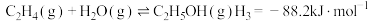
1.已知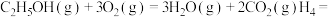
___________ 。
2.反应Ⅰ中属于共价化合物的电子式:___________ 。
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在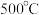 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
4.如图为四种组分的平衡时物质的量分数随温度的变化曲线。图中曲线 表示的物质是
表示的物质是___________ ,原因是___________ 。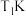 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和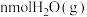 ,同时加入了
,同时加入了 和
和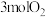 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
___________ (用含 的代数式表示)。
的代数式表示)。
 ,再在钼系催化剂的催化作用下与
,再在钼系催化剂的催化作用下与 反应,最终生成
反应,最终生成 过程中主要发生如下反应:
过程中主要发生如下反应:反应Ⅰ:
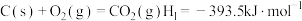
反应Ⅱ:
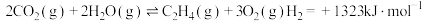
反应Ⅲ:
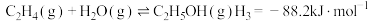
1.已知
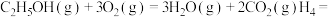
2.反应Ⅰ中属于共价化合物的电子式:
为更好地研究煤的液化过程,某学习小组对反应Ⅱ进行了系统的研究。在一个
 的恒容容器中加入
的恒容容器中加入 气体及
气体及 水蒸气,在
水蒸气,在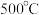 及钼系催化剂(固体)存在条件下只发生反应Ⅱ。
及钼系催化剂(固体)存在条件下只发生反应Ⅱ。3.下列不能说明该反应已达到平衡状态的有___________(填标号)。
A. 的体积分数不再改变 的体积分数不再改变 | B.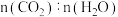 不再改变 不再改变 |
| C.容器的总压不再改变 | D.容器中气体的密度不再改变 |
 表示的物质是
表示的物质是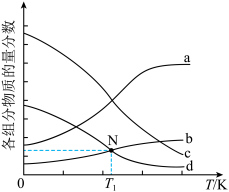
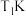 时,某同学在该容器中加入
时,某同学在该容器中加入 和
和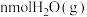 ,同时加入了
,同时加入了 和
和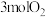 ,达到平衡后各组分体积分数仍与图中所示相同,则
,达到平衡后各组分体积分数仍与图中所示相同,则
 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
解题方法
8 . 甲醇是一种重要的基础化工原料,也是一种很有前景的燃料。利用工业废气中的CO2、CO与H2反应都可以制得甲醇。某温度下,在一恒容密闭容器中进行反应:CO(g)+2H2 (g) CH3OH(g) △H=−90.14kJ·mol−l
CH3OH(g) △H=−90.14kJ·mol−l
1.该反应平衡常数的表达式为_____ 。
2.若压强、投料比对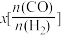 的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
3.若反应各物质起始浓度分别为c(CO)=1.0mol·L−l,c(H2)=2.4mol·L−l,5min后达到平衡,[CO]=0.5mol·L−l,则5min内H2的平均反应速率为_____ 。
4.若反应物的起始浓度分别为c(CO)=4.0mol·L−l,c(H2)=amol·L−l,达平衡后[CH3OH]=2.0mol·L−l,a=_____ 。
5.下列能说明该反应达到平衡状态的是
6.利用CO2和H2的混合气在催化剂M存在的条件下制甲醇的催化过程如图所示,反应物、产物均为气态物质。若生成1molCH3OH放出热量48.97kJ。写出其反应的热化学方程式:_____ 。 CO(g)+H2O(g),其△H=
CO(g)+H2O(g),其△H=_____ kJ·mol−l,则从化学反应的自发性角度分析,温度应控制在_____ (填“高温”或“低温”)下才有利于主反应进行。
 CH3OH(g) △H=−90.14kJ·mol−l
CH3OH(g) △H=−90.14kJ·mol−l1.该反应平衡常数的表达式为
2.若压强、投料比对
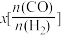 的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。
的百分含量的影响如图所示。则图中曲线所示的压强关系:p1_____p2。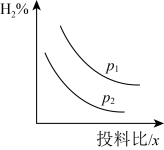
| A.> | B.< | C.= | D.无法确定 |
4.若反应物的起始浓度分别为c(CO)=4.0mol·L−l,c(H2)=amol·L−l,达平衡后[CH3OH]=2.0mol·L−l,a=
5.下列能说明该反应达到平衡状态的是
| A.容器内气体压强不再改变 |
| B.容器内气体密度不再改变 |
| C.c(H2)与c(CH3OH)的比值保持不变 |
| D.单位时间内有2molH2消耗的同时有1molCH3OH生成 |
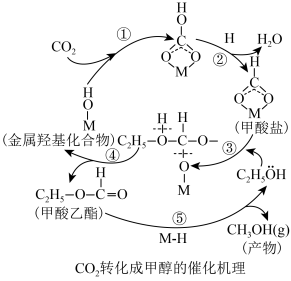
 CO(g)+H2O(g),其△H=
CO(g)+H2O(g),其△H=
您最近半年使用:0次
名校
解题方法
9 . 亚硝酰氯(NOCl)常用于合成洗涤剂、触媒,也可用作有机合成中间体。可通过反应
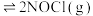 获得。
获得。
1.亚硝酰氯参与大气平流层和对流层化学,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①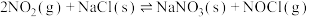

②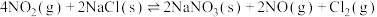

③

则
___________ (用 和
和 表示)。
表示)。
2.已知几种化学键的键能数据如表所示(NO的结构式:N≡O,亚硝酰氯的结构式:Cl—N=O):
则反应 的
的
___________  (用含a的代数式表示)。
(用含a的代数式表示)。
按投料比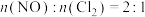 把NO和
把NO和 加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
___________ 0(填“>”“<”或“=”),理由是___________ 。
4.能标志该反应达到化学平衡状态的是___________。
5.计算图中M点处容器内NO的体积分数为___________ 。
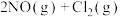
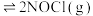 获得。
获得。1.亚硝酰氯参与大气平流层和对流层化学,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及以下反应:
①
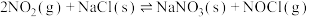

②
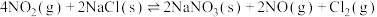

③


则

 和
和 表示)。
表示)。2.已知几种化学键的键能数据如表所示(NO的结构式:N≡O,亚硝酰氯的结构式:Cl—N=O):
| 化学键 | N≡O | Cl—Cl | Cl—N | N=O |
键能/ | 630 | 243 | a | 607 |
 的
的
 (用含a的代数式表示)。
(用含a的代数式表示)。按投料比
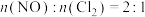 把NO和
把NO和 加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:
加入一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T的关系如图A所示:

4.能标志该反应达到化学平衡状态的是___________。
| A.容器内总压强不再变化 | B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 | D.NO与NOCl的体积分数相等 |
您最近半年使用:0次
10 . 乙烯是合成多种塑料的单体。我国科学家开发的特殊催化剂用 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。
主反应: 放热反应
放热反应
(1)在容积为2L的恒容密闭容器中充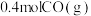 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内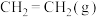 的平均反应速率为
的平均反应速率为___________ 。
(2)在一定温度下,向恒容密闭容器中充入 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是___________ (填编号)。
A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高 平衡转化率的措施是
平衡转化率的措施是___________ (任填一条)。
(3)下列事实中,不能用勒夏特列原理解释的是_______。
(4)下图表示反应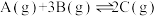 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
 制备
制备 ,有利于实现“双碳”目标。
,有利于实现“双碳”目标。主反应:
 放热反应
放热反应(1)在容积为2L的恒容密闭容器中充
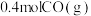 和
和 ,若只发生主反应,反应时间2.0min,
,若只发生主反应,反应时间2.0min, 的转化率为20%,在这段时间内
的转化率为20%,在这段时间内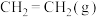 的平均反应速率为
的平均反应速率为(2)在一定温度下,向恒容密闭容器中充入
 和
和 ,若只发生主反应,下列情况不能说明反应达到平衡的是
,若只发生主反应,下列情况不能说明反应达到平衡的是A.混合气体总压强保持不变 B.混合气体密度保持不变
C.乙烯体积分数保持不变 D.平均摩尔质量保持不变
达到平衡后能提高
 平衡转化率的措施是
平衡转化率的措施是(3)下列事实中,不能用勒夏特列原理解释的是_______。
A.反应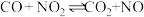 (放热反应),升高温度平衡向逆反应方向移动 (放热反应),升高温度平衡向逆反应方向移动 |
B.采用高压有利于合成氨反应: |
C.使用催化剂有利于合成氨反应: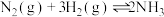 |
D.氯水中有下列平衡: ,当加入 ,当加入 溶液后溶液颜色变浅 溶液后溶液颜色变浅 |
(4)下图表示反应
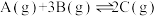 放热反应在某段时间
放热反应在某段时间 里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。
里的反应速率与反应过程的关系图,则C的百分含量最高的一段是_______。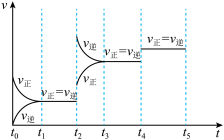
A. | B. | C. | D. |
您最近半年使用:0次



