名校
1 . 汽车尾气净化器中的主要反应: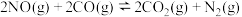 ,某科研小组在
,某科研小组在 密闭容器中充入
密闭容器中充入 和
和 ,对该反应进行了一系列的研究,在一定温度
,对该反应进行了一系列的研究,在一定温度 下,测得
下,测得 随时间
随时间 变化的曲线如图所示。
变化的曲线如图所示。
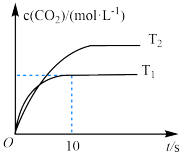
(1)该反应的
___________ 0(填“>”“<”或“=”)。下列选项中,能说明该反应达到平衡状态的依据是___________ 。
A. B.
B. 的浓度不再变化
的浓度不再变化
C.混合气体的平均相对分子质量不再改变 D.混合气体密度不变
(2)在温度为 时,若反应从开始到
时,若反应从开始到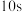 时
时 的平均反应速率
的平均反应速率 则
则
___________ ,此温度下平衡常数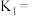
___________ ,平衡时,向此容器中再通入 和
和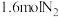 ,则平衡
,则平衡___________ (填“向正反应方向”“向逆反应方向”或“不”)移动,原因是___________ 。
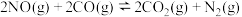 ,某科研小组在
,某科研小组在 密闭容器中充入
密闭容器中充入 和
和 ,对该反应进行了一系列的研究,在一定温度
,对该反应进行了一系列的研究,在一定温度 下,测得
下,测得 随时间
随时间 变化的曲线如图所示。
变化的曲线如图所示。
(1)该反应的

A.
 B.
B. 的浓度不再变化
的浓度不再变化C.混合气体的平均相对分子质量不再改变 D.混合气体密度不变
(2)在温度为
 时,若反应从开始到
时,若反应从开始到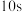 时
时 的平均反应速率
的平均反应速率 则
则
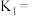
 和
和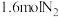 ,则平衡
,则平衡
您最近一年使用:0次
名校
解题方法
2 . 工业合成氨是氮的活化重要途径之一。
(1)在一定条件下,将 和
和 通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是______。
通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是______。
(2)下列关于合成氨工艺的理解,正确的是______。
(3)比较合成氨工业与接触法制硫酸中SO2催化氧化的生产过程,下列说法错误的是______。
(1)在一定条件下,将
 和
和 通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是______。
通入到体积为1L的恒容容器中,下列说法能说明该可逆反应达到平衡状态的是______。| A.容器中气体密度不变 | B.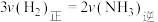 |
| C.容器中压强不变 | D. 、 、 、 、 分子数之比为1:3:2 分子数之比为1:3:2 |
| A.当温度、压强一定时,在原料气中添加少量惰性气体,有利于提高平衡转化率 |
| B.增大体系的压强能增大活化分子的百分数,从而加快反应速率 |
| C.合成氨反应选择在高温条件下进行时为了使平衡向正反应方向 |
| D.原料气须经过净化处理,以防止催化剂中毒和安全事故发生 |
| A.都使用了合适的催化剂 |
| B.都选择了较高的温度 |
| C.都采用了原料循环使用以提高原料利用率的方法 |
| D.都采用了高压的生产条件 |
您最近一年使用:0次
名校
解题方法
3 . 在一定温度的恒容仪器中,当下列物理量不在发生变化时,能说明NH2COONH4(s) 2NH3(g)+CO2(g)达到化学平衡状态的是
2NH3(g)+CO2(g)达到化学平衡状态的是
 2NH3(g)+CO2(g)达到化学平衡状态的是
2NH3(g)+CO2(g)达到化学平衡状态的是| A.NH3的体积分数不变 | B.混合气体的密度 |
| C.混合气体的平均相对分子质量 | D.反应物和生成物的浓度之比等于化学计量数之比 |
您最近一年使用:0次
2023-10-02更新
|
85次组卷
|
3卷引用:上海市嘉定区安亭高级中学2022-2023学年高二上学期期中考试化学试题
4 . 以煤炭为原料制备氢气是一种常用的方法,总反应为: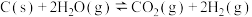 (正反应为吸热反应)
(正反应为吸热反应)
(1)上述反应中,反应物的总能量___________ 生成物的总能量。
A.大于 B.小于 C.等于
(2)下列措施中,能加快上述反应的反应速率的是___________。
(3)能说明上述反应一定达到化学平衡状态的是
(4)一定温度下,在2L密闭容器中加入足量的C(s)和3molH2O(g),反应至5min时,H2O(g)的物质的量变为1mol,0~5min内H2O(g)的平均反应速率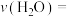
___________ 。
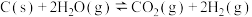 (正反应为吸热反应)
(正反应为吸热反应)(1)上述反应中,反应物的总能量
A.大于 B.小于 C.等于
(2)下列措施中,能加快上述反应的反应速率的是___________。
| A.将煤炭粉碎 | B.通入氦气 | C.降低温度 | D.加入催化剂 |
A. 保持不变 保持不变 | B.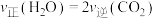 |
| C.物质的总质量不变 | D.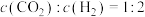 |
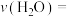
您最近一年使用:0次
名校
5 . 一种借助光将CO2转化为CH4的催化机理如图所示。
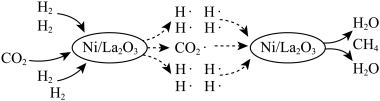
(1)该转化过程总反应的化学方程式是_______ ;图中所示的各物质中,含有极性共价键的非极性分子是_______ (填化学式)。
一定条件下,CO2和H2还可发生如下两个平行反应:
i. CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1
ii. CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H2=-49.5 kJ·mol-1
已知相关物质的总键能数据如表:
(2)则反应i的∆H1= _______ kJ·mol-1。
(3)为了提高CH3OH的产率,理论上应采用的措施是_______(填标号)。
(4)保持温度为533 K,压强为3 Mpa,按投料比 向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。
向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。
上述条件下,使用Cat.2催化剂,下列说法能判断反应ii达到平衡状态的是_______(填标号)。
(5)一定条件下,向0.5 L恒容密闭容器中充入1 mol CO2和 3 mol H2,只发生上述反应ii,达平衡时,H2的转化率为80%,则该温度下的平衡常数K= _______ (保留两位小数)。
(6)若恒容密闭容器中只发生上述反应i,在进气比 不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB
不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB _______ TC (填“<”,“>”,或“=”),其原因是_______ 。


(1)该转化过程总反应的化学方程式是
一定条件下,CO2和H2还可发生如下两个平行反应:
i. CO2(g)+H2(g)⇌CO(g)+H2O(g) ∆H1
ii. CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ∆H2=-49.5 kJ·mol-1
已知相关物质的总键能数据如表:
| 物质 | H2 | H2O | CO2 | CO |
| 键能(kJ·mol-1) | 436 | 928 | 1606 | 1072 |
(3)为了提高CH3OH的产率,理论上应采用的措施是_______(填标号)。
| A.低温低压 | B.高温低压 | C.高温高压 | D.低温高压 |
 向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。
向密闭容器中充入CO2和H2,反应相同时间测得不同催化剂下CO2转化率和CH3OH选择性的相关实验数据如下表所示(已知CH3OH选择性为转化的CO2中生成CH3OH的物质的量的百分比)。| 催化剂 | CO2转化率 | CH3OH选择性 |
| Cat.1 | 21.9% | 67.3% |
| Cat.2 | 36.1% | 100.0% |
| A.气体压强不再变化 | B.气体平均相对分子质量不再变化 |
| C.CH3OH和H2O的物质的量之比为1:1 | D.CO2和H2的物质的量之比不再变化 |
(6)若恒容密闭容器中只发生上述反应i,在进气比
 不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB
不同、温度不同时,测得相应的CO2平衡转化率如图所示。则B和C两点的温度TB 
您最近一年使用:0次
名校
6 . 一定温度下,向容积为2L的恒容密闭容器中加入等物质的量的 和
和 ,发生反应
,发生反应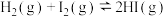
 。测得不同反应时间容器内
。测得不同反应时间容器内 物质的量如表:
物质的量如表:
(1)0~20min内 的平均反应速率为
的平均反应速率为_______ 。
(2)反应达化学平衡状态时, 的转化率为
的转化率为_______ ,容器内 的体积分数为
的体积分数为_______ 。
(3)该条件下,能说明上述反应达到化学平衡状态的是_______。
 和
和 ,发生反应
,发生反应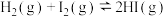
 。测得不同反应时间容器内
。测得不同反应时间容器内 物质的量如表:
物质的量如表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
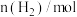 | 1 | 0.75 | 0.65 | 0.6 | 0.6 |
 的平均反应速率为
的平均反应速率为(2)反应达化学平衡状态时,
 的转化率为
的转化率为 的体积分数为
的体积分数为(3)该条件下,能说明上述反应达到化学平衡状态的是_______。
| A.混合气体颜色不再改变 | B.容器内压强不再改变 |
C. 、 、 、 、 三种气体体积分数不再改变 三种气体体积分数不再改变 | D.混合气体密度不再改变 |
您最近一年使用:0次
名校
7 . 一定条件下, 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:
①

②

(1)为了提高 的产率,理论上应采用的措施是___________(单选)。
的产率,理论上应采用的措施是___________(单选)。
(2)保持温度533K、压强3MPa,按投料比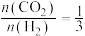 向容器中充入
向容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。
上述条件下,使用催化剂B作催化剂,下列说法能判断反应②达到平衡状态的是___________(单选)。
(3)一定条件下,向0.5L恒容密闭容器中充入 和
和 ,只发生上述反应②,达平衡时,
,只发生上述反应②,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
___________ (保留两位小数。)
(4)若恒容密闭容器中只发生上述反应①,在进气比 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
___________ 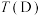 (填“<”、“>”或“=”),其原因是
(填“<”、“>”或“=”),其原因是___________ 。

 和
和 还可发生如下两个平行反应:
还可发生如下两个平行反应:①


②


(1)为了提高
 的产率,理论上应采用的措施是___________(单选)。
的产率,理论上应采用的措施是___________(单选)。| A.低温低压 | B.高温低压 | C.高温高压 | D.低温高压 |
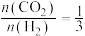 向容器中充入
向容器中充入 和
和 ,反应相同时间测得不同催化剂下
,反应相同时间测得不同催化剂下 转化率和
转化率和 选择性的相关实验数据如下表所示(已知
选择性的相关实验数据如下表所示(已知 选择性:转化的
选择性:转化的 中生成
中生成 的百分比)。
的百分比)。| 催化剂 |  转化率 转化率 |  选择性 选择性 |
| 催化剂A | 21.9% | 67.3% |
| 催化剂B | 36.1% | 100.0% |
| A.气体压强不再变化 | B.气体平均相对分子质量不再变化 |
C. 和 和 的物质的量之比为 的物质的量之比为 | D. 和 和 的物质的量之比不再变化 的物质的量之比不再变化 |
 和
和 ,只发生上述反应②,达平衡时,
,只发生上述反应②,达平衡时, 的转化率为80%,则该温度下的平衡常数
的转化率为80%,则该温度下的平衡常数
(4)若恒容密闭容器中只发生上述反应①,在进气比
 不同、温度不同时,测得相应的
不同、温度不同时,测得相应的 平衡转化率如图所示。则B和D两点的温度
平衡转化率如图所示。则B和D两点的温度
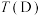 (填“<”、“>”或“=”),其原因是
(填“<”、“>”或“=”),其原因是
您最近一年使用:0次
名校
8 . 固氮的方式除了有天然固氮,还有人工固氮。合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食。
I.在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。



(1)写出以N2、H2O和C为原料合成NH3的反应热化学方程式_______ 。
(2)根据热化学方程式,说明碳化钙合成氨的方法的缺点_______ 。
Ⅱ.1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:

(3)关于该反应的△H与△S判断正确的是_______。
(4)将N2与H2以体积比1:3置于恒容密闭容器中发生上述反应,下列能说明反应达到平衡状态的是_______。
I.在Haber-Bosch工艺开发前,Frank于1908年开发了一种通过碳化钙合成氨的方法。



(1)写出以N2、H2O和C为原料合成NH3的反应热化学方程式
(2)根据热化学方程式,说明碳化钙合成氨的方法的缺点
Ⅱ.1913年,Haber-Bosch发明的催化合成氨技术实现了工业化生产:

(3)关于该反应的△H与△S判断正确的是_______。
| A.△H与△S均大于0 | B.△H与△S均小于0 |
| C.△H大于0,△S小于0 | D.△H小于0,△S大于0 |
| A.体系压强保持不变 |
| B.混合气体密度保持不变 |
| C.N2和H2的体积比保持不变 |
| D.混合气体的平均相对分子质量保持不变 |
您最近一年使用:0次
名校
9 . 下列标志可表明对应反应达到平衡状态的是
| 反应条件 | 可逆反应 | 标志 | |
| A | 恒温恒容 | 2SO2(g)+O2(g) 2SO3(g) 2SO3(g) | 混合气体的密度不变 |
| B | 恒温恒压 | NH2COONH4(s) 2NH3(g)+CO2(g) 2NH3(g)+CO2(g) | NH3在混合气体中的百分含量不变 |
| C | 恒温恒容 | H2(g)+I2(g) 2HI(g) 2HI(g) | QC(浓度商)不变 |
| D | 恒温恒压 | 2NO2(g) N2O4(g) N2O4(g) | c(NO2)=2c(N2O4) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-20更新
|
278次组卷
|
4卷引用:上海市华东师范大学第三附属中学2023-2024学年高二上学期第一次阶段检测(等级考)化学试题
名校
解题方法
10 . 化学平衡
Ⅰ.勒夏特列于1888年提出平衡移动原理,对现在大规模的化工生产具有重要的意义。
(1)可逆反应 达到化学平衡时,有关说法正确的是_________
达到化学平衡时,有关说法正确的是_________
(2)某化工生产反应历程的能量变化如图。过程I没有使用催化剂,过程II使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是_________

(3)下图是合成氨反应的正、逆反应速率随反应时间变化的示意图,有关叙述错误的是_________

(4)实验室研究大气固氮反应: 。下表是不同温度下该反应的平衡常数K的数值:
。下表是不同温度下该反应的平衡常数K的数值:
下列说法正确的是_________
Ⅱ.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
 ,已知该反应在240℃,平衡常数
,已知该反应在240℃,平衡常数 。
。
(5)N2、O2分子中化学键的键能分别是 、
、 ,则NO分子中化学键的键能为
,则NO分子中化学键的键能为___________ kJ/mol。
(6)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率v(NO)=___________ 。
(7)若反应是在恒温恒容条件下进行,判断该反应达到平衡的标志___________。
(8)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是___________ (单选)。
A. B.
B. C.
C.
(9)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数___________ (填“变大”、“变小”或“不变”)。
(10)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为 、
、 和
和 ,此时反应
,此时反应___________ (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”)。
Ⅰ.勒夏特列于1888年提出平衡移动原理,对现在大规模的化工生产具有重要的意义。
(1)可逆反应
 达到化学平衡时,有关说法正确的是_________
达到化学平衡时,有关说法正确的是_________| A.反应停止了 | B.体系中不存在 |
| C.红棕色消失 | D. 浓度不再改变 浓度不再改变 |

| A.生产效率 | B.反应的完成程度 |
| C.反应物的状态 | D.反应热效应 |

| A.状态Ⅰ和状态Ⅱ时,反应均处于平衡状态 |
| B.状态Ⅰ变化为状态Ⅱ的过程,称为化学平衡移动 |
| C.t1时刻平衡向正反应方向移动,平衡常数增大 |
| D.同一种反应物在状态Ⅰ和状态Ⅱ时,浓度不相等 |
 。下表是不同温度下该反应的平衡常数K的数值:
。下表是不同温度下该反应的平衡常数K的数值:| 温度/℃ | 25 | 2000 |
| K |  | 0.100 |
| A.上述反应是放热反应 | B.K值的大小与温度、压强均有关 |
| C.NO与H2O、O2反应生成铵态氮肥 | D.不宜以此方法大规模生产NO |
Ⅱ.汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:

 ,已知该反应在240℃,平衡常数
,已知该反应在240℃,平衡常数 。
。(5)N2、O2分子中化学键的键能分别是
 、
、 ,则NO分子中化学键的键能为
,则NO分子中化学键的键能为(6)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率v(NO)=
(7)若反应是在恒温恒容条件下进行,判断该反应达到平衡的标志___________。
| A.消耗1 mol N2同时生成1 mol O2 | B.混合气体密度不变 |
| C.平衡常数K保持不变 | D.2v正(N2) =v逆(NO) |
A.
 B.
B. C.
C.
(9)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态,与原平衡状态相比,此时平衡混合气中NO的体积分数
(10)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为
 、
、 和
和 ,此时反应
,此时反应
您最近一年使用:0次



