1 . 下列事实不能用勒夏特列原理解释的是
A.用排饱和食盐水法收集 |
| B.加压有利于合成氨反应 |
| C.冰镇的啤酒打开后泛起泡沫 |
D.对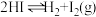 平衡体系缩小体积,增加压强使颜色变深 平衡体系缩小体积,增加压强使颜色变深 |
您最近半年使用:0次
名校
2 . 只改变一个影响因素,平衡常数 与化学平衡移动的关系叙述正确的是
与化学平衡移动的关系叙述正确的是
 与化学平衡移动的关系叙述正确的是
与化学平衡移动的关系叙述正确的是A. 变化,平衡可能不移动 变化,平衡可能不移动 | B. 变化,平衡一定移动 变化,平衡一定移动 |
C.平衡不移动, 可能变化 可能变化 | D.平衡移动, 一定变化 一定变化 |
您最近半年使用:0次
3 . 氮、碳化合物转化是环境科学研究热点课题之一。“双碳”目标大背景下,采取高效经济方式利用CO2对人类社会发展具有重要意义。
(1)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。_______ (用Ka、Kb、Kc表示)。
②表示C2H4体积分数随温度变化的曲线是_______ (填“k”“l”“m”“n”)。
③若d表示240℃时某时刻H2的体积分数,保持温度不变,则反应向_______ (填“正”或“逆”)反应方向进行。
(2)低碳烯烃是基础有机化工原料,工业上可利用合成气间接或直接制取。其间接制取的主要反应方程式如下:
CO(g)+2H2(g)⇌CH3OH(l) ΔH1=-116kJ·mol-1
2CH3OH(l)⇌C2H4(g)+2H2O(l) ΔH2=-35kJ·mol-1
H2O(g)⇌H2O(l) ΔH3=-44kJ·mol-1
①写出用CO(g)和H2(g)直接制取低碳烯烃C2H4(g)和H2O(g)的热化学方程式:_______ 。
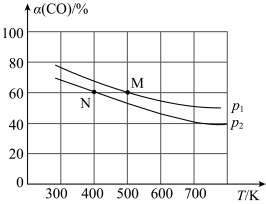
②将He、CO和H2以体积比为1∶1∶2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图所示,则p1_______ p2(填“>”“<”或“=”),M点的正反应速率_______ N点的逆反应速率(填“>”“<”或“=”)。在500K,压强为p1的条件下,该反应的Kp=_______ (列出计算式)。
(1)CO2催化加氢可合成乙烯,反应为2CO2(g)+6H2(g)⇌C2H4(g)+4H2O(g) ΔH<0,在恒压密闭容器中,起始充入2molCO2(g)和6molH2(g)发生反应,不同温度下达到平衡时各组分的体积分数随温度的变化如图所示。
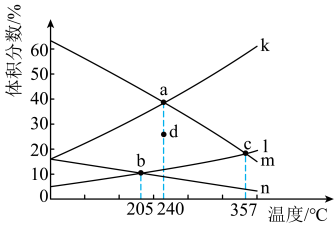
②表示C2H4体积分数随温度变化的曲线是
③若d表示240℃时某时刻H2的体积分数,保持温度不变,则反应向
(2)低碳烯烃是基础有机化工原料,工业上可利用合成气间接或直接制取。其间接制取的主要反应方程式如下:
CO(g)+2H2(g)⇌CH3OH(l) ΔH1=-116kJ·mol-1
2CH3OH(l)⇌C2H4(g)+2H2O(l) ΔH2=-35kJ·mol-1
H2O(g)⇌H2O(l) ΔH3=-44kJ·mol-1
①写出用CO(g)和H2(g)直接制取低碳烯烃C2H4(g)和H2O(g)的热化学方程式:
②将He、CO和H2以体积比为1∶1∶2充入密闭容器中直接制取乙烯,CO的平衡转化率与温度的关系如图所示,则p1
您最近半年使用:0次
4 . 完成下列问题。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式_______ 。
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈____ 色。
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈_______ 色。
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡_______ (填“向左移动”或“向右移动”),溶液颜色将_______ 。
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向_______ 反应方向移动,正反应为_______ (填“吸热”或“放热”)反应,平衡时B、C的浓度之比 将
将_______ 。(填“增大”“减小”或“不变”,下同)。
②减小压强时平衡向_______ 反应方向移动,A的质量分数_______ ,且m+n_______ p(填“>”或“<”)。
③若容积不变加入B,则B的转化率_______ ,A的转化率_______ 。
(1)K2Cr2O7是橙红色晶体,K2CrO4是黄色晶体,若将K2Cr2O7配成一定浓度的溶液,当达到平衡时,溶液的颜色在橙色和黄色之间,试回答:
①写出有关的离子方程式
②向盛有2mL的上述K2Cr2O7溶液的试管中滴入10滴2mol/L的NaOH溶液,试管中溶液呈
③向已加入NaOH溶液的②溶液中再加入过量稀H2SO4,则溶液呈
④向原溶液中逐渐加入足量Ba(NO3)2溶液(已知BaCrO4为黄色沉淀),则平衡
(2)现有反应:mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①升高温度时,平衡向
 将
将②减小压强时平衡向
③若容积不变加入B,则B的转化率
您最近半年使用:0次
名校
5 . 某温度下,利用CO2生产甲醇主要涉及以下两个反应。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g) CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为_______ ,在_______ 条件下反应I可自发发生。_______ 移动(填“正向”、“逆向”或“不”)。
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性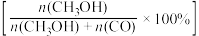 和CO的选择性
和CO的选择性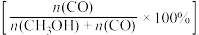 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是_______ (填“m”、“n”或“p”),A点时H2的转化率为_______ ,CH3OH的平衡分压为_______ MPa(保留两位有效数字)。 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp_______ (填“增大”、“减小”或“不变”)。根据速率方程分析,T>Tm时v逐渐减小的原因是_______ 。
反应I._______
反应Ⅱ.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=+41.2kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g)
 CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
CH3OH(g) ΔH3=–90.6kJ·mol-1。反应I的转化原理如图所示。该反应的热化学方程式为
(3)将1molCO2(g)和3molH2(g)充入密闭容器发生反应I和Ⅱ,并达到平衡状态。相同温度下,在不同压强下测得CO2的平衡转化率、CH3OH(g)的选择性
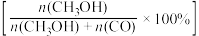 和CO的选择性
和CO的选择性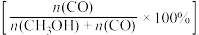 随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是
随压强变化曲线如图所示。图中表示CO2的平衡转化率的曲线是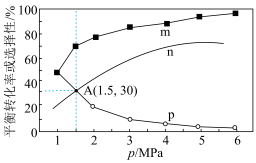
 ,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
,式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示各组分的物质的量分数。Kp为平衡常数,k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。温度升高时,CO催化变换反应的Kp
您最近半年使用:0次
名校
6 . 科学家研究出一种新的催化剂能有效处理汽车尾气,其反应的化学方程式为: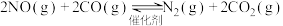
 ,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
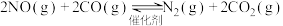
 ,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是
,若反应在恒容密闭容器中进行,由该反应相关图象作出的判断正确的是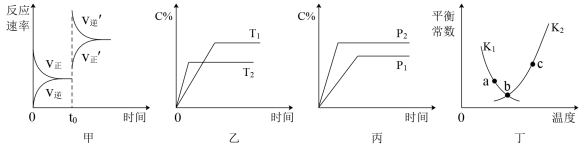
| A.甲图中改变的反应条件为升温 |
B.乙图中温度 ,纵坐标可代表NO的百分含量 ,纵坐标可代表NO的百分含量 |
C.丙图中压强 ,纵坐标可代表NO的体积分数 ,纵坐标可代表NO的体积分数 |
| D.丁图中a、b、c三点只有b点已经达到平衡状态 |
您最近半年使用:0次
7 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的
___________  ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________ (填标号)。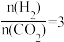 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为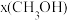 ,在
,在 ℃下的
℃下的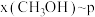 、在
、在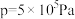 下的
下的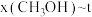 如图所示。
如图所示。
___________ ;
②图中对应等压过程的曲线是___________ ;
③当 时,
时, 的平衡转化率
的平衡转化率
___________ ,反应条件可能为___________ 或___________ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:

该反应一般认为通过如下步骤来实现:
①

②

总反应的

 ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是
;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是A. 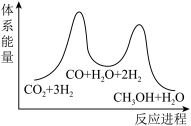 B.
B.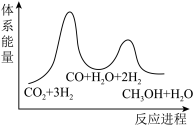
C. D.
D.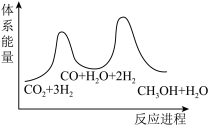
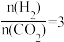 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为
时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为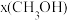 ,在
,在 ℃下的
℃下的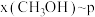 、在
、在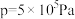 下的
下的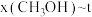 如图所示。
如图所示。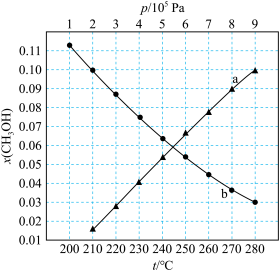

②图中对应等压过程的曲线是
③当
 时,
时, 的平衡转化率
的平衡转化率
您最近半年使用:0次
名校
8 . 氢能是一种绿色能源,研发新型制氢技术具有重要意义。
(1)甘油 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
反应I: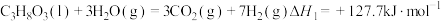
反应Ⅱ: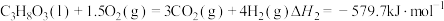
①
___________ 。
②除 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是___________ 。
(2)“表面改性铝粉分解水制氢”因 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。
①利用 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为___________ 。
② 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积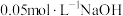 溶液和
溶液和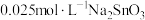 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是___________ 。 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为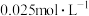 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是___________ 。 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用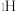 、
、 和
和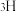 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为___________ ;步骤Ⅱ可描述为___________ 。
(1)甘油
 、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:
、水蒸气、氧气自热式催化重整制氢时无需加热,主要反应如下:反应I:
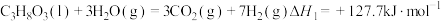
反应Ⅱ:
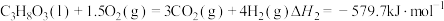
①

②除
 外,可能还会产生
外,可能还会产生 等副产物,为了提高原子利用率,最需要抑制
等副产物,为了提高原子利用率,最需要抑制 的生成,原因是
的生成,原因是(2)“表面改性铝粉分解水制氢”因
 储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响
储量丰富和较强的还原活性得到广泛应用。铝粉表面的致密氧化膜是影响 还原活性的主要因素,工业上常用
还原活性的主要因素,工业上常用 溶液或锡酸钠
溶液或锡酸钠 溶液作为
溶液作为 粉的改性试剂。已知:
粉的改性试剂。已知: 。
。①利用
 溶液改性
溶液改性 粉的原理可用化学方程式表示为
粉的原理可用化学方程式表示为②
 下,向两份质量和粒径均相同的
下,向两份质量和粒径均相同的 粉中,分别加入等体积
粉中,分别加入等体积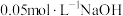 溶液和
溶液和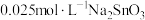 溶液来改性
溶液来改性 粉,氢气产率随时间的变化关系如图1所示。
粉,氢气产率随时间的变化关系如图1所示。 溶液改性效果明显优于
溶液改性效果明显优于 溶液的可能原因是
溶液的可能原因是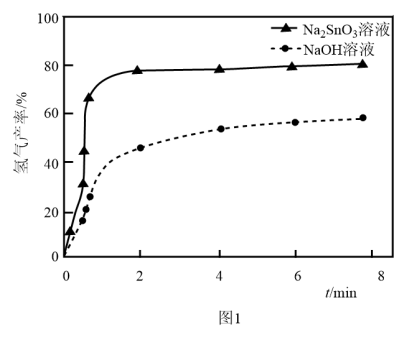
 溶液浓度的变化关系如图2所示。当
溶液浓度的变化关系如图2所示。当 溶液浓度为
溶液浓度为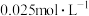 时,氢气产率接近
时,氢气产率接近 。但
。但 溶液过大或过小会大大降低氢气产率,其可能原因分别是
溶液过大或过小会大大降低氢气产率,其可能原因分别是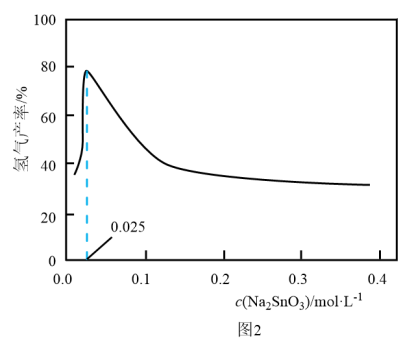
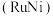 催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与
催化氨硼烷水解制氢”主要经过吸附和还原的过程,其反应机理如图所示(每个步骤只画出了可能参与该步反应的1个水分子,氨硼烷中与 原子相连的3个
原子相连的3个 原子分别用
原子分别用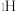 、
、 和
和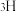 标记)。根据元素电负性的变化规律推测题图的虚线框内微粒
标记)。根据元素电负性的变化规律推测题图的虚线框内微粒 和
和 的化学式分别为
的化学式分别为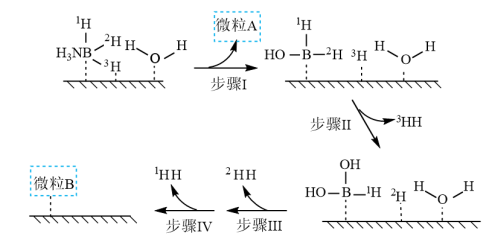
您最近半年使用:0次
名校
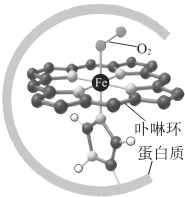
9 . 已知:血红蛋白可与 结合,血红蛋白更易与CO配位,血红蛋白与
结合,血红蛋白更易与CO配位,血红蛋白与 配位示意如图所示,血红蛋白(Hb)与
配位示意如图所示,血红蛋白(Hb)与 、CO结合的反应可表示为①
、CO结合的反应可表示为①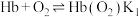
 ;②
;②
 。
。
 结合,血红蛋白更易与CO配位,血红蛋白与
结合,血红蛋白更易与CO配位,血红蛋白与 配位示意如图所示,血红蛋白(Hb)与
配位示意如图所示,血红蛋白(Hb)与 、CO结合的反应可表示为①
、CO结合的反应可表示为①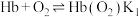
 ;②
;②
 。
。
A.相同温度下,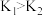 |
B.血红蛋白结合 后Fe的配位数为6 后Fe的配位数为6 |
C.已知反应 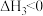 ,则 ,则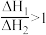 |
| D.高压氧舱可治疗CO中毒 |
您最近半年使用:0次
7日内更新
|
78次组卷
|
2卷引用:河北省衡水市第十三中学2023-2024学年高三上学期测评三 化学试卷
10 . 空气中 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。
(1)利用高炉炼铁尾气中的 制取有机物的过程如下:
制取有机物的过程如下: 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: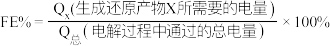 ,选择性
,选择性 .
.
“电解”在质子交换膜电解池中进行,生成 的电极反应式为
的电极反应式为____________ ,当电解电压为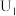 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为____________ .
(2)利用铟氧化物催化 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,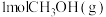 和
和 放出
放出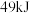 的热量,其热化学方程式为
的热量,其热化学方程式为____________ .
②若原料气中 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是____________ .
③制取 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者____________ 后者(选填“>”、“=”或“<”);保持气体流速不变,反应管内温度从 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是____________ .
 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)利用高炉炼铁尾气中的
 制取有机物的过程如下:
制取有机物的过程如下: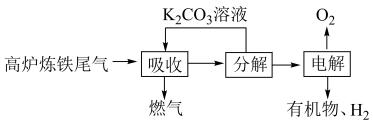
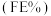 随电解电压的变化如下图1所示:
随电解电压的变化如下图1所示: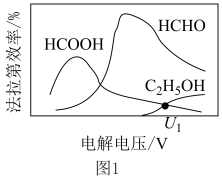
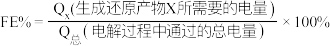 ,选择性
,选择性 .
.“电解”在质子交换膜电解池中进行,生成
 的电极反应式为
的电极反应式为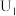 时,生成
时,生成 和
和 的选择性之比为
的选择性之比为(2)利用铟氧化物催化
 制取
制取 的可能机理如下图2所示,
的可能机理如下图2所示, 无催化活性,形成氧空位后具有较强催化活性,将固定比例的
无催化活性,形成氧空位后具有较强催化活性,将固定比例的 混合气体以不同流速通过装有催化剂的反应管,
混合气体以不同流速通过装有催化剂的反应管, 选择性、
选择性、 转化率随气体流速变化曲线如下图3所示,
转化率随气体流速变化曲线如下图3所示,
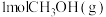 和
和 放出
放出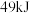 的热量,其热化学方程式为
的热量,其热化学方程式为②若原料气中
 比例过低、过高均会减弱催化剂活性,原因是
比例过低、过高均会减弱催化剂活性,原因是③制取
 时,同时发生反应
时,同时发生反应 ,气体流速分别为
,气体流速分别为 和
和 ,相同时间内生成
,相同时间内生成 的质量,前者
的质量,前者 升高到
升高到 ,测得出口处
,测得出口处 和
和 的物质的量均减小,可能的原因是
的物质的量均减小,可能的原因是
您最近半年使用:0次



