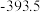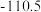名校
1 .  是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
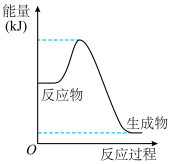
(1)已知利用合成气(主要成分 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为_____________________ (填“放热”或“吸热”)反应。 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收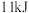 热量,请写出热化学方程式:
热量,请写出热化学方程式:_____________________________________________________ 。
(3)现在实验室中用 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,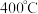 时发生反应:
时发生反应: ,体系中
,体系中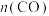 随时间的变化如表:
随时间的变化如表:
①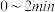 内,以
内,以 表示的该反应速率
表示的该反应速率
_____________________ 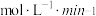 ;
;
②下列措施不能提高反应速率的有_____________________ (请用相应字母填空);
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂
③下列叙述能说明反应达到平衡状态的是_____________________ (请用相应字母填空);
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成
 容器内气体密度保持不变
容器内气体密度保持不变
 容器内质量保持不变
容器内质量保持不变
 是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。
是一种无色有刺激性气味的液体,在生产生活中有重要用途,也是一种重要的化工原料。(1)已知利用合成气(主要成分
 和
和 )在催化剂的作用下合成甲醇,发生反应为:
)在催化剂的作用下合成甲醇,发生反应为: 。反应过程中的能量变化如图所示,该反应为
。反应过程中的能量变化如图所示,该反应为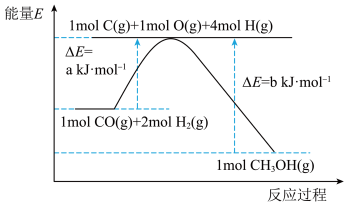
 (
( ,石墨)与适量
,石墨)与适量 反应生成
反应生成 和
和 ,吸收
,吸收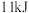 热量,请写出热化学方程式:
热量,请写出热化学方程式:(3)现在实验室中用
 和
和 反应模拟甲醇合成反应,在
反应模拟甲醇合成反应,在 恒容密闭容器内,
恒容密闭容器内,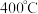 时发生反应:
时发生反应: ,体系中
,体系中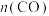 随时间的变化如表:
随时间的变化如表:时间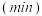 | 0 | 1 | 2 | 3 | 5 |
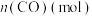 | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
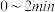 内,以
内,以 表示的该反应速率
表示的该反应速率
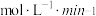 ;
;②下列措施不能提高反应速率的有
 升高温度
升高温度  恒
恒 、恒
、恒 下充入
下充入
 及时分离出
及时分离出
 恒
恒 、恒
、恒 下充入
下充入
 加入高效催化剂
加入高效催化剂③下列叙述能说明反应达到平衡状态的是
 和
和 的浓度保持不变
的浓度保持不变 
 每生成
每生成 的同时有
的同时有 键形成
键形成 容器内气体密度保持不变
容器内气体密度保持不变 容器内质量保持不变
容器内质量保持不变
您最近半年使用:0次
名校
解题方法
2 . 一定温度下,在恒容密闭容器中发生可逆反应:
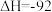 kJ/mol,下列说法错误的是
kJ/mol,下列说法错误的是

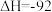 kJ/mol,下列说法错误的是
kJ/mol,下列说法错误的是| A.合适的催化剂、高温均可加快反应速率 |
| B.达到化学平衡时,混合气体的压强保持不变 |
| C.气体密度不变,说明反应达到平衡 |
D.相同时间内,生成0.3 mol  的同时,生成0.2 mol 的同时,生成0.2 mol  ,说明反应已经到达平衡状态 ,说明反应已经到达平衡状态 |
您最近半年使用:0次
名校
3 . 全球大气 浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知 时,大气中的
时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:
①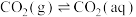
②
过程①的
_______ 0(填“ ”“
”“ ”或“
”或“ ”)。溶液中
”)。溶液中 的浓度与其在大气中的分压(分压
的浓度与其在大气中的分压(分压 总压
总压 物质的量分数)成正比,比例系数为
物质的量分数)成正比,比例系数为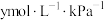 。当大气压强为
。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为_______  (忽略
(忽略 和水的电离)。
和水的电离)。
(2)甲烷干法重整制 同时存在如下反应:
同时存在如下反应:
Ⅰ.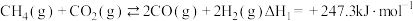
Ⅱ.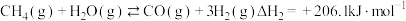
Ⅲ.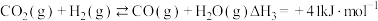
①一定条件下,向 恒容密闭容器中通入
恒容密闭容器中通入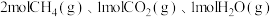 发生上述反应达到平衡时容器中
发生上述反应达到平衡时容器中 为
为 为
为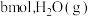 为
为 ,此时
,此时 的浓度为
的浓度为____  。
。
②向恒容密闭容器中充入等物质的量的 和
和 ,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是
,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是____ 。
A.高温低压有利于提高 的平衡转化率
的平衡转化率
 充分反应后的混合气体中,
充分反应后的混合气体中, 的体积分数可能达到
的体积分数可能达到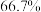
C.充分反应后的混合气体通过生石灰,固体质量增大,说明干重整反应存在限度
 当混合气体中
当混合气体中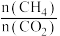 恒定时,反应达到平衡状态
恒定时,反应达到平衡状态
③恒温下,向恒压容器中通入物质的量为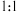 的
的 和
和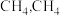 的物质的量
的物质的量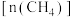 随时间变化如图所示。在
随时间变化如图所示。在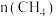 不变的条件下,改成加入
不变的条件下,改成加入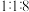 的
的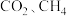 和
和 的混合气体,请在图中画出
的混合气体,请在图中画出 的物质的量随时间
的物质的量随时间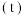 变化的曲线
变化的曲线_______ 。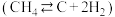 ,关键是开发出具有抗积碳性能
,关键是开发出具有抗积碳性能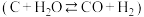 的催化剂。催化剂
的催化剂。催化剂 对积碳与消碳的影响如图所示:
对积碳与消碳的影响如图所示:_______ (填“A”或“ ”),理由是
”),理由是_______ 。
 浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:
浓度升高对人类生产、生活产生了影响,碳及其化合物的资源化利用成为研究热点。回答下列问题:(1)已知
 时,大气中的
时,大气中的 溶于水存在以下过程:
溶于水存在以下过程:①
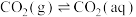
②

过程①的

 ”“
”“ ”或“
”或“ ”)。溶液中
”)。溶液中 的浓度与其在大气中的分压(分压
的浓度与其在大气中的分压(分压 总压
总压 物质的量分数)成正比,比例系数为
物质的量分数)成正比,比例系数为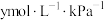 。当大气压强为
。当大气压强为 ,大气中
,大气中 的物质的量分数为
的物质的量分数为 时,溶液中
时,溶液中 的浓度为
的浓度为 (忽略
(忽略 和水的电离)。
和水的电离)。(2)甲烷干法重整制
 同时存在如下反应:
同时存在如下反应:Ⅰ.
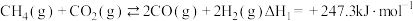
Ⅱ.
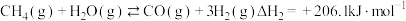
Ⅲ.
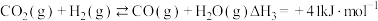
①一定条件下,向
 恒容密闭容器中通入
恒容密闭容器中通入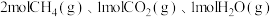 发生上述反应达到平衡时容器中
发生上述反应达到平衡时容器中 为
为 为
为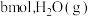 为
为 ,此时
,此时 的浓度为
的浓度为 。
。②向恒容密闭容器中充入等物质的量的
 和
和 ,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是
,若只发生反应Ⅰ和Ⅲ,则下列说法正确的是A.高温低压有利于提高
 的平衡转化率
的平衡转化率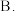 充分反应后的混合气体中,
充分反应后的混合气体中, 的体积分数可能达到
的体积分数可能达到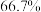
C.充分反应后的混合气体通过生石灰,固体质量增大,说明干重整反应存在限度
 当混合气体中
当混合气体中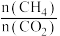 恒定时,反应达到平衡状态
恒定时,反应达到平衡状态③恒温下,向恒压容器中通入物质的量为
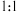 的
的 和
和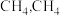 的物质的量
的物质的量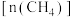 随时间变化如图所示。在
随时间变化如图所示。在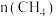 不变的条件下,改成加入
不变的条件下,改成加入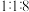 的
的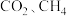 和
和 的混合气体,请在图中画出
的混合气体,请在图中画出 的物质的量随时间
的物质的量随时间 变化的曲线
变化的曲线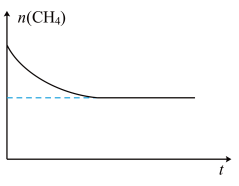
 ,关键是开发出具有抗积碳性能
,关键是开发出具有抗积碳性能 的催化剂。催化剂
的催化剂。催化剂 对积碳与消碳的影响如图所示:
对积碳与消碳的影响如图所示: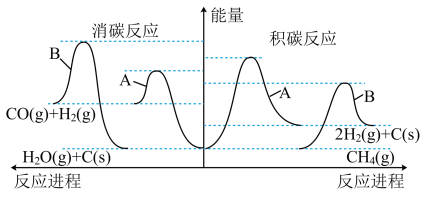
 ”),理由是
”),理由是
您最近半年使用:0次
解题方法
4 . 根据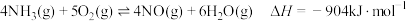 ,下列说法
,下列说法不正确 的是
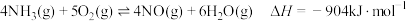 ,下列说法
,下列说法A.反应的 |
B.有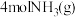 和 和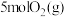 在反应器中充分反应,能放出 在反应器中充分反应,能放出 热量 热量 |
C.断裂1mol 键的同时,断裂 键的同时,断裂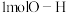 键,说明该反应达到平衡状态 键,说明该反应达到平衡状态 |
D.每消耗 转移电子的数目约为 转移电子的数目约为 |
您最近半年使用:0次
5 . I.回答下列问题
(1)下列变化中满足图示的是___________(填字母)。
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为___________ 。
(3)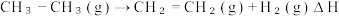 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=___________ 。
Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和)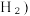 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
i. CO与H₂反应合成甲醇: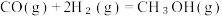
i i.CO₂与H₂反应合成甲醇:
(4)上述反应符合原子经济性的是反应___________ (i或ii)。
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
(7)H₂还原 CO电化学法制备甲醇( 的工作原理如图所示:
的工作原理如图所示:___________ 极(填“正”或“负”),电池工作过程中  通过质子膜向
通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。
(1)下列变化中满足图示的是___________(填字母)。
| A.镁和稀盐酸的反应 |
B.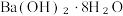 与NH₄Cl的反应 与NH₄Cl的反应 |
| C.NaOH 固体加入水中 |
| D.乙醇燃烧 |
(2)下图是在 101kPa、298K条件下,1mol NO₂气体和1mol CO反应生成
 和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为
和 1mol NO 气体的能量变化的示意图。该反应的热化学方程式为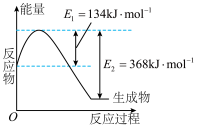
| 化学键 | C——H | C=C | C—C | H—H |
| 键能/(kJ·mol⁻¹) | 414 | 615 | 347.7 | 436.4 |
(3)
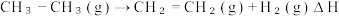 有关化学键的键能如上表所示。则该反应的反应热为ΔH=
有关化学键的键能如上表所示。则该反应的反应热为ΔH=Ⅱ. 近年来,我国化工技术获得重大突破,利用合成气(主要成分为 CO、CO₂和)
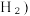 在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:
在催化剂的作用下合成甲醇(CH₃OH)是其中的一个研究项目。该研究发生的主要反应如下:i. CO与H₂反应合成甲醇:
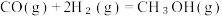
i i.CO₂与H₂反应合成甲醇:

(4)上述反应符合原子经济性的是反应
(5)在某一时刻采取下列措施,能使反应 i 的反应速率减小的措施是___________。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入 Ar |
(6)一定温度下,在容积固定的密闭容器中发生反应ii,下列说法可以表明反应达到化学平衡状态的是___________。
| A.单位时间内消耗 3molH₂, 同时生成1mol的 CH₃OH |
| B.CH₃OH 的体积分数不再发生变化 |
C.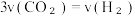 |
| D.容器内气体密度不再改变 |
(7)H₂还原 CO电化学法制备甲醇(
 的工作原理如图所示:
的工作原理如图所示: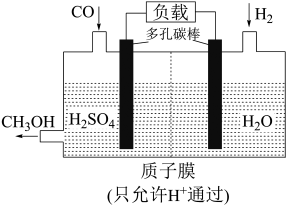
 通过质子膜向
通过质子膜向
您最近半年使用:0次
解题方法
6 . 在体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应: ,测得CO2和CH3OH的浓度随时间的变化如图所示。
,测得CO2和CH3OH的浓度随时间的变化如图所示。
______  。
。
(2)平衡时CO2的转化率为______ 。
(3)下列能说明上述反应达到平衡状态的是______(填字母)。
(4)平衡时混合气体中CH3OH(g)的体积分数是______ 。
(5)该反应的平衡常数
______ 。
 ,测得CO2和CH3OH的浓度随时间的变化如图所示。
,测得CO2和CH3OH的浓度随时间的变化如图所示。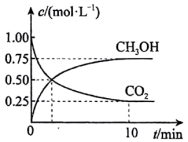

 。
。(2)平衡时CO2的转化率为
(3)下列能说明上述反应达到平衡状态的是______(填字母)。
| A.反应中CO2与CH3OH的物质的量浓度之比为1∶1 |
| B.混合气体的密度不随时间的变化而变化 |
| C.单位时间内消耗3 mol H2,同时生成1 mol H2O |
| D.CO2的体积分数在混合气体中保持不变 |
(5)该反应的平衡常数

您最近半年使用:0次
2024·内蒙古锡林郭勒盟·三模
解题方法
7 . 氮氧化物是大气的主要污染物,为防治环境污染,科研人员做了大量研究。
I.汽油燃油车上安装三元催化转化器,可以使 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为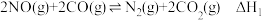 。
。
(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(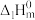 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在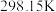 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。
则
__________  。
。
(2)将 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂(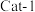 和
和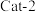 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是__________ (填“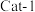 ”或“
”或“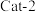 ”)。
”)。
②催化剂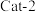 催化条件下,
催化条件下,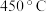 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是_______________ 。
Ⅱ.一定条件下 与
与 可发生反应:
可发生反应: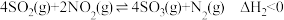 。
。
(3)将 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
(4)将一定量的 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。_______________ 。
②图2中压强:
__________ (填“>”“<”或“=”,下同) ,氮硫比:
,氮硫比:
__________  。
。
③温度为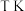 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
__________ 。
I.汽油燃油车上安装三元催化转化器,可以使
 和
和 两种尾气反应生成
两种尾气反应生成 ,可有效降低汽车尾气污染,反应为
,可有效降低汽车尾气污染,反应为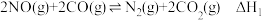 。
。(1)下表中数据是该反应中的相关物质的标准摩尔生成焓(
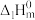 )(标准摩尔生成焓是指在
)(标准摩尔生成焓是指在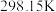 、
、 条件下,由稳定态单质生成
条件下,由稳定态单质生成 化合物时的焓变)数据。
化合物时的焓变)数据。物质 |
|
|
|
|
| 0 |
|
| 90 |

 。
。(2)将
 和
和 按物质的量之比
按物质的量之比 以一定的流速分别通过两种催化剂(
以一定的流速分别通过两种催化剂(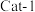 和
和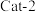 )进行反应,相同时间内测定逸出气体中
)进行反应,相同时间内测定逸出气体中 的含量,从而确定尾气脱氮率(
的含量,从而确定尾气脱氮率( 的转化率),结果如图所示。
的转化率),结果如图所示。
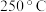 下脱氮率较高的催化剂是
下脱氮率较高的催化剂是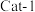 ”或“
”或“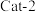 ”)。
”)。②催化剂
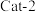 催化条件下,
催化条件下,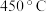 后,脱氮率随温度升高而下降的原因是
后,脱氮率随温度升高而下降的原因是Ⅱ.一定条件下
 与
与 可发生反应:
可发生反应: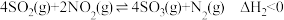 。
。(3)将
 与
与 按物质的量之比
按物质的量之比 置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。
置于恒温恒容密闭容器中反应。下列能说明反应达到平衡状态的是__________(填标号)。| A.体系压强保持不变 | B. 与 与 的物质的量之比保持不变 的物质的量之比保持不变 |
C. | D.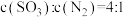 |
(4)将一定量的
 与
与 置于密闭容器中发生反应,在相同时间内测得
置于密闭容器中发生反应,在相同时间内测得 的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。
的物质的量分数与温度的变化曲线如图1所示(虚线为平衡时的曲线)。 的平衡转化率与压强、温度及氮硫比
的平衡转化率与压强、温度及氮硫比 的关系如图2所示。
的关系如图2所示。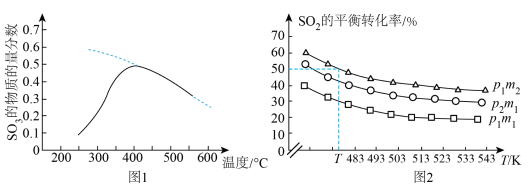
②图2中压强:

 ,氮硫比:
,氮硫比:
 。
。③温度为
 ,压强恒定为
,压强恒定为 时,反应平衡常数
时,反应平衡常数
您最近半年使用:0次
2024-05-01更新
|
352次组卷
|
3卷引用:化学(福建卷01)-2024年高考押题预测卷
名校
解题方法
8 . 空气中的氮氧化物主要来源:化石燃料燃烧、工业制硝酸尾气、汽车尾气。
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:___________ 。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
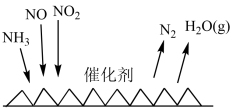
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:___________ 。
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为___________ 。
(5)甲烷与NO2发生的反应为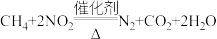 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使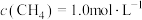 、
、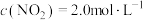 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得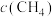 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,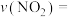
___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是___________ 。
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
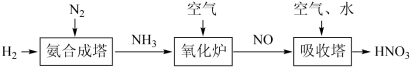
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(5)甲烷与NO2发生的反应为
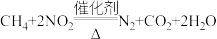 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使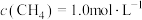 、
、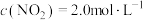 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得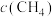 随时间的变化情况如下表:
随时间的变化情况如下表:| 实验序号 | 时间/min 浓度 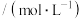 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
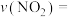
②0~20min内,实验2比实验1反应速率快的原因可能是
您最近半年使用:0次
名校
解题方法
9 . 将1mol固体A置于体积不变的真空密闭容器中(固体试样体积忽略不计),在恒定温度下使其分解:A(s) 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
 2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是
2B(g)+C(g),下列可以判断该反应已达到化学平衡状态的是| A.物质的浓度:c(B)=2c(C) | B.混合气体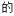 密度保持不变 密度保持不变 |
| C.B的体积分数不变 | D.混合气体的平均摩尔质量保持不变 |
您最近半年使用:0次
2024-04-29更新
|
279次组卷
|
2卷引用:福建省福州九县(区、市)一中(高中)2023-2024学年高一下学期4月期中联考化学试题
名校
10 . I. 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为:
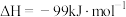 。
。
(1)若要该反应自发进行,_______ (填“高温”、“低温”或“任何温度”)更有利。
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______。
(3)把 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:
①
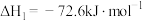
②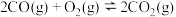

③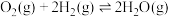
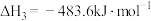
则 与
与 合成
合成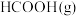 反应的热化学方程式:
反应的热化学方程式:_______ 。
Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下,此反应为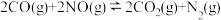
 可有效降低汽车尾气污染物排放。
可有效降低汽车尾气污染物排放。
(4)探究温度、压强 对反应的影响,如图下所示,表示
对反应的影响,如图下所示,表示 的是曲线
的是曲线_______ 。 的恒容密闭容器充入
的恒容密闭容器充入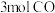 和
和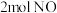 ,当反应达到平衡时NO的体积分数为
,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数
_______ 
_______ 。(第一空写表达式,第二空保留三位有效数字)
(6)使用相同催化剂,测得相同时间内NO的转化率随温度的变化曲线如下图,解释NO的转化率在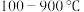 范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
范围内随温度升高先上升后下降,且下降由缓到急的主要原因是____ 。
 的捕集、利用与封存是科学家研究的重要课题,利用
的捕集、利用与封存是科学家研究的重要课题,利用 与
与 制备“合成气”
制备“合成气” 、
、 ,合成气可直接制备甲醇,反应原理为:
,合成气可直接制备甲醇,反应原理为:
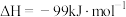 。
。(1)若要该反应自发进行,
(2)在恒温、恒容的密闭容器中,对于合成气合成甲醇的反应,下列说法中能说明该反应达到化学平衡状态的是_______。
| A.混合气体中碳元素的质量分数不再改变 |
| B.混合气体的密度不再变化 |
C. 的百分含量不再变化 的百分含量不再变化 |
D.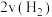 正 正 逆 逆 |
(3)把
 转化为
转化为 是降碳并生产化工原料的常用方法,有关反应如下:
是降碳并生产化工原料的常用方法,有关反应如下:①

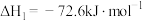
②
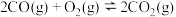

③
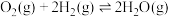
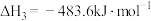
则
 与
与 合成
合成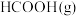 反应的热化学方程式:
反应的热化学方程式:Ⅱ.我国学者结合实验与计算机模拟结果,研究了NO-CO的反应历程。在催化剂作用下,此反应为
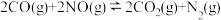
 可有效降低汽车尾气污染物排放。
可有效降低汽车尾气污染物排放。(4)探究温度、压强
 对反应的影响,如图下所示,表示
对反应的影响,如图下所示,表示 的是曲线
的是曲线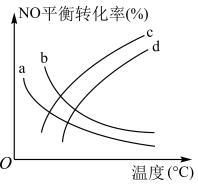
 的恒容密闭容器充入
的恒容密闭容器充入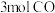 和
和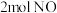 ,当反应达到平衡时NO的体积分数为
,当反应达到平衡时NO的体积分数为 ,此温度下该反应的平衡常数
,此温度下该反应的平衡常数

(6)使用相同催化剂,测得相同时间内NO的转化率随温度的变化曲线如下图,解释NO的转化率在
 范围内随温度升高先上升后下降,且下降由缓到急的主要原因是
范围内随温度升高先上升后下降,且下降由缓到急的主要原因是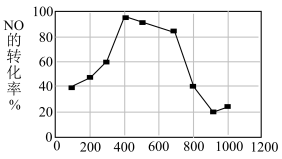
您最近半年使用:0次