名校
解题方法
1 . “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。
Ⅰ.已知 和
和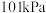 下:
下:
①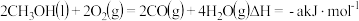
②
③
(1)则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为___________ 。
Ⅱ. 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和 ,发生反应:
,发生反应: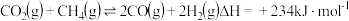 。
。
(2)该反应在___________ (填“高温”或“低温”)条件下能自发进行。
(3)下列能判断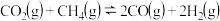 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。
Ⅲ.已知 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: ,设
,设 为起始时的投料比,即
为起始时的投料比,即 。
。

(4)图1中投料比相同,温度从高到低的顺序为___________ 。
(5)图2中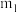 、
、 、
、 从大到小的顺序为
从大到小的顺序为___________ 。
(6)图3表示在总压为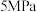 的恒压条件下,且
的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线 代表的物质的化学名称为
代表的物质的化学名称为___________ 。
Ⅰ.已知
 和
和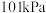 下:
下:①
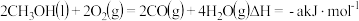
②

③

(1)则表示
 燃烧热的热化学方程式为
燃烧热的热化学方程式为Ⅱ.
 和
和 在一定条件下反应可制得合成气,在
在一定条件下反应可制得合成气,在 密闭容器中分别通入
密闭容器中分别通入 和
和 ,发生反应:
,发生反应: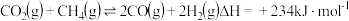 。
。(2)该反应在
(3)下列能判断
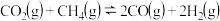 达到平衡状态的是___________(填序号)。
达到平衡状态的是___________(填序号)。| A.一定温度下,容积固定的容器中,气体密度保持不变 |
| B.容积固定的绝热容器中,温度保持不变 |
| C.一定温度和容积固定的容器中,混合气体平均相对分子质量不变 |
D. 和 和 的物质的量之比不再改变 的物质的量之比不再改变 |
Ⅲ.已知
 催化加氢合成乙醇的反应原理为:
催化加氢合成乙醇的反应原理为: ,设
,设 为起始时的投料比,即
为起始时的投料比,即 。
。
(4)图1中投料比相同,温度从高到低的顺序为
(5)图2中
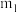 、
、 、
、 从大到小的顺序为
从大到小的顺序为(6)图3表示在总压为
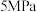 的恒压条件下,且
的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系。则曲线
时,平衡状态时各物质的物质的量分数与温度的关系。则曲线 代表的物质的化学名称为
代表的物质的化学名称为
您最近一年使用:0次
名校
2 . 温度为 时,在三个容积均为
时,在三个容积均为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: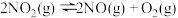 (正反应吸热)。实验测得:
(正反应吸热)。实验测得: ,
,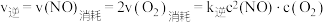 ,
, 、
、 为速率常数,受温度影响。下列说法不正确的是
为速率常数,受温度影响。下列说法不正确的是
 时,在三个容积均为
时,在三个容积均为 的恒容密闭容器中发生反应:
的恒容密闭容器中发生反应: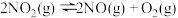 (正反应吸热)。实验测得:
(正反应吸热)。实验测得: ,
,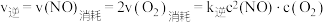 ,
, 、
、 为速率常数,受温度影响。下列说法不正确的是
为速率常数,受温度影响。下列说法不正确的是| 容器编号 | 物质的起始浓度( ) ) | 物质的平衡浓度( ) ) | ||
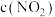 | 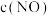 |  |  | |
| I | 0.6 | 0 | 0 | 0.2 |
| II | 0.3 | 0.5 | 0.2 | |
| III | 0 | 0.5 | 0.35 | |
| A.达到平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于4∶5 |
| B.容器Ⅱ向正反应方向达到平衡 |
C.当温度改变为 时,若 时,若 ,则 ,则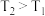 |
D.达到平衡时,容器Ⅲ中 的体积分数大于50% 的体积分数大于50% |
您最近一年使用:0次
名校
3 . 在机动车发动机中,燃料燃烧产生的高温会使空气中的氮气和氧气反应,生成氮氧化物,某些硝酸盐分解,也会产生氮氧化物,已知如下反应:
①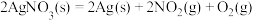
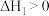
②
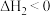
(1)温度 时,在
时,在 的恒容密闭容器中投入
的恒容密闭容器中投入 并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:

①下列情况能说明体系达到平衡状态的是___________ (填字母)。
a.混合气体的平均相对分子质量不再改变 b. 的浓度不再改变
的浓度不再改变
c. 的体积分数不再改变 d.混合气体的密度不再改变
的体积分数不再改变 d.混合气体的密度不再改变
②若达到平衡时,混合气体的总压强 ,反应开始到
,反应开始到 内
内 的平均反应速率为
的平均反应速率为___________  ,在该温度下
,在该温度下 的平衡常数
的平衡常数
___________ 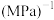 (结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
(结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
③实验测得 ,
, ,
, 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 的数学关系是
的数学关系是
___________ 。若将容器的温度改变为 时,其
时,其 ,则
,则
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为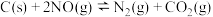 ,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入
,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时反应
,使二者的浓度均增加至原来的两倍,此时反应
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种 电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为
电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为 和
和 ,并实现其定向通过),在该电池工作过程中,
,并实现其定向通过),在该电池工作过程中, 电极上发生的电极反应式为
电极上发生的电极反应式为___________ ,若有 (标准状况下)参加反应,
(标准状况下)参加反应,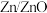 电极质量增加
电极质量增加___________ g。

①
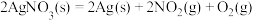
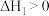
②

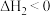
(1)温度
 时,在
时,在 的恒容密闭容器中投入
的恒容密闭容器中投入 并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
并完全分解,测得混合气体的总物质的量(n)与时间(t)的关系如图所示:
①下列情况能说明体系达到平衡状态的是
a.混合气体的平均相对分子质量不再改变 b.
 的浓度不再改变
的浓度不再改变c.
 的体积分数不再改变 d.混合气体的密度不再改变
的体积分数不再改变 d.混合气体的密度不再改变②若达到平衡时,混合气体的总压强
 ,反应开始到
,反应开始到 内
内 的平均反应速率为
的平均反应速率为 ,在该温度下
,在该温度下 的平衡常数
的平衡常数
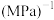 (结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。
(结果保留2位有效数字)。[提示:用平衡时各组分分压替代浓度计算的平衡常数叫压强平衡常数(Kp),组分的分压(p1)=平衡时总压(p)×该组分的体积分数(φ)]。③实验测得
 ,
, ,
, 为速率常数且只受温度影响。则化学平衡常数K与速率常数
为速率常数且只受温度影响。则化学平衡常数K与速率常数 的数学关系是
的数学关系是
 时,其
时,其 ,则
,则
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)用活性炭还原法可将氮氧化物转化为无毒气体,有关反应为
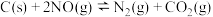 ,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入
,向恒容密闭容器中加入足量的活性炭和一定量NO,20min达到平衡,保持温度和容器体积不变再充入 和
和 ,使二者的浓度均增加至原来的两倍,此时反应
,使二者的浓度均增加至原来的两倍,此时反应
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)氮氧化物排放到空气中会造成空气污染。2021年我国科研人员以二硫化钼(MoS2)作为电极催化剂,研发出一种
 电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为
电池系统,该电池同时具备合成氨和对外供电的功能,其工作原理如图所示(双极膜可将水解离为 和
和 ,并实现其定向通过),在该电池工作过程中,
,并实现其定向通过),在该电池工作过程中, 电极上发生的电极反应式为
电极上发生的电极反应式为 (标准状况下)参加反应,
(标准状况下)参加反应,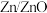 电极质量增加
电极质量增加
您最近一年使用:0次
名校
解题方法
4 .  常用作脱硝催化剂,采用共沉淀法等比掺入金属M后,催化剂
常用作脱硝催化剂,采用共沉淀法等比掺入金属M后,催化剂 的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为
的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为 ,主反应如下:
,主反应如下:
反应I:
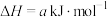
反应II:

(1)已知:
 。则
。则
___________  。
。
(2)某条件下对于反应I, ,
, ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m___________ n(填“>”“<”或“=”)。
(3)将模拟烟气按一定流速通到催化剂表面,不同温度下气体出口处测定相关物质浓度,得出NO的转化率、 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。
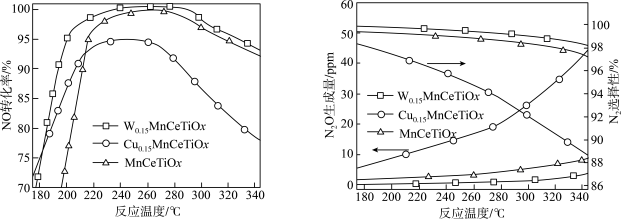
①选择 时,温度高于260℃时NO转化率下降的原因为
时,温度高于260℃时NO转化率下降的原因为___________ 。
②综合分析,该脱硝过程应选择的最佳催化剂中M为___________ 。
(4)273℃,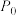 kPa下,向恒温恒压密闭的容器中通入4mol
kPa下,向恒温恒压密闭的容器中通入4mol 、4molNO、2mol
、4molNO、2mol (假设仅发生反应I、II)
(假设仅发生反应I、II)
①下列选项不能说明反应I、II均达到化学平衡状态的是___________ 。
A.混合气体的平均摩尔质量保持不变
B.NO的分压保持不变
C.有1molN—H键断裂的同时,有1mol 键断裂
键断裂
②达到平衡后测定 转化率为30%,体系中
转化率为30%,体系中 为1.2mol。则NO的转化率为
为1.2mol。则NO的转化率为___________ ,反应I的
___________ (写出计算式即可)(分压=总压×物质的量分数)。
 常用作脱硝催化剂,采用共沉淀法等比掺入金属M后,催化剂
常用作脱硝催化剂,采用共沉淀法等比掺入金属M后,催化剂 的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为
的脱硝性能及抗硫中毒性能会发生改变。烟气脱硝主要副产物为 ,主反应如下:
,主反应如下:反应I:

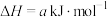
反应II:


(1)已知:

 。则
。则
 。
。(2)某条件下对于反应I,
 ,
, ,
, 、
、 为速率常数。升高温度时,
为速率常数。升高温度时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m(3)将模拟烟气按一定流速通到催化剂表面,不同温度下气体出口处测定相关物质浓度,得出NO的转化率、
 的选择性、
的选择性、 的生成量随温度变化关系如下图。
的生成量随温度变化关系如下图。
①选择
 时,温度高于260℃时NO转化率下降的原因为
时,温度高于260℃时NO转化率下降的原因为②综合分析,该脱硝过程应选择的最佳催化剂中M为
(4)273℃,
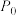 kPa下,向恒温恒压密闭的容器中通入4mol
kPa下,向恒温恒压密闭的容器中通入4mol 、4molNO、2mol
、4molNO、2mol (假设仅发生反应I、II)
(假设仅发生反应I、II)①下列选项不能说明反应I、II均达到化学平衡状态的是
A.混合气体的平均摩尔质量保持不变
B.NO的分压保持不变
C.有1molN—H键断裂的同时,有1mol
 键断裂
键断裂②达到平衡后测定
 转化率为30%,体系中
转化率为30%,体系中 为1.2mol。则NO的转化率为
为1.2mol。则NO的转化率为
您最近一年使用:0次
名校
5 . 为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是:
 。回答下列问题:
。回答下列问题:
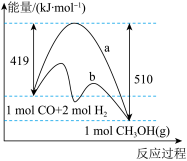
(1)该反应的能量变化如图所示,反应的
______ ,曲线______ (填“a”或“b”)表示使用了催化剂。
(2)相同温度下,若已知反应 的平衡常数为
的平衡常数为 ,反应
,反应 的平衡常数为
的平衡常数为 ,则反应
,则反应 的化学平衡常数K=
的化学平衡常数K=______ (用含 和
和 的代数式表示)。
的代数式表示)。
(3)在恒温恒容密闭容器中按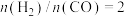 加入反应起始物
加入反应起始物
Ⅰ.下列描述不能说明反应达到平衡状态的是______
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与 的浓度相等 D.容器内CO的体积分数不再变化
的浓度相等 D.容器内CO的体积分数不再变化
II.若CO的平衡转化率[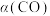 ]随温度的变化曲线如图所示,R、S两点平衡常数大小:
]随温度的变化曲线如图所示,R、S两点平衡常数大小:
______  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 温度下,测得起始压强
温度下,测得起始压强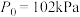 ,达平衡时
,达平衡时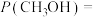
______ kPa。


 。回答下列问题:
。回答下列问题:(1)该反应的能量变化如图所示,反应的


(2)相同温度下,若已知反应
 的平衡常数为
的平衡常数为 ,反应
,反应 的平衡常数为
的平衡常数为 ,则反应
,则反应 的化学平衡常数K=
的化学平衡常数K= 和
和 的代数式表示)。
的代数式表示)。(3)在恒温恒容密闭容器中按
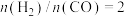 加入反应起始物
加入反应起始物Ⅰ.下列描述不能说明反应达到平衡状态的是
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与
 的浓度相等 D.容器内CO的体积分数不再变化
的浓度相等 D.容器内CO的体积分数不再变化II.若CO的平衡转化率[
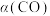 ]随温度的变化曲线如图所示,R、S两点平衡常数大小:
]随温度的变化曲线如图所示,R、S两点平衡常数大小:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 温度下,测得起始压强
温度下,测得起始压强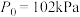 ,达平衡时
,达平衡时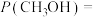

您最近一年使用:0次
名校
6 .  时,将
时,将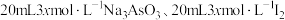 和
和 溶液混合,发生反应:
溶液混合,发生反应: 。溶液中
。溶液中 与反应时间
与反应时间 的关系如图所示。
的关系如图所示。

下列可判断反应达到平衡的是
①溶液的 不再变化②
不再变化② ③
③ 不再变化④
不再变化④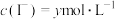
 时,将
时,将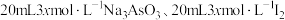 和
和 溶液混合,发生反应:
溶液混合,发生反应: 。溶液中
。溶液中 与反应时间
与反应时间 的关系如图所示。
的关系如图所示。
下列可判断反应达到平衡的是
①溶液的
 不再变化②
不再变化② ③
③ 不再变化④
不再变化④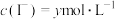
| A.①② | B.②④ | C.①③ | D.③④ |
您最近一年使用:0次
7 . 合成氨反应 是目前最有效的工业固氮方法,解决数亿人口生存问题。合成氨的反应历程和能量变化如图1所示。请回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。合成氨的反应历程和能量变化如图1所示。请回答下列问题:

(1)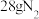 分子中
分子中 键数目为
键数目为___________ ,合成氨反应的热化学方程式为___________ 。
(2)在一定温度下,向一恒压密闭容器中通入氢氮比为3的混合气体,以下叙述能说明该条件下反应达到平衡状态的是___________ (填标号)。
a.氨气的体积分数保持不变 b.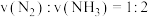
c.气体密度保持不变 d.容器中氢氮比保持不变
(3)利用催化剂通过电化学反应在室温下合成氨的原理如图2所示,该装置中阴极的电极反应式为___________ 。

(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如图3、图4所示。进料组成Ⅰ: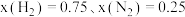 ;进料组成Ⅱ:
;进料组成Ⅱ: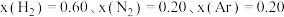 。(物质i的物质的量分数
。(物质i的物质的量分数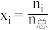 )
)

①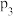
___________ (填“>”、“=”或“<”)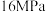 。
。
②进料组成中含惰性气体 的图是
的图是___________ 。
③图3中,当 时,氮气的转化率
时,氮气的转化率
___________ 。该温度时,反应 的平衡常数
的平衡常数
___________ 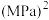 。
。
 是目前最有效的工业固氮方法,解决数亿人口生存问题。合成氨的反应历程和能量变化如图1所示。请回答下列问题:
是目前最有效的工业固氮方法,解决数亿人口生存问题。合成氨的反应历程和能量变化如图1所示。请回答下列问题:
(1)
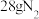 分子中
分子中 键数目为
键数目为(2)在一定温度下,向一恒压密闭容器中通入氢氮比为3的混合气体,以下叙述能说明该条件下反应达到平衡状态的是
a.氨气的体积分数保持不变 b.
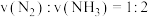
c.气体密度保持不变 d.容器中氢氮比保持不变
(3)利用催化剂通过电化学反应在室温下合成氨的原理如图2所示,该装置中阴极的电极反应式为

(4)在不同压强下,以两种不同组成进料,反应达平衡时氨的物质的量分数与温度的计算结果如图3、图4所示。进料组成Ⅰ:
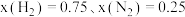 ;进料组成Ⅱ:
;进料组成Ⅱ: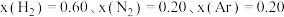 。(物质i的物质的量分数
。(物质i的物质的量分数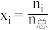 )
)
①
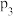
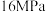 。
。②进料组成中含惰性气体
 的图是
的图是③图3中,当
 时,氮气的转化率
时,氮气的转化率
 的平衡常数
的平衡常数
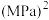 。
。
您最近一年使用:0次
8 . 已知: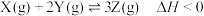 ,向一恒温恒容的密闭容器中充入1molX和3molY发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
,向一恒温恒容的密闭容器中充入1molX和3molY发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
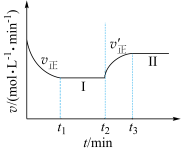
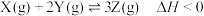 ,向一恒温恒容的密闭容器中充入1molX和3molY发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
,向一恒温恒容的密闭容器中充入1molX和3molY发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态II,正反应速率随时间的变化如图所示。下列说法正确的是
| A.容器内压强不变,表明反应达到平衡 |
| B.t2时改变的条件:向容器中加入Z |
| C.平衡时X的体积分数φ:φ(II)<φ(I) |
| D.平衡常数K:K(II)<K(I) |
您最近一年使用:0次
9 . 苯乙烯是生产塑料和合成橡胶的重要有机原料,国内外目前生产苯乙烯的方法主要是乙苯催化脱氢法,反应方程式为:
(1)实际生产过程中,通常向乙苯中掺混氮气N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。

①乙苯催化脱氢反应的
___________ 0(填“>”或“<”)。
②投料比m为1∶9的曲线是___________ (填 、
、 、
、 或
或 ),图中A与B两点相比较,乙苯活化分子百分数A
),图中A与B两点相比较,乙苯活化分子百分数A___________ B(填“>”、“=”或“<”)。
③保持投料比不变,在恒温恒压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是___________ (填字母)。
A. (乙苯)
(乙苯)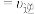 (苯乙烯)
(苯乙烯)
B.容器内气体密度不再变化
C.容器内苯乙烯与H2的分子数之比不再变化
D.容器内气体的平均相对分子质量不再变化
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图(历程中的微粒均为气态):

①该过程中发生的总反应化学方程式为___________ 。
②一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO2起始压强为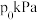 ,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为___________ ,用平衡分压代替平衡浓度表示的化学平衡常数
___________ kPa(用含 的代数式表示,某气体平衡分压=总压×该气体物质的量分数)。
的代数式表示,某气体平衡分压=总压×该气体物质的量分数)。

(1)实际生产过程中,通常向乙苯中掺混氮气N2不参与反应),保持体系总压为100kPa下进行反应,不同投料比m下乙苯的平衡转化率随反应温度变化关系如图所示(其中投料比m为原料气中乙苯和N2的物质的量之比,取值分别为1∶0、1∶1、1∶5、1∶9)。

①乙苯催化脱氢反应的

②投料比m为1∶9的曲线是
 、
、 、
、 或
或 ),图中A与B两点相比较,乙苯活化分子百分数A
),图中A与B两点相比较,乙苯活化分子百分数A③保持投料比不变,在恒温恒压的条件下进行反应,下列事实能作为该反应达到平衡的依据的是
A.
 (乙苯)
(乙苯)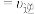 (苯乙烯)
(苯乙烯) B.容器内气体密度不再变化
C.容器内苯乙烯与H2的分子数之比不再变化
D.容器内气体的平均相对分子质量不再变化
(2)近年来,有研究者发现若将上述生产过程中通入N2改为通入CO2,在CO2气氛中乙苯催化脱氢制苯乙烯更容易进行,反应历程如图(历程中的微粒均为气态):

①该过程中发生的总反应化学方程式为
②一定温度下,向恒容密闭容器中充入2mol乙苯和2molCO2起始压强为
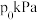 ,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为
,若平衡时容器内气体总物质的量为5mol,乙苯的转化率为
 的代数式表示,某气体平衡分压=总压×该气体物质的量分数)。
的代数式表示,某气体平衡分压=总压×该气体物质的量分数)。
您最近一年使用:0次
2023-12-18更新
|
152次组卷
|
3卷引用:福建省莆田第六中学2023-2024学年高三上学期1月质检模拟考化学试题
名校
10 . 甲硫醇( )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:
Ⅰ.
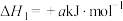
Ⅱ.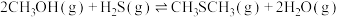
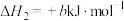
回答下列问题:
(1)计算反应 的ΔH=
的ΔH=___________  。
。
(2) 时,向恒容密闭容器中充入一定量
时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是
发生反应,下列事实能说明反应达到平衡状态的是________ (填选项字母);若按相同比例再充入一定量 和
和 ,
, 的平衡转化率将
的平衡转化率将________ (填“变大”“变小”或“不变”)。
A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C. 的体积分数不再发生变化 D.
的体积分数不再发生变化 D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化
(3) 时,按物质的量之比为1︰2向压强为
时,按物质的量之比为1︰2向压强为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。
①计算 的选择性为
的选择性为___________ ( 的选择性
的选择性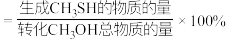 )。
)。
②反应Ⅰ的平衡常数
___________ ( 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。
(4)在 、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。 分压表示的反应速率为
分压表示的反应速率为___________ Mpa/min。
②结合催化机理分析,当温度高于370℃时, 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为___________ 。
③从化学键的角度描述ⅲ→ⅰ脱水的过程:___________ 。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:Ⅰ.

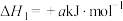
Ⅱ.
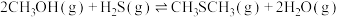
回答下列问题:
(1)计算反应
 的ΔH=
的ΔH= 。
。(2)
 时,向恒容密闭容器中充入一定量
时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是
发生反应,下列事实能说明反应达到平衡状态的是 和
和 ,
, 的平衡转化率将
的平衡转化率将A.容器内气体密度不再发生变化 B.混合气体的平均相对分子质量不再发生变化
C.
 的体积分数不再发生变化 D.
的体积分数不再发生变化 D. 和
和 的物质的量之比不再变化
的物质的量之比不再变化(3)
 时,按物质的量之比为1︰2向压强为
时,按物质的量之比为1︰2向压强为 的恒压密闭容器中充入
的恒压密闭容器中充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性
的选择性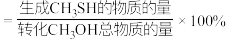 )。
)。②反应Ⅰ的平衡常数

 是用分压表示的平衡常数)。
是用分压表示的平衡常数)。(4)在
 、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
、反应压力为0.7 Mpa条件下,气体按90 mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。

 分压表示的反应速率为
分压表示的反应速率为②结合催化机理分析,当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从化学键的角度描述ⅲ→ⅰ脱水的过程:
您最近一年使用:0次
2023-12-16更新
|
235次组卷
|
3卷引用:福建省宁化市第一中学2023-2024学年高三下学期3月质量检测化学试题



