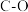解题方法
1 . 硫、氮和磷是生物必须的营养元素,含硫、氮和磷的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①
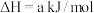
②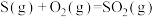
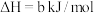
写出H2S(g)完全燃烧的热化学方程式_______ 。
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是_______ 。_______ ;
②若无能量损失,相同条件下,SO2和NO的体积比为_______ 时,两种气体都能被完全处理。
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数( )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。_______ 7(填“<”或“>”或“=”)。
②Na2HPO3其水解平衡常数
_______ (填数值)。
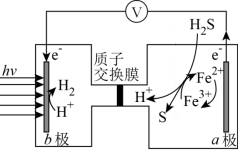
(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为_______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①

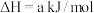
②
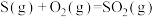
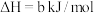
写出H2S(g)完全燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2.为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是


②若无能量损失,相同条件下,SO2和NO的体积比为
(4)某含磷废水的主要成分是H3PO3.25℃时,向一定体积的亚磷酸(H3PO3,二元弱酸)溶液中滴加等物质的量浓度的NaOH溶液,混合液中含磷粒子的物质的量分数(
 )与溶液pH的关系如下图所示。
)与溶液pH的关系如下图所示。
②Na2HPO3其水解平衡常数

(5)太阳能光电催化——化学耦合分解H2S的装置如图所示。该太阳能光电催化——化学耦合分解H2S的过程可描述为
您最近半年使用:0次
2 . 甲醇(CH3OH)在化学工业、农业生产等领域有着广泛应用。回答下列问题:
(1)CH3OH的电子式为___________ 。
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的___________ 。已知相关物质的燃烧热数值如下表,则反应CO(g)+2H2(g) CH3OH(l)的∆H=
CH3OH(l)的∆H=___________ 。
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l) CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。
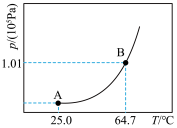
①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是___________ 。
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到___________ (填字母)所示的现象。___________ kPa,馏分中甲醇的物质的量分数为___________ 。
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为___________ kW⋅h⋅kg-1(结果保留一位小数)。已知: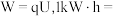 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。
②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的___________ 极相连,Al电极上发生的电极反应方程式为___________ 。
(1)CH3OH的电子式为
(2)工业上可将煤先转化为CO(g)和H2(g),然后在催化剂作用下合成CH3OH(l),该过程称为煤的
 CH3OH(l)的∆H=
CH3OH(l)的∆H=| 物质 | CO(g) | H2(g) | CH3OH(l) |
| 燃烧热/kJ·mol-1 | -283.0 | -285.8 | -726.5 |
(3)常温下,将一定量CH3OH(1)放入真空的恒容密闭中,发生CH3OH(l)
 CH3OH(g) ∆H=+1109.0kJ·mol-1。
CH3OH(g) ∆H=+1109.0kJ·mol-1。①某温度下,甲醇达到液气平衡状态时的压强称为甲醇在该温度下的饱和蒸气压,记为p*。p*与温度T的关系如图所示,B点蒸气压大于A点蒸气压的原因是
i.如图所示,甲烧杯中盛有甲醇,乙烧杯盛有NaOH的甲醇溶液,常温下将两烧杯置于真空密闭容器中,足够长的时间后,可能会观察到

| 物质 | CH3OH(l) | H2O(1) |
| p*(64.7℃)/kPa | 101.30 | 23.90 |
(4)CH3OH可用于制备甲醇燃料电池。
①单位质量燃料所输出电能的多少称为燃料电池的比能量,若某甲醇燃料电池的输出电压为3.60V,其比能量为
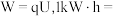 3.6×10⁶J,1mol电子的电量为96500C。
3.6×10⁶J,1mol电子的电量为96500C。②在实验室中用甲醇燃料电池模拟铝制品在稀硫酸溶液中进行的表面钝化处理,Al电极应与甲醇燃料电池的
您最近半年使用:0次
3 . Ⅰ肼可作为火箭发动机的燃料,与N2O4反应生成N2和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:__________ 。
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是________ kJ。
Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g) FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。_______ v逆 (CO2 )(填“>”“<”或“=”)。
(4)0~4min内,CO2的转化率为____________ ,CO的平均反应速率为_________________ 。
(5)下列选项能说明上述反应已达平衡状态的是_______(填字母)。
(6)燃料电池因具有发电效率高。环境污染少等优点而备受人们关注。用于笔记本电脑的甲醇(CH3OH)燃料电池示意图如下,d是_______ 极,此电极反应为_______ 。
①N2(g)+2O2(g)=N2O4(l) ΔH1=−19.5 kJ· mol−1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=−534 kJ· mol−1
(1)写出肼(l)和N2O4(l)完全反应生成N2和水蒸气时的热化学方程式:
(2)已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,O—H为462,则断裂1 mol N—H键所需的能量是
Ⅱ.一定条件下铁可以和CO2发生反应Fe(s)+CO2 (g)
 FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度变化与时间的关系如图所示。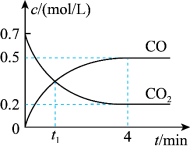
(4)0~4min内,CO2的转化率为
(5)下列选项能说明上述反应已达平衡状态的是_______(填字母)。
| A.v(CO2)=v(CO) |
| B.单位时间内生成n mol Fe的同时生成n mol FeO |
| C.容器中气体压强不随时间的变化而变化 |
| D.容器中CO2浓度不随时间的变化而变化 |

您最近半年使用:0次
名校
解题方法
4 . 甲烷( )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:
(1)实验测得 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量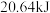 ,则该反应的热化学方程式为
,则该反应的热化学方程式为______________________ 。
(2)已知有关物质的化学键键能数据如下:
试计算反应 的焓变等于
的焓变等于___________ 。
(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:_______________ 。
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是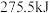 ,硫的燃烧热为
,硫的燃烧热为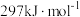 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为___________ 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:______________ 。
 )在生产生活中用途广泛,常用作燃料。利用
)在生产生活中用途广泛,常用作燃料。利用 、
、 与
与 在催化剂作用下可以合成甲烷。回答下列问题:
在催化剂作用下可以合成甲烷。回答下列问题:(1)实验测得
 与
与 反应生成
反应生成 和
和 的反应中,每生成
的反应中,每生成 (标准状况)
(标准状况) ,放出热量
,放出热量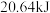 ,则该反应的热化学方程式为
,则该反应的热化学方程式为(2)已知有关物质的化学键键能数据如下:
化学链 |
|
|
|
|
|
键能/ | 436 | 343 | 805 | 413 | 465 |
 的焓变等于
的焓变等于(3)研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
 (液)分解成气态物质需要吸收的能量是
(液)分解成气态物质需要吸收的能量是 ,硫的燃烧热为
,硫的燃烧热为 ,则反应Ⅱ的热化学方程式为
,则反应Ⅱ的热化学方程式为(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图为通过光电转化原理以廉价原料制备新产品的示意图。写出光电转化过程的化学反应方程式:

您最近半年使用:0次
5 . 二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)已知: 、
、 和
和 键的键能分别为
键的键能分别为 、
、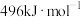 和
和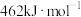 。
。

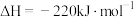

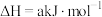
则
___________ 。
(2)已知: 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。___________ (填I或II)时,反应过程中 所能达到的最高浓度更大。
所能达到的最高浓度更大。
②在相同条件下反应达到平衡状态,为提高 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是___________ 。
(3)以 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
I.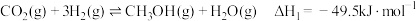
II.
在密闭容器中,压强恒为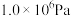 ,
,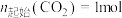 ,
,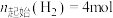 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。 的选择性可表示为
的选择性可表示为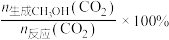 。
。
①反应的最佳温度___________ 。
②反应温度超过 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是___________ 。
③反应温度超过 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是___________ 。
④反应温度在 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时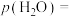
___________  (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数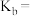
___________ 。
(4)工业废气中含有的 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。___________ 。
②装置b中,x和y为石墨电极,写出电极x的电极反应___________ 。
(1)已知:
 、
、 和
和 键的键能分别为
键的键能分别为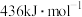 、
、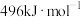 和
和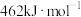 。
。
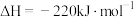

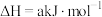
则

(2)已知:
 在催化剂I和II的催化下的反应历程和能量变化如下图。
在催化剂I和II的催化下的反应历程和能量变化如下图。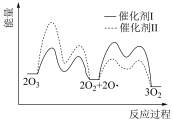
 所能达到的最高浓度更大。
所能达到的最高浓度更大。②在相同条件下反应达到平衡状态,为提高
 的平衡浓度和
的平衡浓度和 的平衡物质的量分数,可以采取的措施是
的平衡物质的量分数,可以采取的措施是(3)以
 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:I.
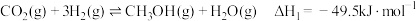
II.

在密闭容器中,压强恒为
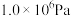 ,
,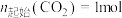 ,
,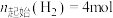 ,
, 平衡转化率、在催化剂作用下反应相同时间所测得的
平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率,随温度的变化如图所示。
实际转化率,随温度的变化如图所示。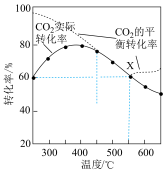
 的选择性可表示为
的选择性可表示为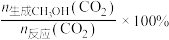 。
。①反应的最佳温度
②反应温度超过
 时,
时, 平衡转化率逐渐增大的原因是
平衡转化率逐渐增大的原因是③反应温度超过
 时,
时, 实际转化率逐渐减小的原因是
实际转化率逐渐减小的原因是④反应温度在
 时,
时, 点
点 的选择性为
的选择性为 ,则平衡时
,则平衡时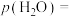
 (保留三位有效数字,后面相同),反应II的压强平衡常数
(保留三位有效数字,后面相同),反应II的压强平衡常数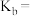
(4)工业废气中含有的
 和
和 可利用如下装置回收利用。
可利用如下装置回收利用。
②装置b中,x和y为石墨电极,写出电极x的电极反应
您最近半年使用:0次
6 . 含硫化合物是实验室和工业上的常用化学品。
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式________ 。
②方法2相对方法1具有的优点是________ 。
③为了使方法2中铜的溶解速率加快,可采取的措施是________ 。
A.升高温度 B.增加铜屑用量 C.将通入气体改为 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)________ 极,发生________ 反应。
②写出正极的电极方程式:________ 。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生 的反应为:
的反应为: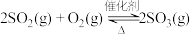 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。 的曲线是
的曲线是________ 。(填a、b或c)
②根据M点的坐标,计算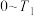 内,用
内,用 表示的反应速率为
表示的反应速率为________  。
。
③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是________ 。
A. 的体积分数保持不变
的体积分数保持不变
B.气体的密度保持不变
C.
D.气体的平均相对分子质量保持不变
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式
②方法2相对方法1具有的优点是
③为了使方法2中铜的溶解速率加快,可采取的措施是
A.升高温度 B.增加铜屑用量 C.将通入气体改为
 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)

②写出正极的电极方程式:
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生
 的反应为:
的反应为: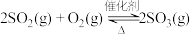 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。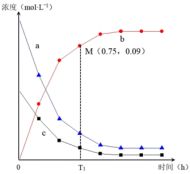
 的曲线是
的曲线是②根据M点的坐标,计算
 内,用
内,用 表示的反应速率为
表示的反应速率为 。
。③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是
A.
 的体积分数保持不变
的体积分数保持不变B.气体的密度保持不变
C.

D.气体的平均相对分子质量保持不变
您最近半年使用:0次
名校
解题方法
7 . 某兴趣小组依据反应 探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。
探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。___________ (填“甲”或“乙”)表示。
(2)若断开K,锌片上___________ (填“有”或“无”,下同)氧化还原反应发生,导线上_________ 电流产生。
(3)连接K,锌片上的电极反应式为___________ 。2min后测得锌片和铜片之间的质量差为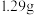 ,则导线中通过电子的物质的量为
,则导线中通过电子的物质的量为___________ mol。
 探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。
探究原电池的工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图1装置。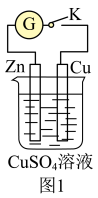

(2)若断开K,锌片上
(3)连接K,锌片上的电极反应式为
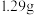 ,则导线中通过电子的物质的量为
,则导线中通过电子的物质的量为
您最近半年使用:0次
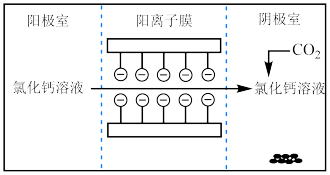
8 . I.电解法可处理氯化钙废液同时,吸收CO2,装置如图所示。_______ 和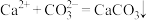 。
。
II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①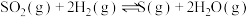

②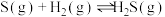

③

请用一个等式来表示三个反应的 之间的关系
之间的关系_______ 。
(3)反应③,在恒温、恒容的密闭容器中,充入 和
和 ,平衡常数
,平衡常数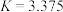 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为_______ 。
方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由_______ 。
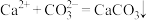 。
。II.工业含硫烟气污染大气,研究烟气脱硫具有重要意义。
方法一、H2还原脱硫:
(2)300℃,发生反应:①
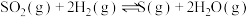

②
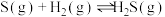

③


请用一个等式来表示三个反应的
 之间的关系
之间的关系(3)反应③,在恒温、恒容的密闭容器中,充入
 和
和 ,平衡常数
,平衡常数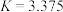 ,测得平衡时
,测得平衡时 和
和 的浓度均为
的浓度均为 ,则平衡时
,则平衡时 的值为
的值为方法二、O2氧化脱硫:
(4)某同学探究活性炭吸附催化氧化
 ,以N2作稀释剂,一定温度下,通入
,以N2作稀释剂,一定温度下,通入 、
、 和
和 反应生成
反应生成 ,其中不同温度下,
,其中不同温度下, 在活性炭上的吸附情况如图,下列说法正确的是_______。
在活性炭上的吸附情况如图,下列说法正确的是_______。
| A.温度越低,SO2的吸附量越高,SO2氧化反应速率越快 |
| B.已知:SO2的物理吸附过程能自发进行,可推断该过程是熵减、放热的过程,温度过高不利 |
| C.原料中水蒸气的含量越大,脱硫速率一定越快 |
D.随着时间的推移,SO2吸附速率降低,可能是由于生成的 占据了吸附位点没及时脱出导致 占据了吸附位点没及时脱出导致 |
(5)在SO2与O2反应过程中掺入少量CH4有利于提高SO2转化成SO3,其中一种解释是甲烷参与氧化反应过程中存在如图机理。原料以一定流速通过反应容器,出口处测SO3的含量,结合机理说明甲烷体积分数增大,SO3体积分数也增大的理由

您最近半年使用:0次
7日内更新
|
123次组卷
|
2卷引用:浙江绍兴市2023-2024学年高三下学期选考科目适应性考试化学试题
9 . Ⅰ.工业上用CO生产燃料甲醇,一定条件下发生反应: 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。
(1)在图1中,曲线________ (填“a”或“b”)表示使用了催化剂。
(2)该反应属于________ (填“吸热”或“放热”)反应。
(3)增大反应体系压强,则该反应化学平衡常数________ (填“增大”“减小”或“不变”)。根据图2计算该反应的化学平衡常数数值为K=________
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是________ (填字母)。
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:________ (填“CH4”或“O2),a处的电极反应式为________ 。
②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为________ 。
 。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和
。图1表示反应中能量变化;图2表示一定温度下,在容积为2L的密闭容器中加入4molH2和一定量的CO后,CO和 的浓度随时间变化。
的浓度随时间变化。 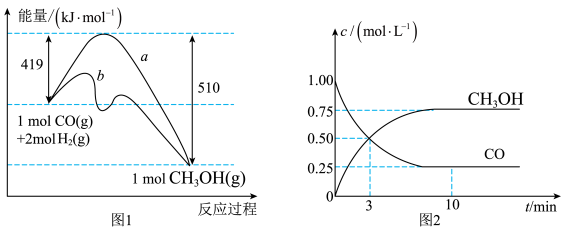
(1)在图1中,曲线
(2)该反应属于
(3)增大反应体系压强,则该反应化学平衡常数
Ⅱ.CuSO4溶液是一种重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究:
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
a.溶液中Cu2+向阳极移动
b.粗铜接电源正极,发生还原反应
c.电解后CuSO4溶液的浓度减小
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)图中,A是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,该同学想在B中实现铁上镀铜:

②当铜电极的质量减轻3.2g,则消耗的CH4在标准状况下的体积为
您最近半年使用:0次
名校
解题方法
10 . 任何化学反应都伴随着能量的变化,通过化学反应,化学能可以与热能、电能等不同形式的能量相互转化,用于生产、生活和科研。请回答下列问题:
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用_____ (填“放热”或“吸热”)的化学变化或物理变化的原理。
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将_____ 直接转变为电能(填:“化学能”“太阳能”“热能”等)
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
一定温度下,利用催化剂将 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
_____ 。
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“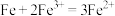 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液_____ 。______ (填“正”或“负”)极,其电极反应式为_____ 。
②电池工作过程中,若A极区产生14 g ,则转移的电子数目为
,则转移的电子数目为______ 。
③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为______ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋利用
(2)世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。光伏电池能将
(3)氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过氨热分解法制氢气。相关化学键的键能数据
| 化学键 |  |  |  |
键能E/(kJ·mol ) ) | 946.0 | a | 390.8 |
 分解为
分解为 和3 mol
和3 mol  ,吸收90.8 kJ热量,则
,吸收90.8 kJ热量,则
(4)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“
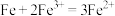 ”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
”设计一个原电池,并在下面方框内画出简单原电池实验装置图,注明电极材料和电解质溶液
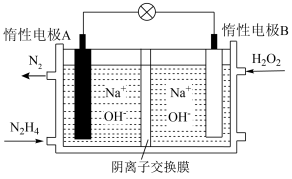
②电池工作过程中,若A极区产生14 g
 ,则转移的电子数目为
,则转移的电子数目为③有人提出可用甲烷去替代肼,此时惰性电极A发生的电极反应式为
您最近半年使用:0次
7日内更新
|
349次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题