名校
解题方法
1 . Ⅰ.反应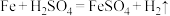 的能量变化如图所示:
的能量变化如图所示:______ 反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______ (填“正”或“负”)极,铜电极上反应的电极反应式为:____________ 。
(3)若要使Fe与稀硫酸的反应速率加快,下列措施可行的是______。
Ⅱ.在一定温度下将2 mol A气体和4 mol B气体在2 L体积不变的密闭容器中混合并发生反应: 。若经2 min后测得C的浓度为0.6 mol·L
。若经2 min后测得C的浓度为0.6 mol·L ,则:
,则:
(4)用物质A表示的反应速率为______ 。
(5)2 min时物质B的浓度为______ 。B的转化率为______ 。
(6)当下列哪些项表明上述反应已达到平衡状态______ 。
A.单位时间内消耗1 mol B同时生成1.5 mol C
B.生成物D的浓度不再发生变化
C.正反应速率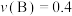 mol⋅L
mol⋅L ⋅min
⋅min ,逆反应速率
,逆反应速率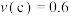 mol⋅L
mol⋅L ⋅min
⋅min
D.混合气体的总物质的量不再发生变化
E.用A、B、C表示的速率比为1∶2∶3
(7)下列说法正确的是______。
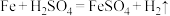 的能量变化如图所示:
的能量变化如图所示:
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
(3)若要使Fe与稀硫酸的反应速率加快,下列措施可行的是______。
| A.改铁片为铁粉 | B.改稀硫酸为98%的硫酸 |
| C.增大压强 | D.滴加几滴 溶液 溶液 |
Ⅱ.在一定温度下将2 mol A气体和4 mol B气体在2 L体积不变的密闭容器中混合并发生反应:
 。若经2 min后测得C的浓度为0.6 mol·L
。若经2 min后测得C的浓度为0.6 mol·L ,则:
,则:(4)用物质A表示的反应速率为
(5)2 min时物质B的浓度为
(6)当下列哪些项表明上述反应已达到平衡状态
A.单位时间内消耗1 mol B同时生成1.5 mol C
B.生成物D的浓度不再发生变化
C.正反应速率
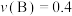 mol⋅L
mol⋅L ⋅min
⋅min ,逆反应速率
,逆反应速率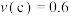 mol⋅L
mol⋅L ⋅min
⋅min
D.混合气体的总物质的量不再发生变化
E.用A、B、C表示的速率比为1∶2∶3
(7)下列说法正确的是______。
| A.当一个化学反应在一定条件下达到限度时,反应即停止 |
| B.化学反应的限度与时间长短无关 |
| C.增大B的浓度,正反应速率加快,逆反应速率减慢 |
| D.化学反应的限度是不可能改变的 |
您最近半年使用:0次
解题方法
2 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g) H= +133 kJ/mol
H= +133 kJ/mol
H2O(g)=H2O(l) H=- 44 kJ/mol
H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是___________ 。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO 。物质A的化学式为
。物质A的化学式为___________ ,阴极的电极反应式是___________ 。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g)
 H= +133 kJ/mol
H= +133 kJ/molH2O(g)=H2O(l)
 H=- 44 kJ/mol
H=- 44 kJ/mol催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO 。物质A的化学式为
。物质A的化学式为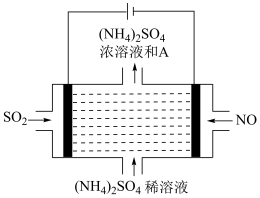
您最近半年使用:0次
3 . 研究氮氧化物污染及其治理是环保的一项重要工作,将 污染物转化为无害的
污染物转化为无害的 或高附加值的含氮化学品具有重要意义。
或高附加值的含氮化学品具有重要意义。
(1)氢气可以消除氮氧化物污染,其中 反应体系能量随反应过程的变化情况如图:
反应体系能量随反应过程的变化情况如图:__________ (填“吸热”或“放热”)反应;
②已知: 、
、 、
、 、
、 中的化学键全部断裂形成气态原子所需要的能量如下表所示:
中的化学键全部断裂形成气态原子所需要的能量如下表所示:
当该反应消耗 的能量变化为
的能量变化为__________ kJ(用含a、b、c、d的代数式表示).
(2)经实验证明, 的正反应速率可以表示为
的正反应速率可以表示为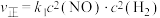 ,逆反应速率可以表示为
,逆反应速率可以表示为 (
( 、
、 为速率常数.其大小与浓度变化无关);若压缩容器的容积,
为速率常数.其大小与浓度变化无关);若压缩容器的容积,
__________ (填“增大”“减小”或“不变”,下同),
__________ ;速率的变化量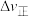
__________ 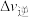 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)在 恒容密闭的恒温容器中,投入
恒容密闭的恒温容器中,投入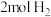 和
和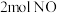 发生
发生 ,其中
,其中 随时间的变化如下表:
随时间的变化如下表:
该反应条件下反应达到平衡时,NO的转化率为__________ ; 的体积百分含量为
的体积百分含量为__________ %(保留2位有效数字)。
(4)直接电催化NO使其转化为有价值的 是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的
是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移;
,并向两极迁移;__________ 反应(填“氧化”或“还原”);
②写出负极的电极反应式:__________ 。
 污染物转化为无害的
污染物转化为无害的 或高附加值的含氮化学品具有重要意义。
或高附加值的含氮化学品具有重要意义。(1)氢气可以消除氮氧化物污染,其中
 反应体系能量随反应过程的变化情况如图:
反应体系能量随反应过程的变化情况如图:
②已知:
 、
、 、
、 、
、 中的化学键全部断裂形成气态原子所需要的能量如下表所示:
中的化学键全部断裂形成气态原子所需要的能量如下表所示:物质 |
|
|
|
|
能量 | a | b | c | d |
 的能量变化为
的能量变化为(2)经实验证明,
 的正反应速率可以表示为
的正反应速率可以表示为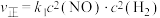 ,逆反应速率可以表示为
,逆反应速率可以表示为 (
( 、
、 为速率常数.其大小与浓度变化无关);若压缩容器的容积,
为速率常数.其大小与浓度变化无关);若压缩容器的容积,

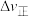
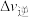 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)在
 恒容密闭的恒温容器中,投入
恒容密闭的恒温容器中,投入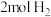 和
和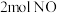 发生
发生 ,其中
,其中 随时间的变化如下表:
随时间的变化如下表:时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 2.00 | 1.80 | 1.50 | 1.44 | 1.40 | 1.40 |
 的体积百分含量为
的体积百分含量为(4)直接电催化NO使其转化为有价值的
 是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的
是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移;
,并向两极迁移;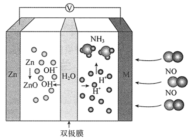
②写出负极的电极反应式:
您最近半年使用:0次
名校
解题方法
4 . Ⅰ.断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称为A—B的键能。下表列出了一些化学键的键能(E):
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸收”或“放出”)_______ kJ能量(用含有a、b的关系式表示)。 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=_______ 。
(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为_______ 。
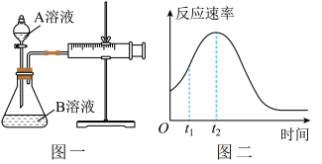
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(4)该实验探究的是_______ 因素对化学反应速率的影响。如下图一,相同时间内针筒中所得的CO2体积大小关系是_______ (填实验序号)。 =
=_______ (假设混合液体积为50mL)。
(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定_______ 来比较化学反应速率。
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/(kJ·mol-1) | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应
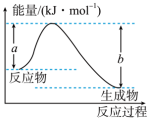
 O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=
O2(g)=H2O(g)放出241.8 kJ能量,则根据所给键能数据可得x=(3)历史上曾用“地康法”制氯气,这一方法是用CuCl2作催化剂,在450 ℃时利用空气中的氧气与氯化氢反应制氯气。反应的化学方程式为
Ⅱ.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol·L-1H2C2O4溶液 | 30mL 0.1 mol·L-1KMnO4溶液 |
| ② | 20mL 0.2mol·L-1H2C2O4溶液 | 30mL 0.1mol·L-1KMnO4溶液 |
 =
=(6)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定
(7)小组同学发现反应速率总是如上图二,其中t1~t2时间内速率变快的主要原因可能是①产物MnSO4是该反应的催化剂、②
您最近半年使用:0次
5 . 含硫化合物是实验室和工业上的常用化学品。
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式________ 。
②方法2相对方法1具有的优点是________ 。
③为了使方法2中铜的溶解速率加快,可采取的措施是________ 。
A.升高温度 B.增加铜屑用量 C.将通入气体改为 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)________ 极,发生________ 反应。
②写出正极的电极方程式:________ 。
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生 的反应为:
的反应为: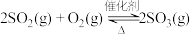 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。 的曲线是
的曲线是________ 。(填a、b或c)
②根据M点的坐标,计算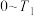 内,用
内,用 表示的反应速率为
表示的反应速率为________  。
。
③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是________ 。
A. 的体积分数保持不变
的体积分数保持不变
B.气体的密度保持不变
C.
D.气体的平均相对分子质量保持不变
请回答:
(1)通过以下两种方法均可以制得硫酸铜
方法1:铜屑与浓硫酸在加热条件下反应
方法2:铜屑在不断通入空气的稀硫酸溶液中加热反应
①方法1制取过程中发生反应的化学方程式
②方法2相对方法1具有的优点是
③为了使方法2中铜的溶解速率加快,可采取的措施是
A.升高温度 B.增加铜屑用量 C.将通入气体改为
 D.加入
D.加入
(2)根据电化学原理,某同学将方法2中的反应设计成原电池装置(见图)

②写出正极的电极方程式:
(3)工业上主要采用接触法由含硫矿石制备硫酸。
其中接触室中产生
 的反应为:
的反应为: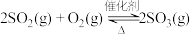 ,将一定浓度的
,将一定浓度的 和
和 通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。
通入恒容密闭容器中,气体中各成分的浓度变化如右图所示。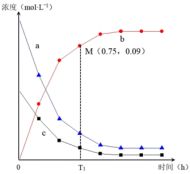
 的曲线是
的曲线是②根据M点的坐标,计算
 内,用
内,用 表示的反应速率为
表示的反应速率为 。
。③控制温度850K反应一段时间,则下列选项能说明上述反应已经达到平衡的是
A.
 的体积分数保持不变
的体积分数保持不变B.气体的密度保持不变
C.

D.气体的平均相对分子质量保持不变
您最近半年使用:0次
6 . 某团队报道了高温富水环境下, 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:
i.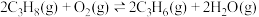

ii.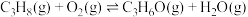

回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因___________ 。
(2)已知:丙烷、丙烯的燃烧热分别为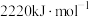 、
、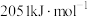 。18g液态水变为
。18g液态水变为 吸收热量44kJ。则
吸收热量44kJ。则
___________  。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是___________ (填标号)。
A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
①一定温度下,反应速率与浓度( )关系如下表所示:
)关系如下表所示:
根据数据计算,α+β+γ+δ=___________ 。
②速率常数与温度、活化能关系式为 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图:___________ (填“Cat1”或“Cat2”)。
(4)在密闭容器中充入 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:___________ 。
② 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为___________ 。
 催化丙烷氧化脱氢原理,涉及反应如下:
催化丙烷氧化脱氢原理,涉及反应如下:i.
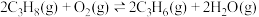

ii.
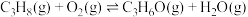

回答下列问题:
(1)上述反应过程中涉及的C、N、O元素可以组成多种配体,如CO、
 、
、 等,CO、
等,CO、 的配位原子是C,而
的配位原子是C,而 的配位原子是N,简述其原因
的配位原子是N,简述其原因(2)已知:丙烷、丙烯的燃烧热分别为
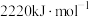 、
、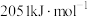 。18g液态水变为
。18g液态水变为 吸收热量44kJ。则
吸收热量44kJ。则
 。下列关于反应i自发性判断正确的是
。下列关于反应i自发性判断正确的是A.任何温度都能自发进行 B.任何温度都不能自发进行
C.在较高温度下能自发进行 D.在较低温度下能自发进行
(3)已知反应i速率方程为
 (k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。
(k为速率常数只与温度、催化剂有关;α、β、γ、δ为反应级数,可以为正数、负数或分数)。①一定温度下,反应速率与浓度(
 )关系如下表所示:
)关系如下表所示:| 序号 |  | 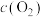 | 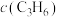 | 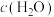 | v |
| Ⅰ | 0.1 | 0.1 | 0.1 | 0.1 | k |
| Ⅱ | 0.2 | 0.1 | 0.1 | 0.1 | 4k |
| Ⅲ | 0.2 | 0.4 | 0.1 | 0.1 | 8k |
| Ⅳ | 0.4 | 0.1 | 0.2 | 0.1 | 8k |
| Ⅴ | 0.4 | 0.4 | 0.1 | 0.2 | 16k |
②速率常数与温度、活化能关系式为
 (R、C为常数,T为温度,
(R、C为常数,T为温度, 为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与
为活化能且不随温度变化而变化)。在不同催化剂Cat1、Cat2作用下,Ink与 关系如图:
关系如图: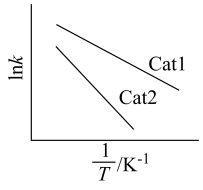
(4)在密闭容器中充入
 和
和 ,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示:
,仅发生上述反应i和ii,测得丙烷的平衡转化率与温度、压强关系如图所示: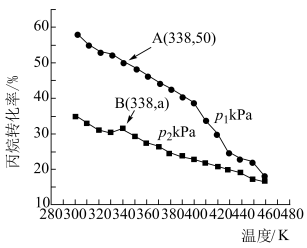
②
 下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
下,A点丙烯的选择性为80%(选择性等于丙烯的物质的量与丙烷转化的总物质的量之比)。B点时,反应ii的压强平衡常数
(5)在熔融碳酸钠中,丙烷-空气燃料电池的放电效率高。该燃料电池放电时,负极的电极反应式为
您最近半年使用:0次
名校
解题方法
7 . 按要求填空
(1)少量铁溶于稀硝酸的化学方程式为_____________________ 。
(2) 通入
通入 溶液的离子反应方程式为
溶液的离子反应方程式为_______________________ 。
(3)铜和浓硫酸的化学方程式为___________________________ ;若要证明该反应产物有 ,需要采取的操作是
,需要采取的操作是__________ 。
(4)工业生产中利用氨水吸收少量 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是________________________________________________________ 。_______________________ 。
②2min内Y的转化率为___________________ 。
(1)少量铁溶于稀硝酸的化学方程式为
(2)
 通入
通入 溶液的离子反应方程式为
溶液的离子反应方程式为(3)铜和浓硫酸的化学方程式为
 ,需要采取的操作是
,需要采取的操作是(4)工业生产中利用氨水吸收少量
 和
和 ,原理如图所示。
,原理如图所示。 被吸收过程的离子方程式是
被吸收过程的离子方程式是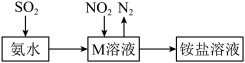

②2min内Y的转化率为
您最近半年使用:0次
8 . 黄铵铁矾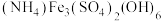 和
和 常用作净水剂。
常用作净水剂。
已知: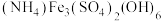 热分解过程发生的反应如下:
热分解过程发生的反应如下:
①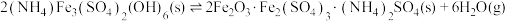
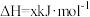
②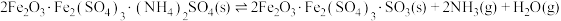
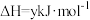
③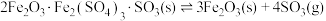
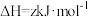
回答下列问题:
(1)基态 的M层电子排布式为
的M层电子排布式为_______ , 中N原子的
中N原子的_______ 轨道与H原子的s轨道重叠形成σ键。
(2) 的
的
_______  。
。
(3)一定温度下,在恒容密闭容器中加入一定量的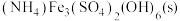 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。
(4)500℃时,在体积可变的密闭容器中加入一定量的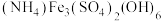 固体,只发生反应:
固体,只发生反应: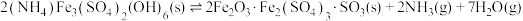 ,达到平衡时测得
,达到平衡时测得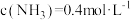 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时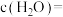
_______  。
。
(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下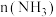 与
与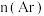 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的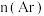 增大,
增大,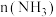 也增大的原因是
也增大的原因是_______ 。 的分解过程会发生下列反应:
的分解过程会发生下列反应:
主反应:

副反应:

两个反应的平衡常数比值 随反应温度升高而
随反应温度升高而_______ (填“增大”“减小”或“不变”);若平衡时总压为25kPa, 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
_______ 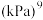 。
。
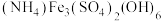 和
和 常用作净水剂。
常用作净水剂。已知:
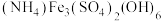 热分解过程发生的反应如下:
热分解过程发生的反应如下:①
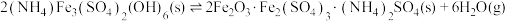
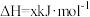
②
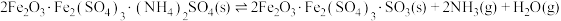
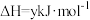
③
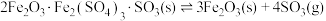
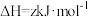
回答下列问题:
(1)基态
 的M层电子排布式为
的M层电子排布式为 中N原子的
中N原子的(2)
 的
的
 。
。(3)一定温度下,在恒容密闭容器中加入一定量的
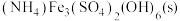 ,只发生反应:
,只发生反应: ,下列可判断该反应达到平衡状态的是_______(填序号)。
,下列可判断该反应达到平衡状态的是_______(填序号)。A. 质量不随时间变化 质量不随时间变化 | B. 体积分数不随时间变化 体积分数不随时间变化 |
| C.混合气体密度不随时间变化 | D.气体平均摩尔质量不随时间变化 |
(4)500℃时,在体积可变的密闭容器中加入一定量的
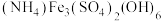 固体,只发生反应:
固体,只发生反应: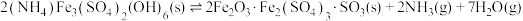 ,达到平衡时测得
,达到平衡时测得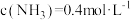 。保持温度不变,将容器体积变为原来的一半,达到新平衡时
。保持温度不变,将容器体积变为原来的一半,达到新平衡时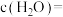
 。
。(5)一定温度下,总压强恒定时,向体积可变的密闭容器中加入一定量的
 和
和 氩气,仅发生反应②。测得平衡状态下
氩气,仅发生反应②。测得平衡状态下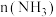 与
与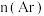 的关系如下图所示。随着通入的
的关系如下图所示。随着通入的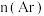 增大,
增大,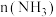 也增大的原因是
也增大的原因是
 的分解过程会发生下列反应:
的分解过程会发生下列反应:主反应:


副反应:


两个反应的平衡常数比值
 随反应温度升高而
随反应温度升高而 的体积分数为0.4,主反应的平衡常数
的体积分数为0.4,主反应的平衡常数
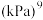 。
。
您最近半年使用:0次
2024-04-18更新
|
54次组卷
|
2卷引用:2024届”3+3+3“高考备考诊断性联考卷(二)理综试题-高中化学
9 . Ⅰ.硒(Se)是一种重要的化学元素,在医药、农业、能源和电子等领域有广泛应用。
(1)以下不能用元素周期律解释的是___________。
(2)硒化铅可用作玻璃和陶瓷的着色剂,其晶胞结构如图所示:___________ 。
A.离子键 B.共价键
②晶体中每个Se周围与其最近的,且距离相等的Se有___________ 个。
Ⅱ.工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、Ag2Se等)回收Se。
② 室温下Ksp(Ag2SO4)=10−5;Ksp(AgCl)=10−9.75。
(3)“焙烧”前,将阳极泥中大块颗粒粉碎的目的是___________ 。
(4)“烟气”中含有SO2和SeO2,被水吸收发生反应,SO2与和SeO2的物质的量之比为___________ ,SeO2体现了___________ 。
A.氧化性 B.还原性
(5)“提纯”步骤中用到真空蒸馏工艺,真空的作用是___________ 、___________ 。
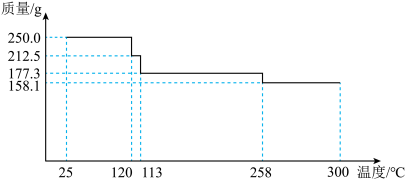
(6)小组同学测定某CuSO4∙xH2O晶体样品热分解的质量变化情况(如图所示),258℃失去全部结晶水,x=___________ 。(结果保留2位小数)___________ 。
Ⅲ.亚硒酸(H2SeO3)是主要的含硒化合物,是二元弱酸。常温下,H2SeO3溶液中某些微粒的物质的量分数与pH的关系如图所示:
(9)向滴有酚酞的H2SeO3溶液中加入氨水,当溶液由粉红色变为红色时,反应的离子方程式为___________ 。
(1)以下不能用元素周期律解释的是___________。
| A.键的极性:H−Se < H−Br | B.原子半径:Se > Br |
| C.稳定性:H2Se < HBr | D.酸性:H2SeO3 < HBrO4 |
(2)硒化铅可用作玻璃和陶瓷的着色剂,其晶胞结构如图所示:
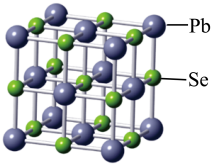
A.离子键 B.共价键
②晶体中每个Se周围与其最近的,且距离相等的Se有
Ⅱ.工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、Ag2Se等)回收Se。
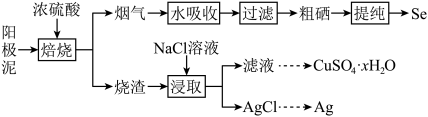
② 室温下Ksp(Ag2SO4)=10−5;Ksp(AgCl)=10−9.75。
(3)“焙烧”前,将阳极泥中大块颗粒粉碎的目的是
(4)“烟气”中含有SO2和SeO2,被水吸收发生反应,SO2与和SeO2的物质的量之比为
A.氧化性 B.还原性
(5)“提纯”步骤中用到真空蒸馏工艺,真空的作用是
(6)小组同学测定某CuSO4∙xH2O晶体样品热分解的质量变化情况(如图所示),258℃失去全部结晶水,x=
Ⅲ.亚硒酸(H2SeO3)是主要的含硒化合物,是二元弱酸。常温下,H2SeO3溶液中某些微粒的物质的量分数与pH的关系如图所示:
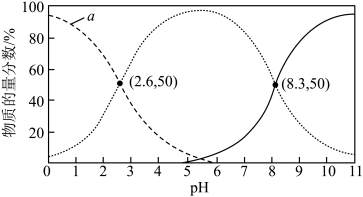
A.曲线a表示的是SeO 物质的量分数随pH变化 物质的量分数随pH变化 |
| B.Ka1=10−5.5 |
C.pH=3时, =100.4 =100.4 |
D.向H2SeO3溶液中逐滴加入NaOH溶液,pH=8.3时溶液中存在:2c(Na+)=3[c(HSeO )+ c(SeO )+ c(SeO )+ c(H2SeO3)] )+ c(H2SeO3)] |
(9)向滴有酚酞的H2SeO3溶液中加入氨水,当溶液由粉红色变为红色时,反应的离子方程式为
您最近半年使用:0次
解题方法
10 . 联氨(N2H4)又称肼,在航天、能源等领域具有广泛应用。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。___________
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
(3)酸碱质子理论提出:凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱。
①由N2H4+H2O N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是___________ 。
A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为___________ 。
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是___________ 。
②N2H4和N2O4作为火箭推进剂的主要原因是___________ 。
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是_______ 。
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平_______ 。
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O
当转移7.224×1024个电子数时,生成金属钴___________ 克。
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是___________ 。
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有___________ 。
Ⅰ.N2H4分子中所有原子均达到稀有气体原子的稳定结构。
(1)写出N2H4的电子式。
(2)N2H4晶体受热熔化时,破坏的作用力有___________。
| A.范德华力 | B.氢键 | C.共价键 | D.离子键 |
①由N2H4+H2O
 N2H
N2H +OH- 可知N2H4是
+OH- 可知N2H4是A.酸 B.碱
②选择足量的盐酸或NaOH溶液与N2H4充分反应,生成盐的化学式为
Ⅱ.肼具有强还原性,可作火箭推进剂燃料,反应的热化学方程式表示为:2N2H4(l)+N2O4(g)=3N2(g)+4H2O(g) ∆H<0。
(4)①结合化学反应原理分析,该反应可自发进行的原因是
②N2H4和N2O4作为火箭推进剂的主要原因是
Ⅲ.肼可还原钴离子制备纳米金属钴,纳米金属钴具有特殊的物理、化学和表面性质。
(5)下列状态的钴中,电离最外层一个电子所需能量最小的是
A.[Ar]3d74s2 B.[Ar]3d74s14p1 C.[Ar]3d74s1
(6)Co2+被N2H4还原的离子方程式如下,完成方程式并配平
 Co2++
Co2++ N2H4+
N2H4+ ___________=
___________= Co↓+
Co↓+ N2↑+
N2↑+ H2O
H2O当转移7.224×1024个电子数时,生成金属钴
(7)金属钴可以形成多种配合物。一种配合物由Co3+、NH3、Cl-、H2O组成,实验显示Co3+、NH3、Cl-、H2O的物质的量之比为1∶3∶3∶1.向该配合物的水溶液加入AgNO3溶液,只能沉淀出三分之一的Cl-。
①该配合物的化学式是
A.[Co(NH3)3ClH2O]Cl2 B.[Co(NH3)3Cl2H2O]Cl C.[Co(NH3)3H2O]Cl3
②该配合物的配体有
您最近半年使用:0次