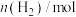名校
解题方法
1 . 保持温度240℃不变,在容积为2L的恒容密闭容器中充入 和
和 (物质的量之比为1∶3)发生反应:
(物质的量之比为1∶3)发生反应: ,其中
,其中 的物质的量(n)随时间(t)的变化关系如图1中曲线Ⅰ所示,反应过程中的能量变化如图2所示。下列说法错误的是
的物质的量(n)随时间(t)的变化关系如图1中曲线Ⅰ所示,反应过程中的能量变化如图2所示。下列说法错误的是
 和
和 (物质的量之比为1∶3)发生反应:
(物质的量之比为1∶3)发生反应: ,其中
,其中 的物质的量(n)随时间(t)的变化关系如图1中曲线Ⅰ所示,反应过程中的能量变化如图2所示。下列说法错误的是
的物质的量(n)随时间(t)的变化关系如图1中曲线Ⅰ所示,反应过程中的能量变化如图2所示。下列说法错误的是
| A.该反应是放热反应 |
B. 平衡转化率为87.5% 平衡转化率为87.5% |
C.0~30min内用H₂表示的平均反应速率 mol⋅L mol⋅L ⋅min ⋅min |
| D.图2中若水的状态为液态,则能量变化曲线可能为① |
您最近半年使用:0次
2 . 研究氮氧化物污染及其治理是环保的一项重要工作,将 污染物转化为无害的
污染物转化为无害的 或高附加值的含氮化学品具有重要意义。
或高附加值的含氮化学品具有重要意义。
(1)氢气可以消除氮氧化物污染,其中 反应体系能量随反应过程的变化情况如图:
反应体系能量随反应过程的变化情况如图:__________ (填“吸热”或“放热”)反应;
②已知: 、
、 、
、 、
、 中的化学键全部断裂形成气态原子所需要的能量如下表所示:
中的化学键全部断裂形成气态原子所需要的能量如下表所示:
当该反应消耗 的能量变化为
的能量变化为__________ kJ(用含a、b、c、d的代数式表示).
(2)经实验证明, 的正反应速率可以表示为
的正反应速率可以表示为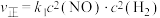 ,逆反应速率可以表示为
,逆反应速率可以表示为 (
( 、
、 为速率常数.其大小与浓度变化无关);若压缩容器的容积,
为速率常数.其大小与浓度变化无关);若压缩容器的容积,
__________ (填“增大”“减小”或“不变”,下同),
__________ ;速率的变化量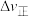
__________ 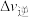 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)在 恒容密闭的恒温容器中,投入
恒容密闭的恒温容器中,投入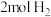 和
和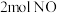 发生
发生 ,其中
,其中 随时间的变化如下表:
随时间的变化如下表:
该反应条件下反应达到平衡时,NO的转化率为__________ ; 的体积百分含量为
的体积百分含量为__________ %(保留2位有效数字)。
(4)直接电催化NO使其转化为有价值的 是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的
是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移;
,并向两极迁移;__________ 反应(填“氧化”或“还原”);
②写出负极的电极反应式:__________ 。
 污染物转化为无害的
污染物转化为无害的 或高附加值的含氮化学品具有重要意义。
或高附加值的含氮化学品具有重要意义。(1)氢气可以消除氮氧化物污染,其中
 反应体系能量随反应过程的变化情况如图:
反应体系能量随反应过程的变化情况如图:
②已知:
 、
、 、
、 、
、 中的化学键全部断裂形成气态原子所需要的能量如下表所示:
中的化学键全部断裂形成气态原子所需要的能量如下表所示:物质 |
|
|
|
|
能量 | a | b | c | d |
 的能量变化为
的能量变化为(2)经实验证明,
 的正反应速率可以表示为
的正反应速率可以表示为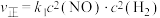 ,逆反应速率可以表示为
,逆反应速率可以表示为 (
( 、
、 为速率常数.其大小与浓度变化无关);若压缩容器的容积,
为速率常数.其大小与浓度变化无关);若压缩容器的容积,

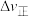
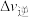 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)在
 恒容密闭的恒温容器中,投入
恒容密闭的恒温容器中,投入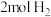 和
和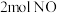 发生
发生 ,其中
,其中 随时间的变化如下表:
随时间的变化如下表:时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 2.00 | 1.80 | 1.50 | 1.44 | 1.40 | 1.40 |
 的体积百分含量为
的体积百分含量为(4)直接电催化NO使其转化为有价值的
 是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的
是一种有吸引力的策略,装置如图所示,双极膜由阴离子交换膜和阳离子交换膜组成,放电时,双极膜中间层的 解离为
解离为 和
和 ,并向两极迁移;
,并向两极迁移;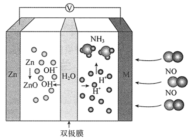
②写出负极的电极反应式:
您最近半年使用:0次
3 . 在25℃时,恒容密闭容器中X、Y、Z三种气体的初始浓度和2min后达到平衡的浓度如表所示,下列说法不正确的是
| 物质 | X | Y | Z |
初始浓度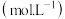 | 1 | 2 | 0 |
平衡浓度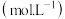 | 0.5 | 0.5 | 1 |
A.反应可表示为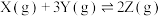 | B.Y的平衡转化率为75% |
| C.反应前后气体总压强之比为3∶2 | D.化学平衡常数为4 |
您最近半年使用:0次
4 . 一定温度下,在2L的恒容密闭容器中充入1 mol CO和2mol H2,发生反应:CO(g)+2H2(g) CH3OH(g),
CH3OH(g),
测得CO(g)和CH3OH(g)的物质的量随时间变化如图1所示,反应过程中的能量变化如图2所示。___________ mol/(L·min)。
(2)改变下列条件对反应速率无影响的是___________ (填标号)。
(3)下列描述中能说明上述反应达到平衡状态的是___________(填标号)。
(4)平衡时H2的转化率为___________ ,平衡时压强与起始时压强之比为___________ 。
(5)已知断开1 mol CO(g)和2 mol H2(g)中的化学键需要吸收的能量为1944 kJ,则断开1 mol CH3OH(g)中的化学键所需要吸收___________ kJ的能量。
(6)CH3OH和O2形成的燃料电池的结构如下图所示。则电极c的反应式为___________ ,若转移2 mol电子,则消耗的O2在标准状况下的体积为___________ L。
 CH3OH(g),
CH3OH(g),测得CO(g)和CH3OH(g)的物质的量随时间变化如图1所示,反应过程中的能量变化如图2所示。
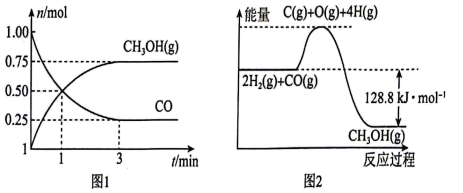
(2)改变下列条件对反应速率无影响的是___________ (填标号)。
| A.升高温度 | B.加入合适的催化剂 |
| C.保持压强不变,充入氩气 | D.保持体积不变,充入氩气 |
| A.混合气体的密度不随时间的变化而变化 |
| B.混合气体的压强不随时间的变化而变化 |
| C.单位时间内消耗2 mol H2的同时生成1 mol CH3OH |
| D.混合气体的平均相对分子质量不随时间的变化而变化 |
(5)已知断开1 mol CO(g)和2 mol H2(g)中的化学键需要吸收的能量为1944 kJ,则断开1 mol CH3OH(g)中的化学键所需要吸收
(6)CH3OH和O2形成的燃料电池的结构如下图所示。则电极c的反应式为
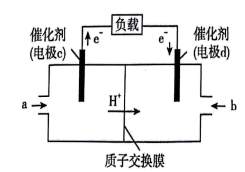
您最近半年使用:0次
5 . (1)已知:
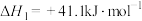


写出 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:___________ ;
(2)恒温条件下,可逆反应: 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是___________ ;
A.单位时间内生成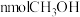 的同时生成
的同时生成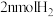
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E. 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。
(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为___________ ;
②如表所列数据是反应在不同温度下的化学平衡常数( )
)
a.由表中数据判断该反应的
___________ 0(填“>”、“=”或“<”);
b.某温度下,将 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为___________ ,此时的温度为___________ ;
③要提高 的转化率,可以采取的措施是
的转化率,可以采取的措施是___________ ;
a.升温 b.加入催化剂 c.增加 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇

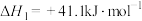


写出
 催化氢化合成甲醇和水的热化学方程式:
催化氢化合成甲醇和水的热化学方程式:(2)恒温条件下,可逆反应:
 在体积固定的密闭容器中进行,达到平衡状态的标志的是
在体积固定的密闭容器中进行,达到平衡状态的标志的是A.单位时间内生成
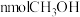 的同时生成
的同时生成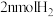
B.混合气体的密度不再改变的状态
C.混合气体的压强不再改变的状态
D.混合气体的平均摩尔质量不再改变的状态
E.
 、
、 、
、 浓度之比为
浓度之比为 的状态。
的状态。(3)工业上在恒容密闭容器中用下列反应合成甲醇:


①该反应的平衡常数表达式为
②如表所列数据是反应在不同温度下的化学平衡常数(
 )
)| 温度 | 250℃ | 300℃ | 350℃ |
 | 2.041 | 0.270 | 0.012 |

b.某温度下,将
 和
和 充入
充入 的密闭容器中,充分反应
的密闭容器中,充分反应 后达到平衡时测得
后达到平衡时测得 ,则
,则 的转化率为
的转化率为③要提高
 的转化率,可以采取的措施是
的转化率,可以采取的措施是a.升温 b.加入催化剂 c.增加
 的浓度 d.恒容充入
的浓度 d.恒容充入 e.分离出甲醇
e.分离出甲醇
您最近半年使用:0次
6 . 一定条件下, 、
、 、
、 三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。
三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。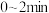 内该反应共吸收了
内该反应共吸收了 (
( )能量。下列说法不正确的是
)能量。下列说法不正确的是
 、
、 、
、 三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。
三种气体在某恒容密闭容器中发生反应,各气体的浓度随时间变化的曲线如图所示。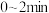 内该反应共吸收了
内该反应共吸收了 (
( )能量。下列说法不正确的是
)能量。下列说法不正确的是
A.达到平衡时, 的浓度不再变化 的浓度不再变化 |
B.反应的化学方程式为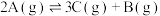 |
C.该条件下,达到平衡时, 的转化率为 的转化率为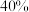 |
D.由图可知, 内, 内, 的反应速率为 的反应速率为 |
您最近半年使用:0次
名校
解题方法
7 . 在2L恒容密闭容器中,充入0.6molX气体和0.4molY气体,发生如下反应: ,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为
,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为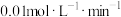 ,则:上述反应在5min末时,已消耗掉Y的物质的量分数是
,则:上述反应在5min末时,已消耗掉Y的物质的量分数是
 ,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为
,5min末容器中W的物质的量为0.2mol。若测得前5min以Z浓度变化来表示的平均反应速率为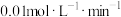 ,则:上述反应在5min末时,已消耗掉Y的物质的量分数是
,则:上述反应在5min末时,已消耗掉Y的物质的量分数是| A.20% | B.25% | C.33% | D.50% |
您最近半年使用:0次
8 . 已知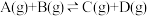 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式
___________ ,
___________ 0(填“<”、“>”或“=”);
(2)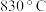 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入 的A和
的A和 的B,若反应初始
的B,若反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时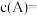
___________  ,C的物质的量为
,C的物质的量为___________  ;若反应一段时间后达到平衡,则A的转化率为
;若反应一段时间后达到平衡,则A的转化率为___________ ;如果这时向该密闭容器中再充入 氩气,平衡时A的转化率为
氩气,平衡时A的转化率为___________ 。
(3)判断该反应是否达到平衡的依据为___________ (填字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.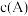 不随时间改变 d.单位时间里生成C和D的物质的量相等
不随时间改变 d.单位时间里生成C和D的物质的量相等
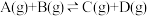 反应的平衡常数和温度的关系如下:
反应的平衡常数和温度的关系如下:| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式


(2)
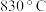 时,向一个
时,向一个 的密闭容器中充入
的密闭容器中充入 的A和
的A和 的B,若反应初始
的B,若反应初始 内A的平均反应速率
内A的平均反应速率 ,则
,则 时
时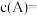
 ,C的物质的量为
,C的物质的量为 ;若反应一段时间后达到平衡,则A的转化率为
;若反应一段时间后达到平衡,则A的转化率为 氩气,平衡时A的转化率为
氩气,平衡时A的转化率为(3)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.
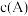 不随时间改变 d.单位时间里生成C和D的物质的量相等
不随时间改变 d.单位时间里生成C和D的物质的量相等
您最近半年使用:0次
解题方法
9 . 某温度下,在一个 的密闭容器中,加入
的密闭容器中,加入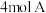 和
和 发生反应:
发生反应: ,反应
,反应 后达到平衡,测得生成
后达到平衡,测得生成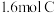 ,则下列说法正确的是
,则下列说法正确的是
 的密闭容器中,加入
的密闭容器中,加入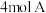 和
和 发生反应:
发生反应: ,反应
,反应 后达到平衡,测得生成
后达到平衡,测得生成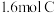 ,则下列说法正确的是
,则下列说法正确的是A.前 ,D的平均反应速率为 ,D的平均反应速率为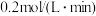 |
B.达到平衡时,B的平衡转化率是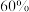 |
| C.升高该体系的温度,化学平衡常数不变 |
| D.增加C,逆向反应速率增大 |
您最近半年使用:0次
名校
解题方法
10 . 将等物质的量的A、B混合于2L的密闭容器中,发生下列反应: ,经2min后测得D的浓度为0.5mol/L,
,经2min后测得D的浓度为0.5mol/L,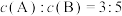 ,以C表示的平均速率
,以C表示的平均速率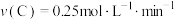 ,下列说法正确的是
,下列说法正确的是
 ,经2min后测得D的浓度为0.5mol/L,
,经2min后测得D的浓度为0.5mol/L,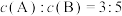 ,以C表示的平均速率
,以C表示的平均速率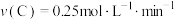 ,下列说法正确的是
,下列说法正确的是A.反应速率 | B.该反应方程式中, |
| C.2min时,A的物质的量为1.5mol | D.2min时,A的转化率为60% |
您最近半年使用:0次