2024高三下·全国·专题练习
1 . H2S分解反应:H2S(g)⇌H2(g)+ S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
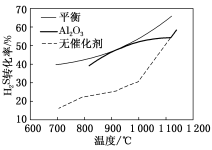
(1)在约1100℃时,无论有无Al2O3催化,H2S转化率几乎相等,这是因为_______ 。
(2)在压强为p、温度为T、Al2O3催化条件下,将H2S(g)、Ar(g)按照物质的量之比为1∶n的比例进行混合,发生热分解反应: ,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实_______ ,平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数)。
 S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
S2(g) ΔH>0,在无催化剂及Al2O3催化下,H2S在反应器中不同温度下反应,间隔相同时间测定一次H2S的转化率,其转化率与温度的关系如图所示:
(1)在约1100℃时,无论有无Al2O3催化,H2S转化率几乎相等,这是因为
(2)在压强为p、温度为T、Al2O3催化条件下,将H2S(g)、Ar(g)按照物质的量之比为1∶n的比例进行混合,发生热分解反应:
 ,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
,S2平衡产率为α。掺入Ar能提高S2的平衡产率,解释说明该事实
您最近一年使用:0次
2 . 利用 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:
反应Ⅰ
 kJ⋅mol-1
kJ⋅mol-1
反应Ⅱ
 kJ⋅mol-1
kJ⋅mol-1
[ 的产率
的产率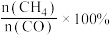 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:反应Ⅰ

 kJ⋅mol-1
kJ⋅mol-1反应Ⅱ

 kJ⋅mol-1
kJ⋅mol-1[
 的产率
的产率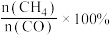 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
| A.当容器内气体总压不变时,反应Ⅱ达到平衡状态 |
B.曲线c表示 的产率随 的产率随 的变化 的变化 |
C.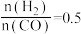 ,反应达平衡时, ,反应达平衡时, 的选择性为50% 的选择性为50% |
D.随着 增大, 增大, 的选择性先增大后减小 的选择性先增大后减小 |
您最近一年使用:0次
2023-05-27更新
|
1740次组卷
|
6卷引用:江苏省南通市2023届高三下学期第四次模拟考试化学试题
3 . 研究C、N元素的单质及化合物的有效利用对工业生产有重要意义。请回答下列问题:
(1)合成氨反应的反应历程和能量变化如图所示: 2NH3(g) △H=
2NH3(g) △H=_______ 。
(2)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
II.4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图所示。_______ 。
②高于T2℃时,NO的产率降低的可能原因为_______ (填选项字母)。
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp= _______ (用含P和P0的计算式表示,已知分压=总压×物质的量分数)
(4)某恒温条件下,CaCO3(s) CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g)
CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g) 2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为
2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为_______ 。
(5)利用“合成气”合成甲醇后,脱水制得二甲醚。反应为:2CH3OH(g) CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+
CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+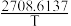 。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
①反应达到平衡后,仅升高温度,k正增大的倍数_______ k逆增大的倍数(填“>”、“<”或“=”)。
②500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为_______ (埴标号)
A.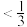 B.
B. C.
C.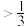 D.无法确定
D.无法确定
(1)合成氨反应的反应历程和能量变化如图所示:
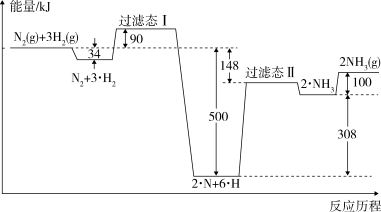
 2NH3(g) △H=
2NH3(g) △H=(2)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1
4NO(g)+6H2O(g) ∆H=-906kJ∙mol−1II.4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1
2N2(g)+6H2O(g) ∆H=-126kJ∙mol−1将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图所示。
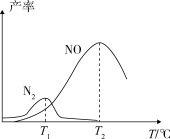
②高于T2℃时,NO的产率降低的可能原因为
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
(3)甲烷干法重整制H2的过程为反应a:CH4+CO2
 2CO+2H2,同时发生副反应b:CO2+H2
2CO+2H2,同时发生副反应b:CO2+H2 CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp=
CO+H2O,T℃时,在恒压容器中,通入2molCH4和1molCO2发生上述反应,总压强为P0,平衡时甲烷的转化率为40%,H2O的分压为P,则反应a的压强平衡常数Kp= (4)某恒温条件下,CaCO3(s)
 CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g)
CaO(s)+CO2(g)的平衡常数K=1.5mol/L,在此温度下,CO2又有部分分解成CO,即2CO2(g) 2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为
2CO(g)+O2(g),若将5molCaCO3装入1L真空容器中,当达到平衡时气体中O2的物质的量分数为20%,则此时CaO的物质的量为(5)利用“合成气”合成甲醇后,脱水制得二甲醚。反应为:2CH3OH(g)
 CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+
CH3OCH3(g)+H2O(g)△H经查阅资料,在一定范围内,上述反应化学平衡常数与热力学温度存在如下关系:lnKc=-2.205+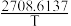 。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。
。其速率方程为:v正=k正·c2(CH3OH),v逆=k逆·c(CH3OCH3)·c(H2O),k正、K逆为速率常数,且影响外因只有温度。①反应达到平衡后,仅升高温度,k正增大的倍数
②500K下,在密闭容器中加入一定量甲醇CH3OH,反应到达平衡状态时,体系中CH3OCH3(g)的物质的量分数为
A.
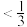 B.
B. C.
C.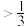 D.无法确定
D.无法确定
您最近一年使用:0次
4 . 二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)II.2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
| A.0~4 min,反应I的v(H2)=0.8 mol·L-1·min-1 |
| B.反应II中CH3OH的转化率为80% |
| C.反应I的平衡常数K=6.25 |
| D.容器总压强保持不变,可证明反应体系到达平衡状态 |
您最近一年使用:0次
5 . 德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g)⇌2NH3(g) △H=-92.4kJ·mol-1,他因此获得了1918年诺贝尔化学奖。合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。请回答下列问题:
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
则从反应开始到25min时,以H2表示的平均反应速率=_______ 。
(2)合成氨反应N2(g)+3H2(g)⇌2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。则:
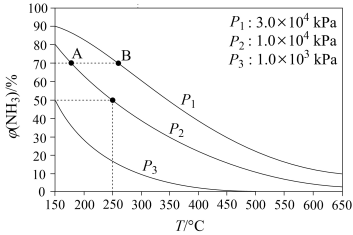
A、B两点的化学反应速率较大的是_______ (填“A点”或“B点”)。在250°C、1.0×104kPa下,化学平衡常数表达式为K=_______ 。
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;_______ 。
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g)⇌3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表_______ (填字母代号)。
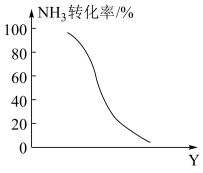
A.原料中CH4与NH3的体积比 B.温度 C.压强
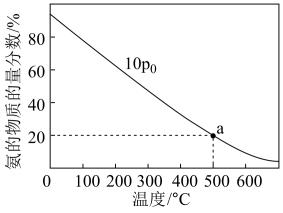
(5)工业合成氨反应为:N2(g)+3H2(g)⇌2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=_______ [Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数),用P0的代数式表示]。
(6)我国科研人员发现在反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。
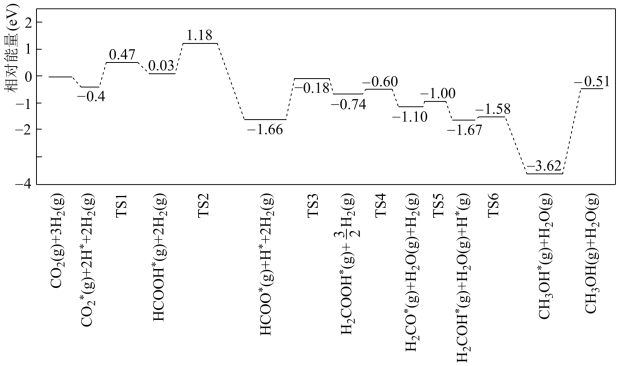
上述能垒(活化能)为1.15eV的反应为_______ 。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)合成氨反应N2(g)+3H2(g)⇌2NH3(g),初始时氮气、氢气的体积比为1:3,在相同催化剂条件下平衡混合物中氨的体积分数φ(NH3)与温度、压强的关系如图所示。则:

A、B两点的化学反应速率较大的是
(3)随着温度升高,单位时间内NH3的产率增大,温度高于900°C以后,单位时间内NH3的产率开始下降的原因可能是:升高温度催化剂活性降低;
(4)工业上可以利用氨气生产氢氰酸(HCN)的反应为:NH3(g)+CH4(g)⇌3H2(g)+HCN(g) ΔH>0,在其他条件一定,该反应达到平衡时NH3转化率随外界条件Y变化的关系如图所示,Y代表

A.原料中CH4与NH3的体积比 B.温度 C.压强
(5)工业合成氨反应为:N2(g)+3H2(g)⇌2NH3(g),当进料体积比V(N2):V(H2)=1:3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:500°C、压强为10P0时,Kp=

(6)我国科研人员发现在反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)使用Pt单原子催化剂有着高达90%以上的甲醇选择性。反应历程如下图,其中TS表示过渡态,吸附在催化剂表面上的物种用*表示。

上述能垒(活化能)为1.15eV的反应为
您最近一年使用:0次
6 . 反应2NO(g)+O2(g) 2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
(1)NO被氧化的机理如下:第一步:NO+O2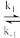 NO3,第二步:NO3+NO
NO3,第二步:NO3+NO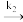 2NO2,其能量与反应过程的关系如图所示:
2NO2,其能量与反应过程的关系如图所示:
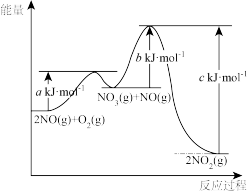
①2NO(g)+O2(g) = 2NO2(g)的ΔH___________ 0(填“>”或“<”)。图中第一步反应的逆反应的活化能为___________ kJ/mol(用含a、b、c、ΔH的代数式表示)。
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为___________ (用含如k1、k−1的代数式表示);写出反应2NO(g) +O2(g) 2NO2(g)的平衡速率方程:v(正)=
2NO2(g)的平衡速率方程:v(正)=___________ (用含k1、k−1、k2、c( NO)及c(O2)的代数式表示)。
(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。
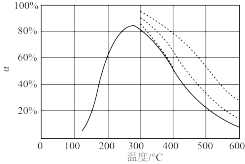
①该压强下,400℃、O2过量100%时,NO的平衡转化率α =___________
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是___________ 。
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=___________ kPa−1(以分压表示,分压=总压×物质的量分数)。
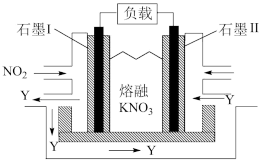
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为___________ 。
 2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:
2NO2(g)是制取硝酸、烟气脱硝中的重要反应。回答下列问题:(1)NO被氧化的机理如下:第一步:NO+O2
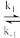 NO3,第二步:NO3+NO
NO3,第二步:NO3+NO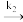 2NO2,其能量与反应过程的关系如图所示:
2NO2,其能量与反应过程的关系如图所示:
①2NO(g)+O2(g) = 2NO2(g)的ΔH
②k1、k−1、k2为反应速率常数,若某反应包含多个基元反应(一步直接转化为产物的反应,如上述反应第一步与第二步均为基元反应),反应速率由最慢的一步基元反应决定,对于基元反应aA + bB=cC+dD,其速率方程为v(正)=kca(A)·cb(B)。上述第一步反应的平衡常数为
 2NO2(g)的平衡速率方程:v(正)=
2NO2(g)的平衡速率方程:v(正)=(2)在恒压反应器中充入NO、O2,当O2分别过量6%、20%和100%时,NO的平衡转化率α分别如图所示(图中虚线)。

①该压强下,400℃、O2过量100%时,NO的平衡转化率α =
②图中实线为相同时间内NO的转化率随温度的变化曲线,实线左侧,随温度升高,NO的转化率逐渐增大,其原因是
(3)若在恒压反应器中充入m mol NO和n mol O2,在温度T℃、压强p kPa条件下进行反应。平衡时,若NO的转化率为50%,则该条件下的平衡常数Kp=
(4)NO2、O2和熔融KNO3可制作燃料电池,其原理如下图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。则正极反应方程式为

您最近一年使用:0次
7 . 高氯酸铜易溶于水.在130℃时发生分解,是一种燃烧催化剂,可用于烟花火药配方。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

(1)“电解I”采用不锈钢网和石墨分别作为电极材料。在不锈钢网附近得到的电解产物是_______ ;
(2)“60℃歧化“时生成的产物之一为NaClO3,则反应的离子方程式为_______ ;
(3)“电解II”时阳极反应式为_______ ;
(4)“反应”步骤生成Cu(ClO4)2,该反应的化学反应方程式为_______ ;
(5)“反应”阶段所采用的不同实验条件对产率影响的结果如下图所示。则该反应最适宜的温度是_______ 。用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为_______ (用含a、b的代数式表示)。


(1)“电解I”采用不锈钢网和石墨分别作为电极材料。在不锈钢网附近得到的电解产物是
(2)“60℃歧化“时生成的产物之一为NaClO3,则反应的离子方程式为
(3)“电解II”时阳极反应式为
(4)“反应”步骤生成Cu(ClO4)2,该反应的化学反应方程式为
(5)“反应”阶段所采用的不同实验条件对产率影响的结果如下图所示。则该反应最适宜的温度是

您最近一年使用:0次
名校
解题方法
8 . 乙基环己烷常用作气相色谱对比样品,也用于有机合成。
(1)乙基环己烷(C8H16)脱氢制苯乙炔(C8H6)的热化学方程式如下:
①C8H16(l) C8H10(l)+3H2(g) ΔH1>0
C8H10(l)+3H2(g) ΔH1>0
②C8H10(l) C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
③C8H6(l)+5H2(g) C8H16(l) ΔH3=b kJ·mol-1
C8H16(l) ΔH3=b kJ·mol-1
则反应①的ΔH1为__________ (用含a、b的代数式表示),有利于提高上述反应①的平衡转化率的条件是____ (填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)不同压强和温度下乙基环己烷的平衡转化率如下图所示。
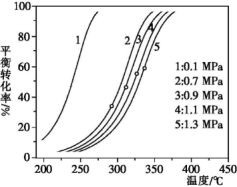
①在相同压强下升高温度,未达到新平衡前,v正____ (填“大于”“小于”或“等于”)v逆。
②研究表明,既升高温度又增大压强,C8H16(l)的转化率也升高,理由可能是____ 。
(3)t ℃,向恒容密闭反应器中充入1.00 mol C8H16(l)进行催化脱氢,测得液态C8H10(l)和C8H6(l)的产率x1和x2(以物质的量分数计)随时间变化关系如下图所示。
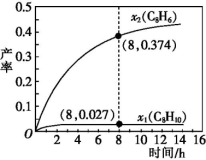
①在8 h时,反应体系内氢气的量为_____ mol(忽略其他副反应),液态C8H16(l)的转化率是_________ 。
②x1显著低于x2的原因是_____________ 。
(1)乙基环己烷(C8H16)脱氢制苯乙炔(C8H6)的热化学方程式如下:
①C8H16(l)
 C8H10(l)+3H2(g) ΔH1>0
C8H10(l)+3H2(g) ΔH1>0②C8H10(l)
 C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
C8H6(l)+2H2(g) ΔH2=a kJ·mol-1 ③C8H6(l)+5H2(g)
 C8H16(l) ΔH3=b kJ·mol-1
C8H16(l) ΔH3=b kJ·mol-1则反应①的ΔH1为
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)不同压强和温度下乙基环己烷的平衡转化率如下图所示。

①在相同压强下升高温度,未达到新平衡前,v正
②研究表明,既升高温度又增大压强,C8H16(l)的转化率也升高,理由可能是
(3)t ℃,向恒容密闭反应器中充入1.00 mol C8H16(l)进行催化脱氢,测得液态C8H10(l)和C8H6(l)的产率x1和x2(以物质的量分数计)随时间变化关系如下图所示。

①在8 h时,反应体系内氢气的量为
②x1显著低于x2的原因是
您最近一年使用:0次
解题方法
9 . 在温度为373K时,将0.100mol无色的N2O4气体通入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
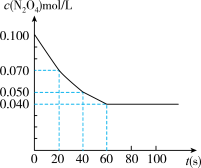
(1)计算在20至40秒时间内,NO2的平均生成速率为________ 。
(2)该反应的化学平衡常数表达式为_____________ 。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
据此可推测该反应(生成NO2)是_______ 反应(选填“吸热”或“放热”)。
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,画出此温度下的反应进程示意曲线。
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为
(2)该反应的化学平衡常数表达式为
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
| T/ K | 323 | 373 |
| K值 | 0.022 | 0.36 |
据此可推测该反应(生成NO2)是
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,画出此温度下的反应进程示意曲线。
您最近一年使用:0次
解题方法
10 . (1)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)  2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
①该反应的平衡常数表达式为K=___ 。升高温度,平衡常数将____ (填“增大”“减小”或“不变”)。
②能判断该反应是否达到化学平衡状态的依据是________ 。
A.容器中压强不变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c(C)
(2)为研究不同条件对反应2NO(g)+Cl2(g) 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为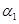 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为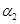 ,则
,则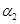
__________ 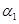 ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。
(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为_________________ 。用该燃料电池作电源,以石墨为电极电解足量的硫酸铜溶液,当电路中通过0.1 mol电子时,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入_____ (填物质名称),其质量约为_______ g。
 2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。
2C(g)+D(s) △H1<0反应,按下表数据投料,反应达到平衡状态,测得体系压强升高。物质 | A | B | C | D |
起始投料/mol | 2 | 1 | 2 | 0 |
①该反应的平衡常数表达式为K=
②能判断该反应是否达到化学平衡状态的依据是
A.容器中压强不变
B.混合气体的密度不变
C.υ(A):υ(B):υ(C)=2:1:2
D.c(A)=c(C)
(2)为研究不同条件对反应2NO(g)+Cl2(g)
 2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为
2C1NO(g) △H2<0的影响,在恒温条件下,向2 L恒容密闭容器中加入0.2 mol NO和0.1 mol C12,10 min时反应达到平衡。测得NO的转化率为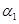 。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为
。其他条件保持不变,反应在恒压条件下进行,平衡时NO的转化率为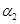 ,则
,则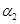
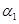 ,(填“大于”“小于”或“等于”)。
,(填“大于”“小于”或“等于”)。(3)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2—离子。电池工作时负极反应式为
您最近一年使用:0次



