1 . 工业生产中常常产生硫的氧化物和氮的氧化物,对环境产生重大影响,为减少对环境的污染,科学工作者采用“O3氧化法”和“光催化氧化法”对工业烟气脱硫、脱硝,原理如下。回答下列问题:
I.O3氧化法
(1)用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) △H1=-241.6kJ/mol K1
b)2O3(g)⇌3O2(g) △H2=-286.6kJ/mol K2
c)2SO2(g)+O2(g)⇌2SO3(g) △H3 K3
根据盖斯定律,△H3=_______ ,K3=_______ (用含K1、K2的式子表示)。
(2)在密闭容器中充入1molN2O4和1molO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) △H4=+57kJ/mol
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) △H5
不同压强(P)下,N2O4平衡转化率α(N2O4)随反应温度(T)的变化关系如图1所示。_______ 0(填“>”或“<”),若缩小体积增大压强,B点可能向_______ 点移动(填“A”或“C”)。
②下列有关该反应体系的说法正确的是_______ (填标号)。
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)>1mol
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大N2O4的浓度,反应d的正反应速率增大,e的正反应速率减小
③某温度下,t分钟后达到平衡,此时N2O4的物质的量分数为1/3,且NO2与O2的物质的量分数相等,v(O2)=_______ mol/min
Ⅱ.光催化氧化法
光照条件下,催化剂TiO2表面产生电子(e-)和空穴(h+)。电子与O2作用生成离子自由基(·O ),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO
),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO 。变化过程如图2所示。
。变化过程如图2所示。_______ 。
(4)已知该过程中生成的HNO2可继续与·OH发生反应:HNO2+2·OH=H++NO +H2O;该反应可分两步进行,请补充反应i:
+H2O;该反应可分两步进行,请补充反应i:
i:_______ ;
ii.NO2+·OH=H++NO 。
。
I.O3氧化法
(1)用O3氧化烟气中的SO2时,体系中存在以下反应:
a)SO2(g)+O3(g)⇌SO3(g)+O2(g) △H1=-241.6kJ/mol K1
b)2O3(g)⇌3O2(g) △H2=-286.6kJ/mol K2
c)2SO2(g)+O2(g)⇌2SO3(g) △H3 K3
根据盖斯定律,△H3=
(2)在密闭容器中充入1molN2O4和1molO3,发生以下反应:
d)N2O4(g)⇌2NO2(g) △H4=+57kJ/mol
e)N2O4(g)+O3(g)⇌N2O5(g)+O2(g) △H5
不同压强(P)下,N2O4平衡转化率α(N2O4)随反应温度(T)的变化关系如图1所示。

②下列有关该反应体系的说法正确的是
A.恒压下,混合气体的密度保持不变时,说明反应体系已达到平衡
B.任意时刻,存在n(NO2)+n(N2O4)+n(N2O5)>1mol
C.恒容下,升高温度,该体系中气体颜色变浅
D.恒容下,增大N2O4的浓度,反应d的正反应速率增大,e的正反应速率减小
③某温度下,t分钟后达到平衡,此时N2O4的物质的量分数为1/3,且NO2与O2的物质的量分数相等,v(O2)=
Ⅱ.光催化氧化法
光照条件下,催化剂TiO2表面产生电子(e-)和空穴(h+)。电子与O2作用生成离子自由基(·O
 ),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO
),空穴与水电离出的OH-作用生成羟基自由基(·OH),·O-和·OH分别与NO反应生成NO 。变化过程如图2所示。
。变化过程如图2所示。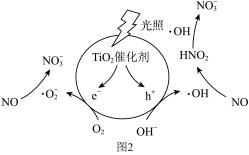
(4)已知该过程中生成的HNO2可继续与·OH发生反应:HNO2+2·OH=H++NO
 +H2O;该反应可分两步进行,请补充反应i:
+H2O;该反应可分两步进行,请补充反应i:i:
ii.NO2+·OH=H++NO
 。
。
您最近半年使用:0次
名校
解题方法
2 . 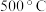 ,将
,将 和
和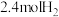 充入体积为
充入体积为 的已装有催化剂的恒容密闭容器中发生合成氨反应
的已装有催化剂的恒容密闭容器中发生合成氨反应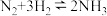 ,“此反应放热,下列说法正确的是
,“此反应放热,下列说法正确的是
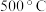 ,将
,将 和
和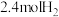 充入体积为
充入体积为 的已装有催化剂的恒容密闭容器中发生合成氨反应
的已装有催化剂的恒容密闭容器中发生合成氨反应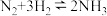 ,“此反应放热,下列说法正确的是
,“此反应放热,下列说法正确的是A.平衡时, 的浓度可能为 的浓度可能为 |
| B.容器内气体的密度不再随时间改变说明该反应已达到平衡状态 |
C.若已知生成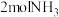 放出 放出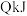 的热量,则该反应达平衡时放出的热量小于 的热量,则该反应达平衡时放出的热量小于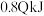 |
D.反应平衡后,向容器中充入一定体积的氨气,使容器中气体总压强增大,则 、 、 均增大 均增大 |
您最近半年使用:0次
3 . 天然气、石油钻探过程会释放出 、
、 等气体。
等气体。
Ⅰ.某种将 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:
①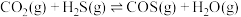

②

③
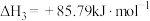
④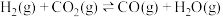
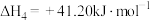
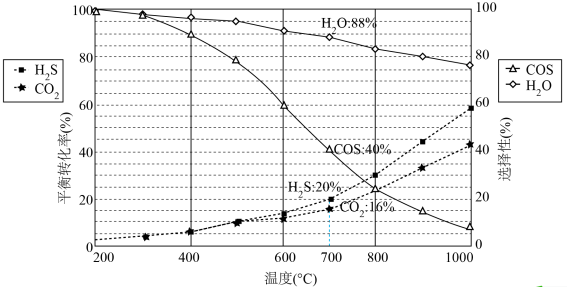
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ. 和
和 的初始物质的量相等;
的初始物质的量相等;
ⅱ.COS的选择性 ,
, 的选择性
的选择性 ;
;
ⅲ.产率=转化率×选择性。
(1)
_______ 。
(2)温度高于 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是_______ 。
(3) 达到平衡时,反应体系中
达到平衡时,反应体系中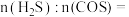
_______ 。
(4)催化剂 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。请在答题纸对应区域绘出 过渡态 的示意图
的示意图_______ 。 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示:_______ 。
(6)阳极区发生反应为:
①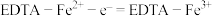 ;
;
②_______ 。
(7)工作时, 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是_______ 。
 、
、 等气体。
等气体。Ⅰ.某种将
 和
和 共活化的工艺涉及反应如下:
共活化的工艺涉及反应如下:①
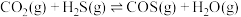

②


③

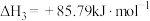
④
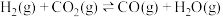
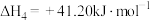
恒压密闭容器中,反应物的平衡转化率、部分生成物的选择性与温度关系如图所示。
已知:ⅰ.
 和
和 的初始物质的量相等;
的初始物质的量相等;ⅱ.COS的选择性
 ,
, 的选择性
的选择性 ;
;ⅲ.产率=转化率×选择性。
(1)

(2)温度高于
 时,
时, 的转化率大于
的转化率大于 ,原因是
,原因是(3)
 达到平衡时,反应体系中
达到平衡时,反应体系中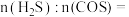
(4)催化剂
 对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。
对反应②具有高选择性,通过理论计算得到反应的主要路径如下图。 的示意图
的示意图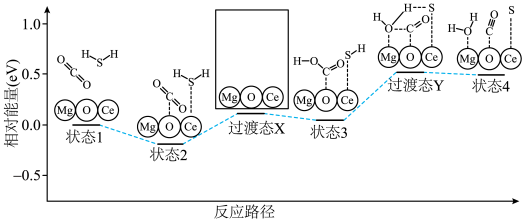
 协同转化装置,实现对天然气中
协同转化装置,实现对天然气中 和
和 的高效去除,其中电极分别为
的高效去除,其中电极分别为 石墨烯(石墨烯包裹的
石墨烯(石墨烯包裹的 )和石墨烯。过程如图所示:
)和石墨烯。过程如图所示: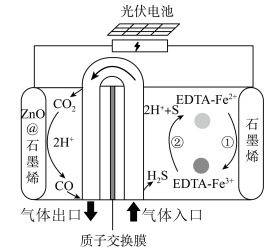
(6)阳极区发生反应为:
①
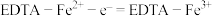 ;
;②
(7)工作时,
 石墨烯电极区的
石墨烯电极区的 基本保持不变,原因是
基本保持不变,原因是
您最近半年使用:0次
名校
解题方法
4 . 一定条件下,在密闭容器中利用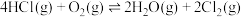 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是
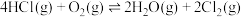 制备
制备 ,下列有关说法正确的是
,下列有关说法正确的是A.若断开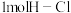 键的同时有 键的同时有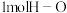 键断开,则表明该反应达到平衡状态 键断开,则表明该反应达到平衡状态 |
B.提高 ,该反应的平衡常数增大 ,该反应的平衡常数增大 |
C.使用催化剂,可以提高 的平衡转化率 的平衡转化率 |
D.该反应在一定条件下可自发进行,则该反应 |
您最近半年使用:0次
名校
解题方法
5 . 向绝热恒容密闭容器中通入SO2和NO2,在一定条件下发生反应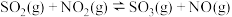 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④ ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量
⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
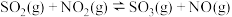 ,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为
,正反应速率随时间变化的示意图如下图,下列结论中正确的个数为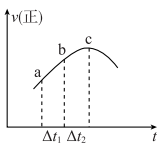
②SO2浓度:a点小于c点
③反应物的总能量低于生成物的总能量
④
 ,ab段NO2的消耗量小于bc段NO2的消耗量
,ab段NO2的消耗量小于bc段NO2的消耗量⑤混合物颜色不再变化,说明反应达到平衡
⑥体系压强不再变化,说明反应达到平衡
⑦逆反应速率图象在此时间段内和上图趋势相同
⑧达到平衡后,改变容器体积增大压强,逆反应速率可能先增大后减小
| A.3个 | B.4个 | C.5个 | D.6个 |
您最近半年使用:0次
名校
解题方法
6 . 可逆反应 ,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
①单位时间内生成n mol 的同时生成2n mol
的同时生成2n mol
②单位时间内生成n mol 的同时生成2n mol
的同时生成2n mol
③用 、
、 、
、 表示的反应速率的比为2∶2∶1的状态
表示的反应速率的比为2∶2∶1的状态
④各气体的浓度不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
 ,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是
,在容积恒定的密闭容器中反应,下列说法能充分说明该反应已经达到化学平衡状态的是①单位时间内生成n mol
 的同时生成2n mol
的同时生成2n mol
②单位时间内生成n mol
 的同时生成2n mol
的同时生成2n mol
③用
 、
、 、
、 表示的反应速率的比为2∶2∶1的状态
表示的反应速率的比为2∶2∶1的状态④各气体的浓度不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①③④⑤ | B.②③⑤⑦ | C.①④⑥⑦ | D.①②③④⑤⑥⑦ |
您最近半年使用:0次
7 . 以 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
 。
。
已知: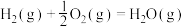
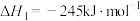
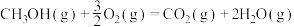
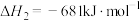
回答下列问题:
(1)计算上述合成甲醇反应的焓变
___________  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa,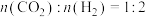 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的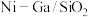 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是___________ 。催化剂的最佳配比和反应温度是___________ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数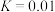 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。
(4) 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1L容器中投入
。5MPa,200℃时在1L容器中投入 和
和 ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率 )。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(列出计算表达式)___________ 。
 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。已知:
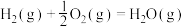
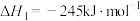
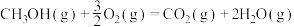
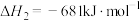
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果,在3MPa,
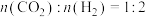 时,不同Ni、Ga配比的
时,不同Ni、Ga配比的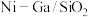 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示,甲醇时空收率随温度变化先增大后减小的原因是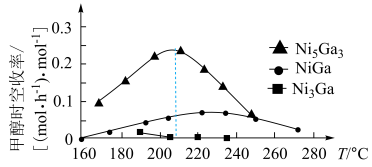
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数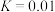 ,下列事实说明该反应已达平衡的是___________。
,下列事实说明该反应已达平衡的是___________。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中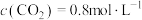 , ,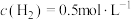 , , |
| D.混合气体的平均相对分子质量不变 |
(4)
 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1L容器中投入
。5MPa,200℃时在1L容器中投入 和
和 ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率 )。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(列出计算表达式)
您最近半年使用:0次
解题方法
8 . CH4与CO2反应得到合成气的原理为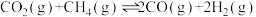
 。向容积为2L的恒容密闭容器中充入
。向容积为2L的恒容密闭容器中充入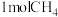 与
与 ,反应过程中CO的体积分数与温度及压强的关系如图所示。下列说法正确的是
,反应过程中CO的体积分数与温度及压强的关系如图所示。下列说法正确的是
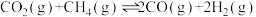
 。向容积为2L的恒容密闭容器中充入
。向容积为2L的恒容密闭容器中充入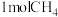 与
与 ,反应过程中CO的体积分数与温度及压强的关系如图所示。下列说法正确的是
,反应过程中CO的体积分数与温度及压强的关系如图所示。下列说法正确的是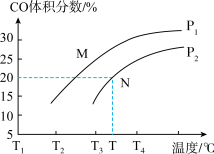
A.该反应焓变: | B.压强大小关系: |
C.M、N状态下平衡常数: | D.N点CH4的平衡转化率与M点的不相同 |
您最近半年使用:0次
名校
解题方法
9 . 关注化学反应中的物质和能量变化是认识和研究化学反应的重要视角。
(1)在2.0 L恒温恒容密闭容器中充入2.0 mol 和6.0 mol
和6.0 mol  ,发生反应:
,发生反应:
 ,反应t min时测得
,反应t min时测得 的物质的量为3.6 mol。
的物质的量为3.6 mol。
①0~t min内,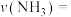
______ mol⋅L ⋅min
⋅min (用含t的代数式表示)。
(用含t的代数式表示)。
②反应至t min时,容器内压强与反应初始时压强之比为______ ;
(2)甲烷可以消除氮氧化物的污染: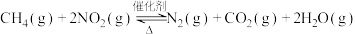 。
。
①在不改变初始浓度的条件下,加快反应速率的措施有______ (填一条)。
②若在恒温恒容密闭容器中充入1 mol 和2 mol
和2 mol  发生上述反应,下列叙述能说明反应达到平衡状态的是
发生上述反应,下列叙述能说明反应达到平衡状态的是______ (填字母)。
A. 、
、 、
、 的物质的量之比为1∶1∶2
的物质的量之比为1∶1∶2
B.混合气体中 的物质的量分数保持不变
的物质的量分数保持不变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)在催化剂作用下,利用含 的废气协同处理烟气中的
的废气协同处理烟气中的 ,转化为无污染气体的同时得到S单质,该反应的化学方程式为
,转化为无污染气体的同时得到S单质,该反应的化学方程式为____________ 。
(4) 催化剂可以催化
催化剂可以催化 脱除烟气中的NO。将
脱除烟气中的NO。将 和
和 按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
①该反应中氧化剂与还原剂的物质的量之比为______ 。
②将模拟烟气以一定流速通过催化剂反应管,反应相同时间,测得NO的转化率随温度的变化如图所示。反应温度高于380℃时,NO的转化率下降的原因可能为______ (填一条)。
(1)在2.0 L恒温恒容密闭容器中充入2.0 mol
 和6.0 mol
和6.0 mol  ,发生反应:
,发生反应:
 ,反应t min时测得
,反应t min时测得 的物质的量为3.6 mol。
的物质的量为3.6 mol。①0~t min内,
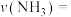
 ⋅min
⋅min (用含t的代数式表示)。
(用含t的代数式表示)。②反应至t min时,容器内压强与反应初始时压强之比为
(2)甲烷可以消除氮氧化物的污染:
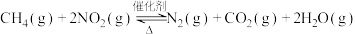 。
。①在不改变初始浓度的条件下,加快反应速率的措施有
②若在恒温恒容密闭容器中充入1 mol
 和2 mol
和2 mol  发生上述反应,下列叙述能说明反应达到平衡状态的是
发生上述反应,下列叙述能说明反应达到平衡状态的是A.
 、
、 、
、 的物质的量之比为1∶1∶2
的物质的量之比为1∶1∶2B.混合气体中
 的物质的量分数保持不变
的物质的量分数保持不变C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)在催化剂作用下,利用含
 的废气协同处理烟气中的
的废气协同处理烟气中的 ,转化为无污染气体的同时得到S单质,该反应的化学方程式为
,转化为无污染气体的同时得到S单质,该反应的化学方程式为(4)
 催化剂可以催化
催化剂可以催化 脱除烟气中的NO。将
脱除烟气中的NO。将 和
和 按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。①该反应中氧化剂与还原剂的物质的量之比为
②将模拟烟气以一定流速通过催化剂反应管,反应相同时间,测得NO的转化率随温度的变化如图所示。反应温度高于380℃时,NO的转化率下降的原因可能为

您最近半年使用:0次
名校
解题方法
10 . 在2L密闭容器中进行反应: ,式中a、b、c、d为化学计量数。在
,式中a、b、c、d为化学计量数。在 内,各物质的物质的量(单位为mol)的变化如下表所示:
内,各物质的物质的量(单位为mol)的变化如下表所示:
已知2min内 ,
,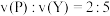 。
。
(1)起始时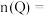
___________ ,2min末是否达到平衡___________ (填“是”或“否”)。
(2)上述反应的化学方程式为___________ 。
(3)下列各项为1min内各物质所表示的反应速率,其中最快的是___________ 。
a. b.
b. c.
c.
(4)用Y表示2min内的反应速率为___________ 。2min末,Q在混合气体中的体积分数为___________ 。
(5)在保持绝热和容积不变的情况下,下列关于上述反应的叙述不正确的是___________ 。
a.向容器内加入固体X,会使反应速率明显提高
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡
 ,式中a、b、c、d为化学计量数。在
,式中a、b、c、d为化学计量数。在 内,各物质的物质的量(单位为mol)的变化如下表所示:
内,各物质的物质的量(单位为mol)的变化如下表所示:| 物质 时间 | X | Y | P | Q |
| 起始 | 0.5 | 2.2 | 1.0 | |
| 2min末 | 0.7 | 2.7 | 1.2 | |
| 3min末 | 0.8 |
 ,
,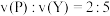 。
。(1)起始时
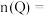
(2)上述反应的化学方程式为
(3)下列各项为1min内各物质所表示的反应速率,其中最快的是
a.
 b.
b. c.
c.
(4)用Y表示2min内的反应速率为
(5)在保持绝热和容积不变的情况下,下列关于上述反应的叙述不正确的是
a.向容器内加入固体X,会使反应速率明显提高
b.向容器内充入稀有气体Ar(不参与反应),会导致体系压强增大,反应速率加快
c.随着反应的进行,混合气体的平均相对分子质量不再改变即说明反应已经达到平衡
d.随着反应的进行,混合气体的密度不再改变即说明反应已经达到平衡
e.随着反应的进行,混合气体的压强不再改变即说明反应已经达到平衡
您最近半年使用:0次



