二甲醚是一种清洁能源,用水煤气制取二甲醚的原理如下:
I.CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
II.2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
I.CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)II.2CH3OH(g)
 CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)500 K时,在2 L恒容密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3),则下列说法不正确的是
| A.0~4 min,反应I的v(H2)=0.8 mol·L-1·min-1 |
| B.反应II中CH3OH的转化率为80% |
| C.反应I的平衡常数K=6.25 |
| D.容器总压强保持不变,可证明反应体系到达平衡状态 |
更新时间:2022-04-06 21:57:29
|
相似题推荐
【推荐1】利用 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:
反应Ⅰ
 kJ⋅mol-1
kJ⋅mol-1
反应Ⅱ
 kJ⋅mol-1
kJ⋅mol-1
[ 的产率
的产率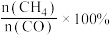 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:反应Ⅰ

 kJ⋅mol-1
kJ⋅mol-1反应Ⅱ

 kJ⋅mol-1
kJ⋅mol-1[
 的产率
的产率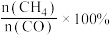 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
| A.当容器内气体总压不变时,反应Ⅱ达到平衡状态 |
B.曲线c表示 的产率随 的产率随 的变化 的变化 |
C.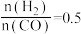 ,反应达平衡时, ,反应达平衡时, 的选择性为50% 的选择性为50% |
D.随着 增大, 增大, 的选择性先增大后减小 的选择性先增大后减小 |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐2】一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应: 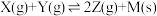 ,5min后达到平衡,此时生成2a mol Z,建立平衡状态I,此时Y的体积分数为w%。下列说法正确的是
,5min后达到平衡,此时生成2a mol Z,建立平衡状态I,此时Y的体积分数为w%。下列说法正确的是
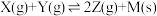 ,5min后达到平衡,此时生成2a mol Z,建立平衡状态I,此时Y的体积分数为w%。下列说法正确的是
,5min后达到平衡,此时生成2a mol Z,建立平衡状态I,此时Y的体积分数为w%。下列说法正确的是| A.用V(X)和V(Y)表示此反应的反应速率是:V(X)=V(Y)=(0.1-0.2a)mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态,此时气体总量为(1+n)mol |
| C.若建立平衡I的起始时n=1,维持温度和体积不变,向平衡I的体系中再加入cmolZ和dmolM[其中c>0的任意值,d≥(1-a)mol],达到平衡状态II,此时Y的体积分数一定为w% |
| D.维持温度和体积不变,向上述平衡体系中再充入l mol X和n mol Y,此时v(正)增大,v(逆)减小,平衡正向移动,再次达到平衡时,Z的物质的量浓度为2a mol/L,M的物质的量为2a mol |
您最近一年使用:0次
单选题
|
困难
(0.15)
【推荐3】T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
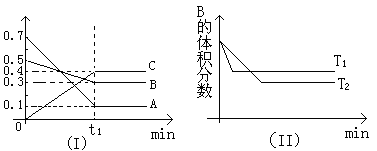

| A.在t1时间内用B表示该反应的平均速率为:0.6mol·L-1·min-1 |
| B.在(t1+10)时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C.T时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1 |
| D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
【推荐1】T℃时,将1molX和2molY投入2L的密闭容器中,发生反应:X(g)+Y(g) 2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )

 2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
2Z(g),X、Y的量随时间变化如下表,该反应的平衡常数随温度的变化如下图,则下列判断正确的是( )
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | |
| X | 1 | 0.80 | 0.66 | 0.58 | 0.52 | 0.50 | 0.50 |
| Y | 2 | 1.80 | 1.66 | … | … | … | … |
| A.前5min用Z表示的平均反应速率为0.2mol/(L·min) |
| B.该反应的正反应是放热反应,且T>T1 |
| C.在T℃时,以1molX、2molY和1molZ充入上述容器中,达到平衡时,X的体积分数不变 |
| D.若温度为T1时,以同样的起始量反应,达到平衡时X的转化率为66.7% |
您最近一年使用:0次
【推荐2】利用 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:
反应Ⅰ
 kJ⋅mol-1
kJ⋅mol-1
反应Ⅱ
 kJ⋅mol-1
kJ⋅mol-1
[ 的产率
的产率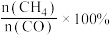 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
 和CO反应生成
和CO反应生成 的过程中主要涉及的反应如下:
的过程中主要涉及的反应如下:反应Ⅰ

 kJ⋅mol-1
kJ⋅mol-1反应Ⅱ

 kJ⋅mol-1
kJ⋅mol-1[
 的产率
的产率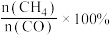 ,
, 的选择性
的选择性 ]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时
]。保持温度一定,在固定容积的密闭容器中进行上述反应,平衡时 和
和 的产率及CO和
的产率及CO和 的转化率随
的转化率随 的变化情况如图所示。下列说法不正确的是
的变化情况如图所示。下列说法不正确的是
| A.当容器内气体总压不变时,反应Ⅱ达到平衡状态 |
B.曲线c表示 的产率随 的产率随 的变化 的变化 |
C.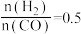 ,反应达平衡时, ,反应达平衡时, 的选择性为50% 的选择性为50% |
D.随着 增大, 增大, 的选择性先增大后减小 的选择性先增大后减小 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
【推荐3】向2l恒温恒容容器中加入2molMgSO4并充入2molCO,发生反应:MgSO4(s)+ CO(g) MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是

 MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
MgO(s)+ CO2(g)+SO2(g)△H>0。测得反应过程中残留固体的质量随时间变化如图所示,下列说法不正确的是
| A.0 ~2min内平均反应速率v(SO2)= 0.3 mol·l-1·min-1 |
| B.2 ~4min内容器内气体的密度没有变化 |
| C.该温度下,反应的平衡常数为1.8 |
| D.保持其他条件不变,起始时向容器中充入1.00 mol MgSO4和1.00 molCO,反应达到平衡时,n(CO2)>0.60 mol |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐1】工业上制备Ti,采用碳氯化法将 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:
①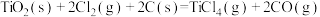
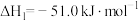
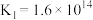
②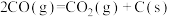
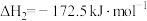
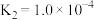
③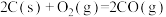
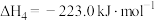
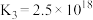 。
。
在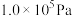 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
 转化成
转化成 。在1000℃时发生如下:
。在1000℃时发生如下:①
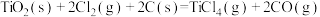
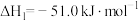
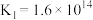
②
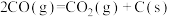
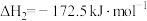
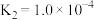
③
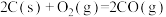
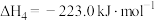
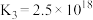 。
。在
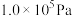 ,将
,将 、C、
、C、 以物质的量比1:2.2:2进行碳氯化,平衡时体系中
以物质的量比1:2.2:2进行碳氯化,平衡时体系中 、CO、
、CO、 和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是
和C的组成比(物质的量分数)随温度变化如下图所示。下列说法不正确的是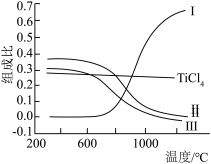
A.1000℃时,反应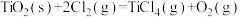 的平衡常数 的平衡常数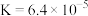 |
B.曲线III表示平衡时 的物质的量分数随温度的变化 的物质的量分数随温度的变化 |
| C.高于600℃,升高温度,主要对反应②的平衡产生影响 |
D.为保证 的平衡产率,选择反应温度应高于1000℃ 的平衡产率,选择反应温度应高于1000℃ |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐2】利用丙烷(C3H8)在无氧条件下制备丙烯(C3H6)的反应方程式为:C3H8(g) C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
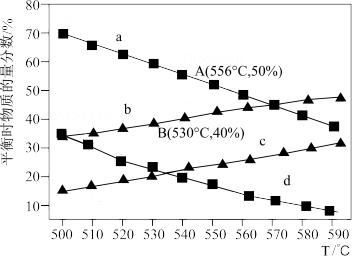
 C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
C3H6(g)+H2(g) △H=+124kJ·mol-1。在一体积可变的容器中,不同起始压强下(0.1MPa、0.01MPa)进行上述反应,达到化学平衡时,测得丙烷和丙烯的物质的量分数随温度变化如图所示,则下列说法中正确的是
| A.c曲线表示的是0.01MPa压强下丙烯随温度变化的物质的量分数 |
| B.A点对应的该反应平衡常数Kp=1.25MPa(Kp为以分压表示的平衡常数) |
| C.B点丙烷的平衡转化率为33.3% |
| D.实际生产过程中需通入一定量水蒸气,其目的是稀释原料气,增大丙烯的平衡产率 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
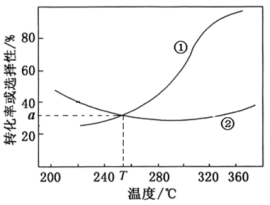
【推荐1】在恒压密闭容器中,充入起始量一定的CO2和H2,主要发生下列反应:

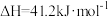

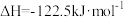
达平衡时,CO2转化率和CO的选择性(CO的选择性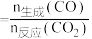 随温度的变化如图所示,下列说法不正确的是。
随温度的变化如图所示,下列说法不正确的是。

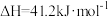

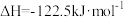
达平衡时,CO2转化率和CO的选择性(CO的选择性
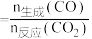 随温度的变化如图所示,下列说法不正确的是。
随温度的变化如图所示,下列说法不正确的是。
| A.图中曲线①表示平衡时CO的选择性随温度的变化 |
B.温度一定,通过增大压强能提高 的平衡产率 的平衡产率 |
C.一定温度下,增大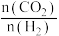 ,一定能降低CO2平衡转化率 ,一定能降低CO2平衡转化率 |
D.T℃时,起始投入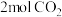 、 、 ,达平衡时生成 ,达平衡时生成 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
【推荐2】在容积可变的密闭容器中充入2mol A和1mol B发生反应:mA(g) + nB(g)  pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是

 pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
| A.维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min) |
| B.P从2×105Pa增加到5×105Pa时,平衡逆向移动 |
C.P为1×106Pa时,平衡常数表达式K=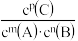 |
D.其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示 |
您最近一年使用:0次
单选题
|
困难
(0.15)
名校
解题方法
【推荐3】甲烷化反应即为氢气和碳氧化物反应生成甲烷,有利于实现碳循环利用。已知涉及的反应如下:
反应Ⅰ: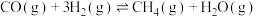 ∆H1<0
∆H1<0
反应Ⅱ: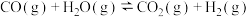 ∆H2<0
∆H2<0
在360℃时,在固定容积的容器中进行上述反应,平衡时CO和H2的转化率及CH4和 CO2的产率随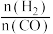 变化的情况如图所示。若按
变化的情况如图所示。若按  向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性=
向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性= 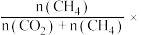 100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是

反应Ⅰ:
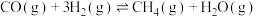 ∆H1<0
∆H1<0反应Ⅱ:
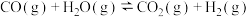 ∆H2<0
∆H2<0在360℃时,在固定容积的容器中进行上述反应,平衡时CO和H2的转化率及CH4和 CO2的产率随
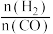 变化的情况如图所示。若按
变化的情况如图所示。若按  向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性=
向恒容容器内投料,初始压强为 p₀[已知:①CH,的选择性= 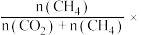 100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
100%;②平衡常数用分压表示,分压=总压×物质的量分数]。 下列说法错误的是
A.图中表示CO转化率变化的曲线是 b, 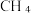 产率变化的曲线是c 产率变化的曲线是c |
B.点 C 通过改变温度达到点 A,则 A、B、C 三点温度由大到小为  |
C.若两个反应达到平衡时总压为  ,CO的平衡转化率为a,则 CH₄的选择性 ,CO的平衡转化率为a,则 CH₄的选择性 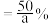 |
D.若两个反应达到平衡时总压为 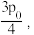 CO的平衡转化率为a,则反应Ⅰ的 CO的平衡转化率为a,则反应Ⅰ的  |
您最近一年使用:0次

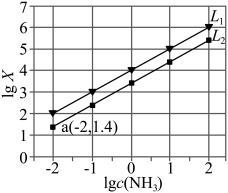
 [Ag(NH3)]+
[Ag(NH3)]+ 或
或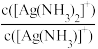 与lgc(NH3)关系如图所示:
与lgc(NH3)关系如图所示: