为实现我国承诺的“碳达峰、碳中和”目标,中国科学院提出了“液态阳光”方案,即将工业生产过程中排放的二氧化碳转化为甲醇,其中反应之一是:
 。回答下列问题:
。回答下列问题:
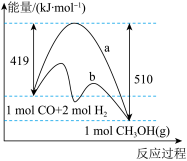
(1)该反应的能量变化如图所示,反应的
______ ,曲线______ (填“a”或“b”)表示使用了催化剂。
(2)相同温度下,若已知反应 的平衡常数为
的平衡常数为 ,反应
,反应 的平衡常数为
的平衡常数为 ,则反应
,则反应 的化学平衡常数K=
的化学平衡常数K=______ (用含 和
和 的代数式表示)。
的代数式表示)。
(3)在恒温恒容密闭容器中按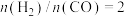 加入反应起始物
加入反应起始物
Ⅰ.下列描述不能说明反应达到平衡状态的是______
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与 的浓度相等 D.容器内CO的体积分数不再变化
的浓度相等 D.容器内CO的体积分数不再变化
II.若CO的平衡转化率[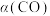 ]随温度的变化曲线如图所示,R、S两点平衡常数大小:
]随温度的变化曲线如图所示,R、S两点平衡常数大小:
______  (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 温度下,测得起始压强
温度下,测得起始压强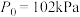 ,达平衡时
,达平衡时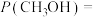
______ kPa。


 。回答下列问题:
。回答下列问题:(1)该反应的能量变化如图所示,反应的


(2)相同温度下,若已知反应
 的平衡常数为
的平衡常数为 ,反应
,反应 的平衡常数为
的平衡常数为 ,则反应
,则反应 的化学平衡常数K=
的化学平衡常数K= 和
和 的代数式表示)。
的代数式表示)。(3)在恒温恒容密闭容器中按
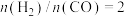 加入反应起始物
加入反应起始物Ⅰ.下列描述不能说明反应达到平衡状态的是
A.容器内压强不再变化 B.氢气的转化率达到最大值
C.容器内CO与
 的浓度相等 D.容器内CO的体积分数不再变化
的浓度相等 D.容器内CO的体积分数不再变化II.若CO的平衡转化率[
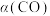 ]随温度的变化曲线如图所示,R、S两点平衡常数大小:
]随温度的变化曲线如图所示,R、S两点平衡常数大小:
 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 温度下,测得起始压强
温度下,测得起始压强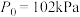 ,达平衡时
,达平衡时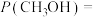

更新时间:2023-12-27 16:20:43
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】合理开发利用 、
、 等含碳化合物对我国实现“碳达峰·碳中和”发展战略具有重要意义。
等含碳化合物对我国实现“碳达峰·碳中和”发展战略具有重要意义。
(1)已知:
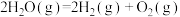
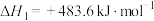

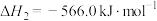
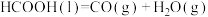
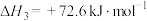
由此可计算反应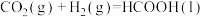 的
的
___________ 。
(2)已知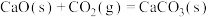
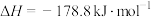 。500℃时,
。500℃时, 与水蒸气重整时主要发生的反应有:
与水蒸气重整时主要发生的反应有: 、
、 ,实际生产中可向重整反应体系中加入适量多孔CaO,理由是
,实际生产中可向重整反应体系中加入适量多孔CaO,理由是___________ 。
(3)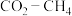 的催化重整反应为
的催化重整反应为 。
。
①恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是___________ (填序号)。
A.单位时间内消耗1mol 的同时生成2mol
的同时生成2mol 
B.密闭容器内的压强不再改变
C.反应速率
D.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
②不同温度和原料配比 对反应出口产物中甲烷含量、
对反应出口产物中甲烷含量、 的影响如图1、图2所示。
的影响如图1、图2所示。


据图1可知,特定 时,在600-850℃范围内
时,在600-850℃范围内 逐渐增大,有同学认为可能是副反应导致,请写出2个可能发生的副反应的化学反应方程式
逐渐增大,有同学认为可能是副反应导致,请写出2个可能发生的副反应的化学反应方程式___________ 。请在图2中画出 =1时出口合成气中
=1时出口合成气中 的变化关系曲线
的变化关系曲线___________ 。
 、
、 等含碳化合物对我国实现“碳达峰·碳中和”发展战略具有重要意义。
等含碳化合物对我国实现“碳达峰·碳中和”发展战略具有重要意义。(1)已知:
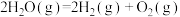
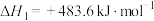

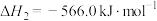
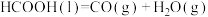
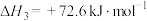
由此可计算反应
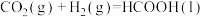 的
的
(2)已知
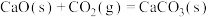
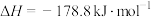 。500℃时,
。500℃时, 与水蒸气重整时主要发生的反应有:
与水蒸气重整时主要发生的反应有: 、
、 ,实际生产中可向重整反应体系中加入适量多孔CaO,理由是
,实际生产中可向重整反应体系中加入适量多孔CaO,理由是(3)
 的催化重整反应为
的催化重整反应为 。
。①恒容绝热密闭容器中,下列能说明该可逆反应已达到平衡状态的是
A.单位时间内消耗1mol
 的同时生成2mol
的同时生成2mol 
B.密闭容器内的压强不再改变
C.反应速率

D.混合气体的密度不再改变
E.混合气体的平均相对分子质量不再改变
②不同温度和原料配比
 对反应出口产物中甲烷含量、
对反应出口产物中甲烷含量、 的影响如图1、图2所示。
的影响如图1、图2所示。

据图1可知,特定
 时,在600-850℃范围内
时,在600-850℃范围内 逐渐增大,有同学认为可能是副反应导致,请写出2个可能发生的副反应的化学反应方程式
逐渐增大,有同学认为可能是副反应导致,请写出2个可能发生的副反应的化学反应方程式 =1时出口合成气中
=1时出口合成气中 的变化关系曲线
的变化关系曲线
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇在化学工业、农业生产等领域都有广泛的应用。请回答:
(1)“氢”风阵阵,甲醇产生氢气的反应为:
 ,
,
已知相关物质的标准燃烧热和标准熵数值如下表:
①
___________ 0(填“>”或“<”)。
②该反应能自发进行的最低温度为___________ K(保留小数点后1位)。
(2)常温下,将一定量甲醇放入真空的恒容密闭容器中,发生:
 。
。
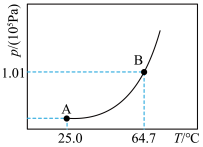
①甲醇达到液气平衡状态时的压强,称为甲醇该温度下的饱和蒸汽压(p),p与温度关系如图所示。请分析B点蒸气压大于A点蒸气压的原因___________ 。
②Raoult定律表明,一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象___________ (用字母表示)。

③实验测定64.5℃时相关物质的饱和蒸气压数值如下表所示:
已知溶液上方蒸气的总压 ,
, ,
, 为甲醇蒸气分压,
为甲醇蒸气分压, 为甲醇和水的蒸气中
为甲醇和水的蒸气中 的物质的量分数。64.5℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数
的物质的量分数。64.5℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数___________ 0.4(填“>”、“<”或“=”),解释采用蒸馏可获得较高浓度甲醇的原因___________ 。
(3)工业用甲醇空气氧化法制甲醛,催化剂为铁钼氧化物。



该反应分两步完成:
反应Ⅰ:


反应Ⅱ:


k、 、
、 为速率方程常数,分压p等于其物质的量分数乘以总压,
为速率方程常数,分压p等于其物质的量分数乘以总压, 为氧化态催化剂的物质的量分数;
为氧化态催化剂的物质的量分数; 为还原态催化剂的物质的量分数;反应Ⅰ为决速步。下列说法
为还原态催化剂的物质的量分数;反应Ⅰ为决速步。下列说法不正确 的是___________。
(1)“氢”风阵阵,甲醇产生氢气的反应为:

 ,
,已知相关物质的标准燃烧热和标准熵数值如下表:
| 化学式 |  |  |  |
标准燃烧热(25℃)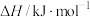 | -726.5 | -285.8 | -283.0 |
标准熵: | 126.8 | 130.7 | 197.7 |

②该反应能自发进行的最低温度为
(2)常温下,将一定量甲醇放入真空的恒容密闭容器中,发生:

 。
。①甲醇达到液气平衡状态时的压强,称为甲醇该温度下的饱和蒸汽压(p),p与温度关系如图所示。请分析B点蒸气压大于A点蒸气压的原因

②Raoult定律表明,一定温度下,在稀溶液中,溶剂的饱和蒸气压等于纯溶剂的饱和蒸气压乘以溶液中溶剂的物质的量分数。下图中甲烧杯盛有甲醇,乙烧杯盛有氢氧化钠的甲醇溶液,常温下,将甲、乙两烧杯置于真空密闭容器中,足够长的时间后,从下图中选择出可能会观察到的现象

③实验测定64.5℃时相关物质的饱和蒸气压数值如下表所示:
| 物质 | 甲醇 | 水 | 甲醇水溶液(甲醇物质的量分数为0.4) | |
| 饱和蒸气压/kPa | 101.3 | 23.90 | 甲醇 | 水 |
| 40.52 | 14.34 | |||
 ,
, ,
, 为甲醇蒸气分压,
为甲醇蒸气分压, 为甲醇和水的蒸气中
为甲醇和水的蒸气中 的物质的量分数。64.5℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数
的物质的量分数。64.5℃时,甲醇水溶液上方饱和蒸气中,甲醇物质的量分数(3)工业用甲醇空气氧化法制甲醛,催化剂为铁钼氧化物。



该反应分两步完成:
反应Ⅰ:



反应Ⅱ:



k、
 、
、 为速率方程常数,分压p等于其物质的量分数乘以总压,
为速率方程常数,分压p等于其物质的量分数乘以总压, 为氧化态催化剂的物质的量分数;
为氧化态催化剂的物质的量分数; 为还原态催化剂的物质的量分数;反应Ⅰ为决速步。下列说法
为还原态催化剂的物质的量分数;反应Ⅰ为决速步。下列说法A. |
| B.用铁钼氧化物来提高反应Ⅰ的平衡转化率 |
C. |
D.若 和 和 的分压增大相同倍数, 的分压增大相同倍数, 比 比 对总反应速率的影响大 对总反应速率的影响大 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】乙二醛(OHC-CHO)是一种重要的精细化工产品。
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g)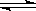 HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
2H2(g)+O2(g)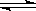 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)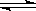 OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
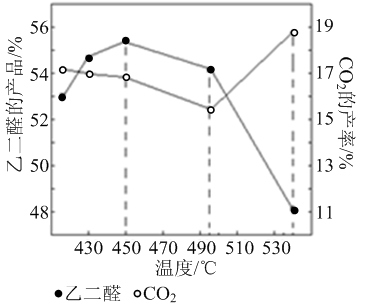
② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
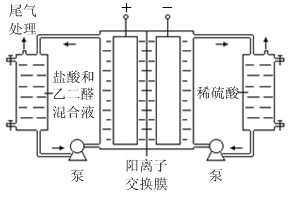
(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η= )
)
Ⅰ.工业生产乙二醛
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为 。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
① 已知:OHC-CHO(g)+2H2(g)
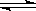 HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K1
HOCH2CH2OH(g) ΔH=-78 kJ·mol-1 K12H2(g)+O2(g)
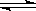 2H2O(g) ΔH=-484 kJ·mol-1 K2
2H2O(g) ΔH=-484 kJ·mol-1 K2乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)
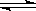 OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
OHC—CHO(g)+2H2O(g)的ΔH= kJ·mol-1。相同温度下,该反应的化学平衡常数K= (用含K1、K2的代数式表示)。
② 当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如下图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是 、
Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如下图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。

(3)阴极电极式为
(4)阳极液中盐酸的作用,除了产生氯气外,还有
(5)保持电流强度为a A,电解t min,制得乙醛酸m g,列式表示该装置在本次电解中的电流效率η=
(设:法拉第常数为f C·mol-1;η=
 )
)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】 是一种重要的化工原料,可由CO或
是一种重要的化工原料,可由CO或 与
与 反应合成,在密闭容器内发生的主要反应如下:
反应合成,在密闭容器内发生的主要反应如下:
Ⅰ.
 (Ⅰ)
(Ⅰ)
Ⅱ.
 (Ⅱ)
(Ⅱ)
其平衡常数的自然对数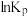 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数),随温度的变化如图所示:
是以分压表示的平衡常数,分压=总压×物质的量分数),随温度的变化如图所示:

(1) 的反应是
的反应是___________ (填标号)。
(2)反应

___________ 0(填“>”或“<”)。
(3)在 ,按照物质的量之比为1∶3的
,按照物质的量之比为1∶3的 和
和 投入恒温恒容容器内催化合成甲醇,反应相同时间时,甲醇的选择性
投入恒温恒容容器内催化合成甲醇,反应相同时间时,甲醇的选择性 、
、 的转化率
的转化率 及CO的选择性
及CO的选择性 与温度的关系如图所示:
与温度的关系如图所示:

①实际生产中选择260℃的原因,除 最大外,还有
最大外,还有___________ 。
②温度高于260℃时,结合平衡移动规律解释升高温度 减小的原因是
减小的原因是___________ 。
③某温度下,平衡时容器的气压为 ,水蒸气的体积分数为37.5%。请计算
,水蒸气的体积分数为37.5%。请计算 (Ⅱ)=
(Ⅱ)=___________ 。
(4)不同压强下。按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示:
的平衡产率随温度的变化关系如下图所示:

已知: 的平衡转化率
的平衡转化率 %;
%;
 的平衡产率
的平衡产率 %
%
其中纵坐标表示 平衡转化率的是图
平衡转化率的是图___________ (填“甲”或“乙”);压强 、
、 、
、 由大到小的顺序为
由大到小的顺序为___________ ;图乙中 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是___________ 。
 是一种重要的化工原料,可由CO或
是一种重要的化工原料,可由CO或 与
与 反应合成,在密闭容器内发生的主要反应如下:
反应合成,在密闭容器内发生的主要反应如下:Ⅰ.

 (Ⅰ)
(Ⅰ)Ⅱ.

 (Ⅱ)
(Ⅱ)其平衡常数的自然对数
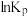 (
( 是以分压表示的平衡常数,分压=总压×物质的量分数),随温度的变化如图所示:
是以分压表示的平衡常数,分压=总压×物质的量分数),随温度的变化如图所示:
(1)
 的反应是
的反应是(2)反应


(3)在
 ,按照物质的量之比为1∶3的
,按照物质的量之比为1∶3的 和
和 投入恒温恒容容器内催化合成甲醇,反应相同时间时,甲醇的选择性
投入恒温恒容容器内催化合成甲醇,反应相同时间时,甲醇的选择性 、
、 的转化率
的转化率 及CO的选择性
及CO的选择性 与温度的关系如图所示:
与温度的关系如图所示:
①实际生产中选择260℃的原因,除
 最大外,还有
最大外,还有②温度高于260℃时,结合平衡移动规律解释升高温度
 减小的原因是
减小的原因是③某温度下,平衡时容器的气压为
 ,水蒸气的体积分数为37.5%。请计算
,水蒸气的体积分数为37.5%。请计算 (Ⅱ)=
(Ⅱ)=(4)不同压强下。按照
 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如下图所示:
的平衡产率随温度的变化关系如下图所示:
已知:
 的平衡转化率
的平衡转化率 %;
%; 的平衡产率
的平衡产率 %
%其中纵坐标表示
 平衡转化率的是图
平衡转化率的是图 、
、 、
、 由大到小的顺序为
由大到小的顺序为 温度时,三条曲线几乎交于一点的原因是
温度时,三条曲线几乎交于一点的原因是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】二甲醚( )是无色气体,可作为一种新型能源。由合成气(组成为
)是无色气体,可作为一种新型能源。由合成气(组成为 、CO和少量CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
、CO和少量CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
①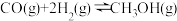
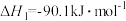
②
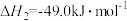
③

④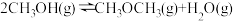
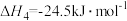 。
。
试回答下列问题:
(1)一步法合成二甲醚是以合成气( )为原料,在一定温度、压强和催化剂作用下进行,由
)为原料,在一定温度、压强和催化剂作用下进行,由 和CO直接制备二甲醚的热化学方程式:
和CO直接制备二甲醚的热化学方程式:

___________ ;判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是___________ 。
A.平均摩尔质量保持不变
B.容器的密度不变
C.容器内压强保持不变
D.单位时间内消耗2moLCO同时消耗1mol二甲醚
(2)燃煤废气中的 转化为二甲醚的反应原理为:
转化为二甲醚的反应原理为: ,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是
,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是___________ 。


A.图1中,反应 的
的 、
、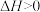
B.图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线B
C.图1中,逆反应速率 :状态Ⅰ<状态Ⅲ
:状态Ⅰ<状态Ⅲ
D.图2中, 对应的平衡常数小于
对应的平衡常数小于 对应的平衡常数
对应的平衡常数
E.图2中,根据图中曲线分析,催化剂Ⅰ的催化效果最好
(3)若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 (总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)

①根据图中数据,温度选择___________ K,达到平衡时,反应体系内甲醇的产量最高。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:___________ 。
(4)利用电化学方法可以将CO2有效地转化为 ,装置如下图所示。
,装置如下图所示。

①在该装置中,右侧Pt电极的电极反应式为___________ 。
②装置工作时,阴极除有 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的 ,电解效率为
,电解效率为___________ (忽略电解前后溶液的体积变化)。已知:电解效应
 )是无色气体,可作为一种新型能源。由合成气(组成为
)是无色气体,可作为一种新型能源。由合成气(组成为 、CO和少量CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
、CO和少量CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:①
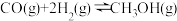
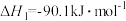
②

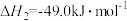
③


④
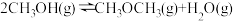
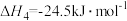 。
。试回答下列问题:
(1)一步法合成二甲醚是以合成气(
 )为原料,在一定温度、压强和催化剂作用下进行,由
)为原料,在一定温度、压强和催化剂作用下进行,由 和CO直接制备二甲醚的热化学方程式:
和CO直接制备二甲醚的热化学方程式:

A.平均摩尔质量保持不变
B.容器的密度不变
C.容器内压强保持不变
D.单位时间内消耗2moLCO同时消耗1mol二甲醚
(2)燃煤废气中的
 转化为二甲醚的反应原理为:
转化为二甲醚的反应原理为: ,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是
,一定条件下,现有两个体积均为2.0L恒容密闭容器甲和乙,在甲中充入1moLCO2和3molH2,在乙中充入2moLCO2和6molH2,发生上述反应并达到平衡。该反应中CO2的平衡转化率随温度的变化曲线如图1所示;容器甲中,在不同催化剂作用下,相同时间内CO2的转化率随温度变化如图2所示。下列说法正确的是

A.图1中,反应
 的
的 、
、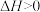
B.图1中,表示乙容器CO2的平衡转化率随温度变化的是曲线B
C.图1中,逆反应速率
 :状态Ⅰ<状态Ⅲ
:状态Ⅰ<状态ⅢD.图2中,
 对应的平衡常数小于
对应的平衡常数小于 对应的平衡常数
对应的平衡常数E.图2中,根据图中曲线分析,催化剂Ⅰ的催化效果最好
(3)若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按
 (总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
(总量为amol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
①根据图中数据,温度选择
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:
(4)利用电化学方法可以将CO2有效地转化为
 ,装置如下图所示。
,装置如下图所示。
①在该装置中,右侧Pt电极的电极反应式为
②装置工作时,阴极除有
 生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的
生成外,还可能生成副产物降低电解效率。标准状况下,当阳极生成氧气体积为448mL时,测得阴极区内的 ,电解效率为
,电解效率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】苯乙烯是一种重要的有机化工原料,可利用乙苯催化脱氢法制备,实际生产中常在体系中充入一定量的CO2,主要反应如下:
I.C8H10(g)=C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1。
回答下列问题:
(1)相比于乙苯直接脱氢制苯乙烯,工业实际生产中充入一定量CO2的优点为___________ (任写一点);二氧化碳与乙苯气体反应生成苯乙烯气体、一氧化碳和水蒸气的热化学方程式为___________ 。
(2)一定温度下,起始向10L盛放催化剂的恒容密闭容器中充入2 mol C8H10(g)和1 molCO2(g)发生反应I和反应II.20min末达到平衡时,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20 min内,用C8H10的物质的量浓度变化表示的平均反应速率v(C8H10)=___________ 。
②反应II的平衡常数Kc=___________ 。
③起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。
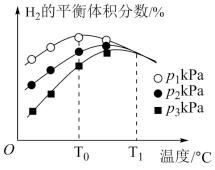
由图可知,温度低于T0℃时,以反应___________ (填“I”或“II”)为主,理由为___________ ;T1℃时,三条曲线几乎相交的原因为___________ ,P1、P2、P3由大到小的顺序为___________ 。
(3)若乙苯催化脱氢过程中发生积碳反应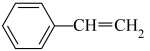 (g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
(g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为___________ (任写一点)。
I.C8H10(g)=C8H8(g)+H2(g) ΔH1=+117.6kJ·mol-1;
II.CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1。
回答下列问题:
(1)相比于乙苯直接脱氢制苯乙烯,工业实际生产中充入一定量CO2的优点为
(2)一定温度下,起始向10L盛放催化剂的恒容密闭容器中充入2 mol C8H10(g)和1 molCO2(g)发生反应I和反应II.20min末达到平衡时,C8H8(g)、H2O(g)的体积分数分别为25%和5%。
①0~20 min内,用C8H10的物质的量浓度变化表示的平均反应速率v(C8H10)=
②反应II的平衡常数Kc=
③起始投料量不变,在不同温度、压强下重复实验,测得H2的平衡体积分数与温度和压强的关系如图所示。

由图可知,温度低于T0℃时,以反应
(3)若乙苯催化脱氢过程中发生积碳反应
 (g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
(g)=8C(s)+4H2(g) ΔH3=-126 kJ·mol-1.积碳反应可能导致的后果为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】向一个容积为2 L的密闭容器中充入4 mol/LA和6 mol/LB,在恒温恒容下发生反应:4A(g)+6B(g) 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
(1)到达平衡前v正_____ v逆(填“>”或者“<”),到达平衡后v正_____ v逆(填“>”、“<”或者“=”)。
(2)增大压强反应速率_____ (填“加快”或者“减慢”),降低温度反应速率_____ (填“加快”或者“减慢”)。
(3)反应开始至平衡时,C的浓度增加了_____ ,以B的浓度变化表示该反应的平均速率v(B)=_____ 。
(4)到达平衡后A的转化率为_____ 。
(5)D的化学计量数x为_____ 。
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是_____ 。
(7)随着反应的进行发现正反应速率逐渐减小,其原因是_____ 。
(8)反应前与到达平衡后的压强之比为_____ 。
 4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。
4C(g)+xD(g),经5 min后达到平衡状态,测得A的浓度为2 mol/L、测得D的化学反应速率为0.4 mol/(L•min)。(1)到达平衡前v正
(2)增大压强反应速率
(3)反应开始至平衡时,C的浓度增加了
(4)到达平衡后A的转化率为
(5)D的化学计量数x为
(6)该条件下反应一段时间,下列能说明反应达到平衡状态的是
| A.气体的密度保持不变 | B.气体的压强保持不变的状态 |
| C.4v正(A)=6v逆(B) | D.B与C浓度保持不变的状态 |
(8)反应前与到达平衡后的压强之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】Ⅰ合成氨在工业上有重要用途,原料氢气来源于天然气。完成下列填空:
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在____ 个平衡。
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:___________________ 。当消耗标况下22.4升富氧空气时,有________ mol电子转移。
(3)H2来自于天然气:CH4(g)+ H2O(g) 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是________ 。(选填编号)
a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显_____ (填“酸”、“碱”或“中”)性;amol/LNH4Cl与a mol/L氨水等体积混合(pH>7),混合溶液中微粒的物质的量浓度由大到小顺序:___________ 。
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中___________ 。 (选填编号)
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:__________________________ 。
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,若恰好完全反应,则该溶液中存在
(2)一定条件下向NH4HS溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
(3)H2来自于天然气:CH4(g)+ H2O(g)
 3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是
3H2(g)+CO(g)。如果该反应在恒容密闭容器中进行,能说明其达到化学平衡状态的是a.υ正(H2)∶υ逆(CO)=3∶1 b.气体密度不再改变
c.c(H2)∶c(CO) =3∶1 d.气体的平均相对分子质量保持不变
Ⅱ氨水是实验室常用的弱碱。
(4)在25℃时,将a mol/L氨水与0.01 mol/L盐酸等体积混合,平衡时,溶液中c(NH4+)=c(Cl-),则溶液显
(5)25℃时CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
a.水的电离程度始终增大
b.正好生成CH3COONH4时,与纯水中H2O的电离程度相同
c.常温下等浓度的NH4Cl和CH3COONa两溶液的pH之和为14
d.当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-)
(6)往CaCl2溶液中通入CO2至饱和,无明显现象,再通一定量氨气后有白色沉淀,请用电离平衡理论解释上述现象:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】(1)一定条件下,向容积为2L的恒容密闭容器中充入1 mol CH3OH(g)和3 mol H2O(g),CH3OH(g) + H2O(g)⇌CO2(g) + 3H2(g)  H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
①达平衡时混合气体的压强是反应前的____________ 倍。
②该条件下反应达平衡状态的依据是(填序号)_______________ 。
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为_____________________ 。
 H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则
H(298K)=+ 49.4 kJ/mol。实验测得:达到平衡状态时,吸收热量19.76 kJ。则①达平衡时混合气体的压强是反应前的
②该条件下反应达平衡状态的依据是(填序号)
A.v正(CH3OH)=v正(CO2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热Q kJ。则表示甲醇燃烧热的热化学方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】100℃时,在1 L恒温恒容的密闭容器中,通入0.1molN2O4,发生反应:N2O4(g) 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。

Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为____ mol·L-1·s-1。
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=____ 。若其他条件不变,升高温度至120℃,达到新平衡时的平衡常数是K2,则K1_____ K2(填“>”、“<”或“=”)。
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是____ 。
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=____ kJ·mol-1。
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g) H2(g)+CO2(g)。
H2(g)+CO2(g)。
(5)下列说法能作为判断该反应达到化学平衡状态的依据的是____ (填字母序号)。
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将___ (填“向右”、“向左”或“不”)移动,达到新的平衡状态后,H2O(g)的体积分数将____ (“变大”、“变小”或“不变”);
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=____ 。(精确到小数点后两位)
 2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
2NO2(g) ΔH=+57.0kJ·mol-1,NO2和N2O4的浓度随时间变化情况如图所示。
Ⅰ.(1)在0~60 s内,以N2O4表示的平均反应速率为
(2)根据图中有关数据,计算100℃时该反应的平衡常数K1=
(3)反应进行到100s时,若只有一项条件发生变化,则变化的条件可能是
A.降低温度 B.通入氦气 C.又往容器中充入N2O4 D.增大容器容积
(4)已知:N2(g)+2O2(g)=2NO2(g) ΔH=+67.2kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534.7kJ·mol-1
N2O4(g)=2NO2(g) ΔH=+57.0kJ·mol-1
则2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=
Ⅱ.向容积为2 L的密闭容器中通入一定量的CO和H2O,发生反应:CO(g)+H2O(g)
 H2(g)+CO2(g)。
H2(g)+CO2(g)。(5)下列说法能作为判断该反应达到化学平衡状态的依据的是
A.容器内CO、H2O、CO2、H2的浓度之比为1∶1∶1∶1
B.CO的消耗速率与H2的消耗速率相等
C.容器内压强保持不变
D.混合气体的密度保持不变
(6)保持其他条件不变:
①若向平衡体系中再通入0.20molH2O(g),平衡将
②在VL密闭容器中通入10molCO和10molH2O(g)发生上述反应,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时其他各成分的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO的燃烧热为283kJ·mol-1,H2的燃烧热为286kJ·mol-1),则T℃平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是重要的化工原料,在生产生活中应用广泛,碳氧化物与氢气在一定条件下可合成甲醇。回答下列问题:
Ⅰ.一氧化碳与氢气合成甲醇的反应为 CO(g)+2H2(g) CH3OH(g) 。在① 、②、③容 积不等的恒容密闭容器中,均充入 0. 1molCO 和 0.2molH2,在催化剂作用下发生上述反 应,测得三个容器中平衡混合物中 CH3OH 的体积分数随温度的变化如图所示:
CH3OH(g) 。在① 、②、③容 积不等的恒容密闭容器中,均充入 0. 1molCO 和 0.2molH2,在催化剂作用下发生上述反 应,测得三个容器中平衡混合物中 CH3OH 的体积分数随温度的变化如图所示:

(1)该反应的正反应为_______ 反应(填“放热”或“吸热”)。
(2)容器的容积①_______ ③(填“>”“<”或“=”)。
(3)P 点时,H2的转化率为_______ ;若其他条件不变,将恒容密闭容器改为恒压密闭容器,平衡后 H2的转化率将_______ (填“增大”“减小”或“不变”)。
Ⅱ.二氧化碳与氢气合成甲醇的主要反应如下:
反应①:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-58kJ/mol
CH3OH(g)+H2O(g) △H1=-58kJ/mol
反应②:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41kJ/mol
CO(g)+H2O(g) △H2=+41kJ/mol
(4)反应时温度控制在 230~280℃之间,温度不能过高的原因是_______ 。
(5)一定条件下,向刚性容器中充入物质的量之比为1:3 的 CO2(g)和H2(g)发生上述反 应。达到平衡时 CO2的转化率为 20% ,CH3OH的选择性为 75%[CH3OH的选择性= ×100%] ,则反应②的平衡常数 Kp=
×100%] ,则反应②的平衡常数 Kp=_______ 。(Kp 为以分压表示的平衡常数)
(6)燃料电池应用前景广泛,燃料电池具有低温快速启动、燃料洁净环保、电池结构简单 等特性,CO 碱性条件下放电时负极的电极反应式为_______ 。
Ⅰ.一氧化碳与氢气合成甲醇的反应为 CO(g)+2H2(g)
 CH3OH(g) 。在① 、②、③容 积不等的恒容密闭容器中,均充入 0. 1molCO 和 0.2molH2,在催化剂作用下发生上述反 应,测得三个容器中平衡混合物中 CH3OH 的体积分数随温度的变化如图所示:
CH3OH(g) 。在① 、②、③容 积不等的恒容密闭容器中,均充入 0. 1molCO 和 0.2molH2,在催化剂作用下发生上述反 应,测得三个容器中平衡混合物中 CH3OH 的体积分数随温度的变化如图所示:
(1)该反应的正反应为
(2)容器的容积①
(3)P 点时,H2的转化率为
Ⅱ.二氧化碳与氢气合成甲醇的主要反应如下:
反应①:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-58kJ/mol
CH3OH(g)+H2O(g) △H1=-58kJ/mol反应②:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41kJ/mol
CO(g)+H2O(g) △H2=+41kJ/mol(4)反应时温度控制在 230~280℃之间,温度不能过高的原因是
(5)一定条件下,向刚性容器中充入物质的量之比为1:3 的 CO2(g)和H2(g)发生上述反 应。达到平衡时 CO2的转化率为 20% ,CH3OH的选择性为 75%[CH3OH的选择性=
 ×100%] ,则反应②的平衡常数 Kp=
×100%] ,则反应②的平衡常数 Kp=(6)燃料电池应用前景广泛,燃料电池具有低温快速启动、燃料洁净环保、电池结构简单 等特性,CO 碱性条件下放电时负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】碳以及碳的化合物在生活中应用广泛。利用CO2合成甲醇不仅能够使二氧化碳得到有效合理的利用,也能解决日益严重的能源危机。由CO2合成甲醇的过程可能涉及如下反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应II:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应III:CO(g)+2H2(g) CH3OH(g) ΔH3
CH3OH(g) ΔH3
回答下列问题:
(1)将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂,发生反应I、II、III。测得不同温度下体系达到平衡时CO2的转化率(a)及甲醇的产率(b)如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是___________ (填字母)。
A.改用高效催化剂 B.升高温度
C.分离出甲醇 D.增加CO2浓度
②据图判断,当温度高于260 ℃后,CO的浓度随着温度的升高而___________ (填“增大”“减小”“不变”或“无法判断”),其原因是___________ 。
(2)一定条件下,在2 L的恒容密闭容器中充入一定量的H2和CO2 (假设仅发生反应Ⅰ)。测得在反应物起始投入量不同时,CO2的平衡转化率与温度的关系如图所示。

反应物起始投入量:
曲线I:n(H2)=3 mol,n(CO2)=1.5 mol
曲线II:n(H2)=3 mol,n(CO2)=2 mol
①根据图中数据判断,要使CO2平衡转化率大于40%,以下条件中最合理的是___________ 。
A.n(H2)=3 mol,n(CO2)=2.5 mol;550 K
B.n(H2)=3 mol,n(CO2)=1.6 mol;550 K
C.n(H2)=3 mol,n(CO2)=1.9 mol;600 K
D.n(H2)=3 mol,n(CO2)=1.5 mol;650 K
②请选择图中数据计算500 K时反应I的平衡常数K=___________ 。
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1反应II:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1反应III:CO(g)+2H2(g)
 CH3OH(g) ΔH3
CH3OH(g) ΔH3回答下列问题:
(1)将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂,发生反应I、II、III。测得不同温度下体系达到平衡时CO2的转化率(a)及甲醇的产率(b)如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是
A.改用高效催化剂 B.升高温度
C.分离出甲醇 D.增加CO2浓度
②据图判断,当温度高于260 ℃后,CO的浓度随着温度的升高而
(2)一定条件下,在2 L的恒容密闭容器中充入一定量的H2和CO2 (假设仅发生反应Ⅰ)。测得在反应物起始投入量不同时,CO2的平衡转化率与温度的关系如图所示。

反应物起始投入量:
曲线I:n(H2)=3 mol,n(CO2)=1.5 mol
曲线II:n(H2)=3 mol,n(CO2)=2 mol
①根据图中数据判断,要使CO2平衡转化率大于40%,以下条件中最合理的是
A.n(H2)=3 mol,n(CO2)=2.5 mol;550 K
B.n(H2)=3 mol,n(CO2)=1.6 mol;550 K
C.n(H2)=3 mol,n(CO2)=1.9 mol;600 K
D.n(H2)=3 mol,n(CO2)=1.5 mol;650 K
②请选择图中数据计算500 K时反应I的平衡常数K=
您最近一年使用:0次



