解题方法
1 . 已知在催化剂存在条件下,能发生如下反应:CO+H2O H2 +CO2 +Q
H2 +CO2 +Q
(1)该反应的平衡常数表达式为:___ 。在5L盛有固体催化剂(其体积可忽略不计)的密闭容器中,通入反应物,10s后,生成了氢气0.4g,则此10s内CO的平均反应速率为v(CO)=__ 。
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是__ 。
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1:1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:
A.在第20s时将容器体积缩小至原来的一半后压强变化图___
B.在第20s时,向容器中注入少量的CO气体后正逆反应速率变化图___
(4)某化学小组在做澄清石灰水导电性实验时,发现石墨两极产生气体,溶液出现白色浑浊,请根据已有知识推测,两极产生的气体可能是__ ,白色浑浊是___ 。为验证白色浑浊物的成分,该同学向白色浑浊液体中加入盐酸,没有观察到气泡产生。他们继续实验,将浑浊的液体倒入密闭容器,通过注射器注入稀盐酸,并用二氧化碳传感器来测定装置中二氧化碳含量的变化,装置和图象如图所示:
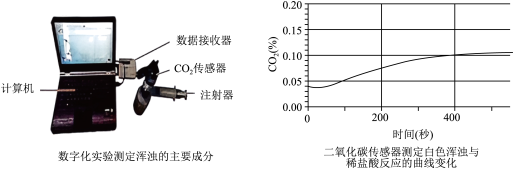
请解释上述现象并分析产生白色浑浊可能的原因___ 。
 H2 +CO2 +Q
H2 +CO2 +Q(1)该反应的平衡常数表达式为:
(2)在该密闭容器中,下列叙述可以说明反应已经达到平衡状态的是
A.若容器体积不变,在一定温度下压强达到恒定
B.CO2的生成速率与H2O蒸气的生成速率之比为1:1
C.CO、H2O、H2、CO在容器中的物质的量浓度保持不变
D.反应体系中混合物的平均摩尔质量保持不变
(3)在上述反应达平衡状态后,分别改变条件,请完成下列两张图:

A.在第20s时将容器体积缩小至原来的一半后压强变化图
B.在第20s时,向容器中注入少量的CO气体后正逆反应速率变化图
(4)某化学小组在做澄清石灰水导电性实验时,发现石墨两极产生气体,溶液出现白色浑浊,请根据已有知识推测,两极产生的气体可能是

请解释上述现象并分析产生白色浑浊可能的原因
您最近一年使用:0次
名校
解题方法
2 . I.环氧乙烷( )常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:
)常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:

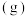
 。
。
(1)该反应在___________ (填“高温”或“低温”)条件下自发进行。试说明理由___________ 。
(2)化工生产设计时,常用串联多个反应器的工艺方法进行合成,并在两个相同的反应器中间加产物吸收装置和热交换降温装置,设计这种工艺的目的是___________ 。
(3)在恒容密闭容器中,利用乙烯氧化法制备环氧乙烷(不考虑副反应),下列情况能说明该反应一定达到化学平衡状态的是___________。
II.反应过程中常伴随副反应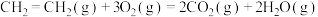
 ,在恒容密闭容器中充入
,在恒容密闭容器中充入 乙烯和含
乙烯和含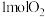 的净化空气,在
的净化空气,在 (耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率
(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率 及
及 的分压随温度变化如图所示:
的分压随温度变化如图所示:

(4)比较 点
点 和
和
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(5)若 时测得环氧乙烷的选择性为
时测得环氧乙烷的选择性为 (某产物的选择性
(某产物的选择性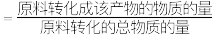 ,计算该温度下主反应的平衡常数(用物质分压表示)
,计算该温度下主反应的平衡常数(用物质分压表示)
___________ 。(用含 的式子表示)
的式子表示)
III.有研究人员对该制备过程的催化剂(其他条件相同)催化机理进行研究,发现 通过对
通过对 的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有
的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有 等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。

(6)根据以上研究结果下列推测合理的是___________ 。
A.由图可知中间体 更容易形成
更容易形成
B.杂质气体 能与催化剂反应而使催化剂失去活性
能与催化剂反应而使催化剂失去活性
C.催化剂 并未参与反应
并未参与反应
IV.工业上也可以通过电化学方法获得环氧乙烷,原理如图所示:

(7) 电极是该电解池的
电极是该电解池的___________ 极。
(8)该电池阴极电极反应式为___________ 。
 )常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:
)常用于医学消毒,工业上常用乙烯氧化法生产,其反应原理为:

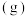
 。
。(1)该反应在
(2)化工生产设计时,常用串联多个反应器的工艺方法进行合成,并在两个相同的反应器中间加产物吸收装置和热交换降温装置,设计这种工艺的目的是
(3)在恒容密闭容器中,利用乙烯氧化法制备环氧乙烷(不考虑副反应),下列情况能说明该反应一定达到化学平衡状态的是___________。
| A.混合气体的密度保持不变 | B.混合气体的平均摩尔质量保持不变 |
C.乙烯和氧气的物质的量比为 | D.每消耗 同时消耗 同时消耗 环氧乙烷 环氧乙烷 |
II.反应过程中常伴随副反应
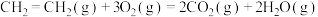
 ,在恒容密闭容器中充入
,在恒容密闭容器中充入 乙烯和含
乙烯和含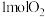 的净化空气,在
的净化空气,在 (耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率
(耐热)催化下发生上述两个反应,反应相同时间后测得乙烯的转化率 及
及 的分压随温度变化如图所示:
的分压随温度变化如图所示:
(4)比较
 点
点 和
和
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)若
 时测得环氧乙烷的选择性为
时测得环氧乙烷的选择性为 (某产物的选择性
(某产物的选择性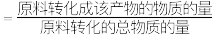 ,计算该温度下主反应的平衡常数(用物质分压表示)
,计算该温度下主反应的平衡常数(用物质分压表示)
 的式子表示)
的式子表示)III.有研究人员对该制备过程的催化剂(其他条件相同)催化机理进行研究,发现
 通过对
通过对 的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有
的吸附完成催化作用,形成的两种中间体相对能量如图所示,研究还发现若原料气(混有 等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
等杂质)不净化,两个中间体和产物环氧乙烷都几乎检测不到。
(6)根据以上研究结果下列推测合理的是
A.由图可知中间体
 更容易形成
更容易形成B.杂质气体
 能与催化剂反应而使催化剂失去活性
能与催化剂反应而使催化剂失去活性C.催化剂
 并未参与反应
并未参与反应IV.工业上也可以通过电化学方法获得环氧乙烷,原理如图所示:

(7)
 电极是该电解池的
电极是该电解池的(8)该电池阴极电极反应式为
您最近一年使用:0次
名校
3 . Ⅰ.为了实现“碳达峰和碳中和”目标,科学家利用C3N4/Cu催化剂(CuNPs)加氢还原CO2制备烃类和烃类含氧衍生物,实现太阳能综合利用。如图所示:
(1)上述装置中能量转化形式主要是________
太阳能→___________能→___________能。
(2)图中采用___________ (填“质子”或“阴离子”)交换膜。
(3)下列措施不利于绿色低碳发展的是___________。
Ⅱ.CO2催化加氢制甲醇(CH3OH)是实现碳达峰、碳中和的途径之一,其反应可表示为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
(4)写出该反应的平衡常数表达式K=___________ 。
(5)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。 =
=___________ kJ/mol。第①步反应的热化学方程式为___________ 。
(6)一定温度下,在一体积固定的密闭容器中投入一定量的CO2和H2进行上述总反应,达到平衡后,改变下列1个条件,反应速率和CO2平衡转化率都增大的是___________。
(7)下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO2,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
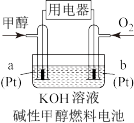
Ⅲ.该反应的产物甲醇燃烧电池具有很多优点。
(8)在碱性甲醇燃料电池中,Pt(a)发生___________ (填“氧化”或“还原”)反应:在酸性甲醇燃料电池中,电极b上发生的电极反应式为___________ 。

(1)上述装置中能量转化形式主要是
太阳能→___________能→___________能。
(2)图中采用
(3)下列措施不利于绿色低碳发展的是___________。
| A.使用氢能源车 | B.杭州西站光伏发电 |
| C.使用脱硫煤发电 | D.使用可循环快递箱 |
Ⅱ.CO2催化加氢制甲醇(CH3OH)是实现碳达峰、碳中和的途径之一,其反应可表示为:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
(4)写出该反应的平衡常数表达式K=
(5)该反应分两步进行,反应过程能量变化如图所示,所有物质均为气态。
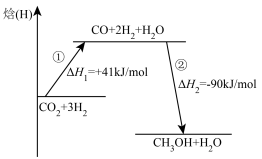
 =
=(6)一定温度下,在一体积固定的密闭容器中投入一定量的CO2和H2进行上述总反应,达到平衡后,改变下列1个条件,反应速率和CO2平衡转化率都增大的是___________。
| A.加入高效催化剂 | B.增大CO2浓度 | C.缩小容器容积 | D.升高温度 |
(7)下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO2与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO2,同时生成1molCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
Ⅲ.该反应的产物甲醇燃烧电池具有很多优点。
(8)在碱性甲醇燃料电池中,Pt(a)发生

您最近一年使用:0次
解题方法
4 . 硫酸是当今世界上最重要的化工产品之一、工业制硫酸主要采用接触法,以黄铁矿(FeS2)为原料制备硫酸的主要设备和流程如图。

(1)“沸腾炉”中主要发生的反应为 。在VL的沸腾炉中,a分钟内生成了b克的SO2,则用SO2来表示该反应的速率
。在VL的沸腾炉中,a分钟内生成了b克的SO2,则用SO2来表示该反应的速率_______ mol∙L-1∙min-1(用a、b等代数式描述)
(2)如图装置(尾气处理装置省略)可实现SO2到SO3的转化,图中的集气瓶可能有的作用是_______

(3)500℃时在转化器室中达到平衡状态的标志是_______(填正确答案标号)。
(4)“吸收塔”中用于吸收SO3的试剂为_______ (填“水”或“浓硫酸”)。
(5)环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为_______ 。

(1)“沸腾炉”中主要发生的反应为
 。在VL的沸腾炉中,a分钟内生成了b克的SO2,则用SO2来表示该反应的速率
。在VL的沸腾炉中,a分钟内生成了b克的SO2,则用SO2来表示该反应的速率(2)如图装置(尾气处理装置省略)可实现SO2到SO3的转化,图中的集气瓶可能有的作用是_______

| A.预热反应气体 | B.干燥SO2和O2气体 |
| C.使SO2、O2混合均匀 | D.控制SO2、O2的流速 |
| A.压强不再变化 | B.密度不再变化 |
C.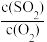 不再变化 不再变化 | D.平均摩尔质量不再变 |
(5)环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为
您最近一年使用:0次
5 . 合成氨对人类生存具有重大意义,反应为: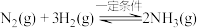
(1) 的空间结构是
的空间结构是_______ 。
(2)传统合成氨工艺是将 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入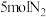 、
、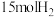 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
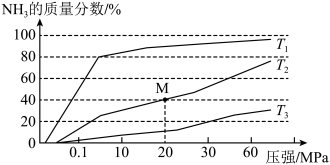
①温度 、
、 、
、 大小关系是
大小关系是_______ 。
②M点的平衡常数K=_______ (可用分数表示)。
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入 ,b处通入
,b处通入 。
。
①该装置中的能量转化形式是:_______ 能转化为_______ 能。
②导线中电子移动方向是_______ (填“a→b”或“b→a”)。
③相比传统工业合成氨,该方法的优点有_______ (任写一点)。
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知: 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
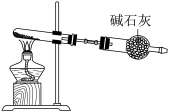
(5)温度为 时,将
时,将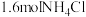 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:
①4~7min,HCl的平均反应速率为_______ 。
②其它条件不变,9min后,向容器中加入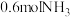 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,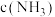
_______ (填“增大”、“减小”或“不变”)。
③下列描述中,可以表明该反应达到化学平衡状态的是_______ 。
A.容器中固体质量不变
B.容器中 的含量不变
的含量不变
C.容器中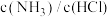 的比值不变
的比值不变
D.容器中气体压强不变
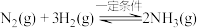
(1)
 的空间结构是
的空间结构是(2)传统合成氨工艺是将
 和
和 在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入
在高温、高压条件下发生反应。若向容积为1.0L的反应容器中投入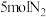 、
、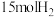 ,在不同温度下分别达平衡时,混合气中
,在不同温度下分别达平衡时,混合气中 的质量分数随压强变化的曲线如图所示。
的质量分数随压强变化的曲线如图所示。
①温度
 、
、 、
、 大小关系是
大小关系是②M点的平衡常数K=
(3)目前科学家利用生物燃料电池原理,研究室温下合成氨并取得初步成果,如图所示:

已知:a处通入
 ,b处通入
,b处通入 。
。①该装置中的能量转化形式是:
②导线中电子移动方向是
③相比传统工业合成氨,该方法的优点有
(4)实验室中制备氨气的方式有很多,例如加热浓氨水、加热某些铵盐固体等。
已知:
 是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
是强氧化性酸,以下哪个铵盐可置于如图装置试管中,通过加热分解制备少量氨气_______。
A. | B. | C. | D.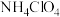 |
 时,将
时,将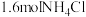 固体置于10L恒容密闭容器中,发生反应:
固体置于10L恒容密闭容器中,发生反应: ,一段时间后达到平衡。反应过程中测定的数据如表:
,一段时间后达到平衡。反应过程中测定的数据如表:| t/min | 2 | 4 | 7 | 9 |
 | 0.4 | 0.5 | 0.6 | 0.6 |
②其它条件不变,9min后,向容器中加入
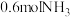 和0.6molHCl,再达平衡时,
和0.6molHCl,再达平衡时,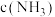
③下列描述中,可以表明该反应达到化学平衡状态的是
A.容器中固体质量不变
B.容器中
 的含量不变
的含量不变C.容器中
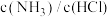 的比值不变
的比值不变 D.容器中气体压强不变
您最近一年使用:0次



