名校
1 . 天然气是一种重要的化工原料,现代工业中常用天然气生产氢气、一氧化碳、甲醇等高附加值化学品,或是将其用于燃料电池。
(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.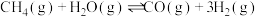
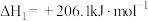
Ⅱ.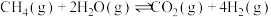
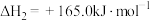
Ⅲ.
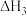
①反应Ⅱ在___________ (填“高温”、“低温”或“任何温度”)下为自发反应,反应Ⅲ的反应热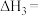
___________ 。
②已知反应I的正、逆反应活化能分别为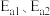 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为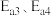 ,则
,则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③在一定条件下,向恒容密闭容器中通入1mol 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是___________ (填序号)。
A.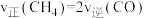
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D. 与
与 的物质的量之比不再改变
的物质的量之比不再改变
④一定条件下,向体积为VL的恒容密闭容器中通入1mol 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为___________  ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为___________  。
。
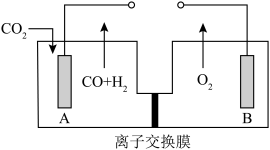
(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为___________ ;若向 时刻的溶液中加入
时刻的溶液中加入___________ molKOH并将溶液混匀,可使溶液中只含有一种溶质。

(1)用天然气作原料制取氢气和一氧化碳的主要反应如下:
I.
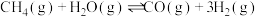
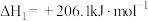
Ⅱ.
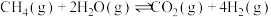
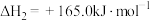
Ⅲ.

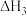
①反应Ⅱ在
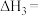
②已知反应I的正、逆反应活化能分别为
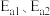 ,反应Ⅱ的正、逆反应活化能分别为
,反应Ⅱ的正、逆反应活化能分别为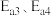 ,则
,则
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③在一定条件下,向恒容密闭容器中通入1mol
 和2mol
和2mol ,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是
,若只发生反应Ⅲ,则下列现象可以说明反应Ⅲ达到平衡的是A.
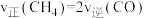
B.气体平均相对分子质量不再改变
C.气体密度不再改变
D.
 与
与 的物质的量之比不再改变
的物质的量之比不再改变④一定条件下,向体积为VL的恒容密闭容器中通入1mol
 和1mol
和1mol ,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中
,发生反应I、Ⅱ、Ⅲ,达到平衡时,容器中 和
和 的物质的量均为0.2mol,此时CO的浓度为
的物质的量均为0.2mol,此时CO的浓度为 ,反应Ⅲ的平衡常数为
,反应Ⅲ的平衡常数为 。
。(2)设计以天然气为燃料的电池,可以提高能源利用率。某燃料电池装置如图所示,A、B为多孔性碳棒。向该电池中持续通入
 ,
, 时刻,已消耗的
时刻,已消耗的 体积为67.2L(标准状况下),继续通入
体积为67.2L(标准状况下),继续通入 ,此时负极的电极反应式为
,此时负极的电极反应式为 时刻的溶液中加入
时刻的溶液中加入
您最近一年使用:0次
名校
2 . 为探讨化学平衡移动原理与氧化还原反应规律的联系,重庆八中某化学兴趣小组成员通过改变浓度研究反应“2Fe3++2I- 2Fe2++I2” 中Fe3+和Fe2+的相互转化,实验设计如图:
2Fe2++I2” 中Fe3+和Fe2+的相互转化,实验设计如图:
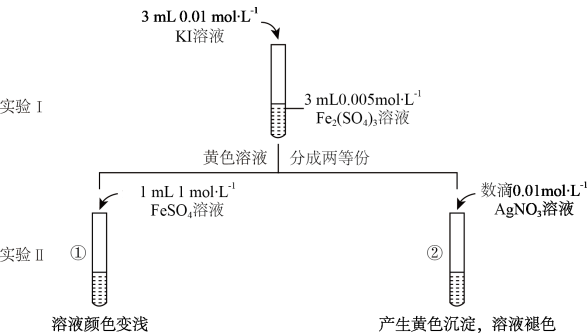
回答下列问题:
(1)待实验I溶液颜色不再改变时,再进行实验II,其目的是确保实验I的反应达到_______ 。
(2)甲同学认为实验II—①中现象产生的原因是c(Fe2+)增大,平衡逆向移动。但乙同学认为此实验不能排除溶液稀释对颜色造成的影响,应增加一个对照实验,即另取等量的黄色溶液,加入_______ ,若______ (填实验现象),则能排除溶液稀释对颜色造成的影响。
(3)实验II—②中产生黄色沉淀的离子方程式为_______ ,用平衡移动原理解释实验II—②中溶液褪色的原因:_______ 。
(4)丙同学推测实验II-②中Fe2+向Fe3+转化的 原因是外加Ag+使c(I-)下降,导致I-的还原性弱于Fe2+,于是设计了如图所示的装置,验证了这一结论。
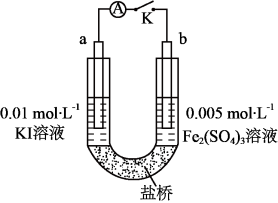
①当K闭合时,电流计指针右偏,此时b极发生的电极反应方程式为_______ 。
②电流计指针归零后,向U形管左侧滴加0.01 mol·L-1AgNO3溶液,产生黄色沉淀,同时_______ (填实验现象)后证实了丙同学的推测。
(5)按照(4)的原理,丙同学又用同样的装置证实了实验II-①中Fe2+向Fe3+转化的原因是外加Fe2+使c(Fe3+)增大,导致Fe2+的还原性强于I-。结合实验I、II,对比(2)—(4)和(5),你能得出的结论是_______ 。
 2Fe2++I2” 中Fe3+和Fe2+的相互转化,实验设计如图:
2Fe2++I2” 中Fe3+和Fe2+的相互转化,实验设计如图: 
回答下列问题:
(1)待实验I溶液颜色不再改变时,再进行实验II,其目的是确保实验I的反应达到
(2)甲同学认为实验II—①中现象产生的原因是c(Fe2+)增大,平衡逆向移动。但乙同学认为此实验不能排除溶液稀释对颜色造成的影响,应增加一个对照实验,即另取等量的黄色溶液,加入
(3)实验II—②中产生黄色沉淀的离子方程式为
(4)丙同学推测实验II-②中Fe2+向Fe3+转化的 原因是外加Ag+使c(I-)下降,导致I-的还原性弱于Fe2+,于是设计了如图所示的装置,验证了这一结论。

①当K闭合时,电流计指针右偏,此时b极发生的电极反应方程式为
②电流计指针归零后,向U形管左侧滴加0.01 mol·L-1AgNO3溶液,产生黄色沉淀,同时
(5)按照(4)的原理,丙同学又用同样的装置证实了实验II-①中Fe2+向Fe3+转化的原因是外加Fe2+使c(Fe3+)增大,导致Fe2+的还原性强于I-。结合实验I、II,对比(2)—(4)和(5),你能得出的结论是
您最近一年使用:0次
解题方法
3 . 二氧化碳的排放受到环境和能源领域的关注,其综合利用是研究的重要课题。
I.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,实现循环内零碳排放。
(1)已知:反应①: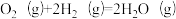
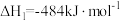
反应②: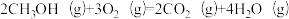
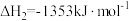
反应③: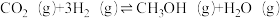 △H3。
△H3。
△H3=__________ kJ·mol-1,下列叙述中能说明反应③达到平衡状态的是________ (填字母)。
A.断裂3molC-H的同时生成1molC=O
B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化
D.v正(CO2)= v正(H2O)
(2)压强为0.1MPa时,在密闭容器中按n(CO2):n(H2)=1:3投料,通过反应③合成甲醇,还发生副反应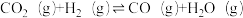
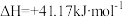 ,得CO2的平衡转化率如图所示。
,得CO2的平衡转化率如图所示。
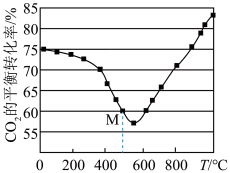
①温度高于570℃后,CO2平衡转化率随温度升高而增大的原因是_______________ 。
②图中M点CO2的平衡转化率为60%,若CH3OH的选择性为 (转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为
(转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为_______________ MPa。
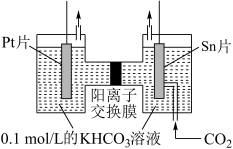
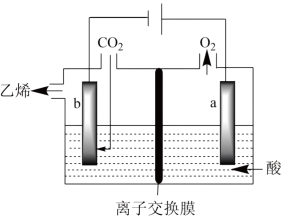
Ⅱ.以甲醇和二氧化碳为原料,利用活性催化电极电解制备甲酸(甲酸盐)的原理如图。

(3)该装置中电子流动方向是_______________ :_____→_____,_____→_____。(用“A”“B”“a”“b”表示)
(4)电解过程中阴极的电极反应式为_______________ 。
(5)若有1molH+通过质子交换膜时,装置内生成HCOOˉ和HCOOH的物质的量的差为_______________ mol。
I.第19届亚洲运动会使用废碳再生的绿色零碳甲醇作为主火炬塔燃料,实现循环内零碳排放。
(1)已知:反应①:
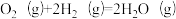
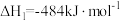
反应②:
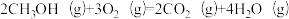
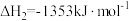
反应③:
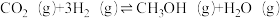 △H3。
△H3。△H3=
A.断裂3molC-H的同时生成1molC=O
B.恒容条件下,体系压强不再变化
C.恒容条件下,气体的密度不再变化
D.v正(CO2)= v正(H2O)
(2)压强为0.1MPa时,在密闭容器中按n(CO2):n(H2)=1:3投料,通过反应③合成甲醇,还发生副反应
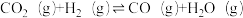
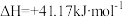 ,得CO2的平衡转化率如图所示。
,得CO2的平衡转化率如图所示。
①温度高于570℃后,CO2平衡转化率随温度升高而增大的原因是
②图中M点CO2的平衡转化率为60%,若CH3OH的选择性为
 (转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为
(转化的CO2中生成CH3OH的百分比,则该温度下容器中H2O(g)的平衡分压为Ⅱ.以甲醇和二氧化碳为原料,利用活性催化电极电解制备甲酸(甲酸盐)的原理如图。

(3)该装置中电子流动方向是
(4)电解过程中阴极的电极反应式为
(5)若有1molH+通过质子交换膜时,装置内生成HCOOˉ和HCOOH的物质的量的差为
您最近一年使用:0次
4 . 氢能是一种绿色能源,氢能产业是我国战略性新兴产业的重点发展方向。
(1)甲烷和水蒸气催化制氢气主要反应如下:
I.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ/mol
II.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
已知:几种共价键的键能如下表。
①ΔH2=_____________________ kJ/mol
②在恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是_______ (填标号)。
A.气体混合物的密度不再变化
B.CO消耗速率和H₂的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
(2)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。在催化剂作用下,HCOOH分解生成CO2和H2的反应机理如图1所示。若HCOOD在该条件下催化释氢,反应生成CO2和_______ (填化学式)。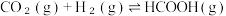 的速率公式为
的速率公式为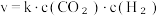 (k为速率常数,只与温度、催化剂有关)。已知经验公式
(k为速率常数,只与温度、催化剂有关)。已知经验公式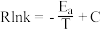 (其中Eₐ、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与
(其中Eₐ、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与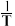 的关系如图2所示,则活化能,Ea=
的关系如图2所示,则活化能,Ea=_______ kJ∙mol-1。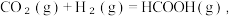 保持总压强为140kPa,测得CO2的平衡转化率与温度之间的关系如图3所示。曲线a代表的投料比为
保持总压强为140kPa,测得CO2的平衡转化率与温度之间的关系如图3所示。曲线a代表的投料比为_______ 。X点条件下,用平衡分压代替平衡浓度计算的平衡常数Kp=_______ kPa-1(分压=总压×物质的量分数)。_______ ;当电路中转移4mole-时,理论上该装置能收集到标准状况下气体的体积为_______ L。
(1)甲烷和水蒸气催化制氢气主要反应如下:
I.CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=+206.2kJ/mol
II.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2
已知:几种共价键的键能如下表。
| 共价键 | C O O | O-H | C=O | H-H |
| 键能/(kJ·mol-¹) | 1075 | 463 | 803 | 436 |

②在恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是
A.气体混合物的密度不再变化
B.CO消耗速率和H₂的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
(2)CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。在催化剂作用下,HCOOH分解生成CO2和H2的反应机理如图1所示。若HCOOD在该条件下催化释氢,反应生成CO2和

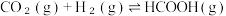 的速率公式为
的速率公式为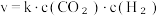 (k为速率常数,只与温度、催化剂有关)。已知经验公式
(k为速率常数,只与温度、催化剂有关)。已知经验公式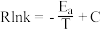 (其中Eₐ、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与
(其中Eₐ、k分别为活化能、速率常数,R、C为常数,T为温度)。在催化剂作用下,测得Rlnk与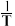 的关系如图2所示,则活化能,Ea=
的关系如图2所示,则活化能,Ea=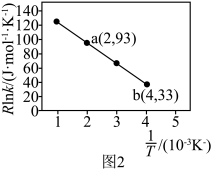
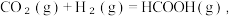 保持总压强为140kPa,测得CO2的平衡转化率与温度之间的关系如图3所示。曲线a代表的投料比为
保持总压强为140kPa,测得CO2的平衡转化率与温度之间的关系如图3所示。曲线a代表的投料比为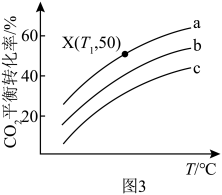
您最近一年使用:0次
名校
解题方法
5 . 良好生态环境是实现中华民族永续发展的内在要求,是增进民生福祉的优先领域,是建设美丽中国的重要基础。硫氧化物和氮氧化物是引起大气环境污染的主要污染物。
(1)氨气可作为脱硝剂。在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应: 。
。
能说明该反应已达到平衡状态标志的是______ (填字母序号)。
a.体系温度不变
b.反应速率
c.容器内压强不再随时间而发生变化
d.容器内 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化
e.容器内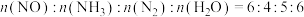
(2)一定温度下,在 恒容密闭容器内发生反应
恒容密闭容器内发生反应 ,
,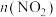 随时间的变化如表:
随时间的变化如表:
① 内,该反应的平均速率
内,该反应的平均速率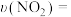
______  。
。
②该温度下,反应 的平衡常数
的平衡常数
______  。
。
(3)对于反应 ,用平衡时各组分压强关系表达的平衡常数
,用平衡时各组分压强关系表达的平衡常数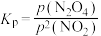 。在一定条件下
。在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: ,
, 。其中
。其中 、
、 是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
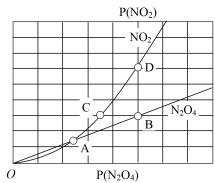
一定温度下, 、
、 与平衡常数
与平衡常数 的关系是
的关系是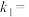
______ 。在上图标出的点中,指出能表示反应达到平衡状态的点并说明理由______ 。
(4)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能(忽略气体溶解)。
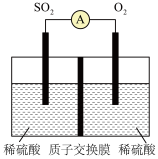
①质子交换膜右侧的溶液在反应后pH______ (填“增大”、“减小”或“不变”)。
②当外电路通过0.2mole-时,质子交换膜左侧的溶液质量______ (填“增大”或“减小”)______ g。
(1)氨气可作为脱硝剂。在绝热恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:
 。
。能说明该反应已达到平衡状态标志的是
a.体系温度不变
b.反应速率

c.容器内压强不再随时间而发生变化
d.容器内
 的物质的量分数不再随时间而发生变化
的物质的量分数不再随时间而发生变化e.容器内
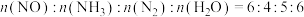
(2)一定温度下,在
 恒容密闭容器内发生反应
恒容密闭容器内发生反应 ,
,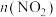 随时间的变化如表:
随时间的变化如表:时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
 内,该反应的平均速率
内,该反应的平均速率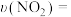
 。
。②该温度下,反应
 的平衡常数
的平衡常数
 。
。(3)对于反应
 ,用平衡时各组分压强关系表达的平衡常数
,用平衡时各组分压强关系表达的平衡常数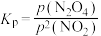 。在一定条件下
。在一定条件下 与
与 的消耗速率与自身压强间存在关系:
的消耗速率与自身压强间存在关系: ,
, 。其中
。其中 、
、 是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
是与反应及温度有关的常数。相应的消耗速率与压强的关系如图所示:
一定温度下,
 、
、 与平衡常数
与平衡常数 的关系是
的关系是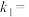
(4)用电化学法模拟工业处理SO2。将硫酸工业尾气中的SO2通入如图装置(电极均为惰性材料)进行实验,可用于制备硫酸,同时获得电能(忽略气体溶解)。

①质子交换膜右侧的溶液在反应后pH
②当外电路通过0.2mole-时,质子交换膜左侧的溶液质量
您最近一年使用:0次
名校
解题方法
6 . 我国向国际社会承诺,2023年买现“碳达峰”,2060年实现“碳中和”
(1)二氧化碳加氢制备甲醇可以实现二氧化碳的转化利用,有利于二氧化碳的减排。
已知:反应A:
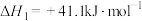
反应B:
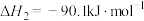
 与
与 反应生成
反应生成 和
和 的热化学反应方程式为
的热化学反应方程式为_______ 。
(2)500℃时,在2L恒容密闭容器中充入2mol 和6mol
和6mol  ,发生反应:
,发生反应: ,平衡时体系压强为
,平衡时体系压强为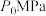 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。

①0~4min,平均反应速率
_______ 。
②平衡时H2的转化率为_______ 。
③下列能说明该反应已达到平衡状态的是_______ 。
A.气体的密度不再变化 B.容器内气体的压强不再变化
C. D.
D. 、
、 、
、 和
和 浓度之比为1:3:1:1
浓度之比为1:3:1:1
④该温度下平衡常数
_______  (用含
(用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。
(3)一定比例的 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点_______ (填是或不是)处于平衡状态。490K之后,甲醇产率下降的原因是_______ 。

(4)电解法转化 可实现
可实现 的资源化利用,电解
的资源化利用,电解 制
制 的原理示意图如图所示:装置中Pt片应与电源的
的原理示意图如图所示:装置中Pt片应与电源的_______ 极相连,反应时阴极电极反应式为_______ 。
(1)二氧化碳加氢制备甲醇可以实现二氧化碳的转化利用,有利于二氧化碳的减排。
已知:反应A:

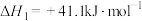
反应B:

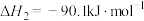
 与
与 反应生成
反应生成 和
和 的热化学反应方程式为
的热化学反应方程式为(2)500℃时,在2L恒容密闭容器中充入2mol
 和6mol
和6mol  ,发生反应:
,发生反应: ,平衡时体系压强为
,平衡时体系压强为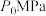 ,测得
,测得 和
和 的浓度随时间变化如图所示。
的浓度随时间变化如图所示。
①0~4min,平均反应速率

②平衡时H2的转化率为
③下列能说明该反应已达到平衡状态的是
A.气体的密度不再变化 B.容器内气体的压强不再变化
C.
 D.
D. 、
、 、
、 和
和 浓度之比为1:3:1:1
浓度之比为1:3:1:1④该温度下平衡常数

 (用含
(用含 的代数式表示,
的代数式表示, 为以分压表示的平衡常数,分压=总压×物质的量分数)。
为以分压表示的平衡常数,分压=总压×物质的量分数)。(3)一定比例的
 和
和 在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点
在装有催化剂的反应器中反应12小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如图所示。温度为470K时,图中P点
(4)电解法转化
 可实现
可实现 的资源化利用,电解
的资源化利用,电解 制
制 的原理示意图如图所示:装置中Pt片应与电源的
的原理示意图如图所示:装置中Pt片应与电源的
您最近一年使用:0次
2022-09-06更新
|
390次组卷
|
2卷引用:重庆市九龙坡区2021--2022学年高二上学期期末质检化学试题
名校
7 . 研究氮的相关化合物在化工生产中有重要意义
(1)反应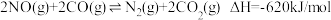 ,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应
,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应_______ (填“①”“②”或“③”),图中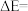
_______ 
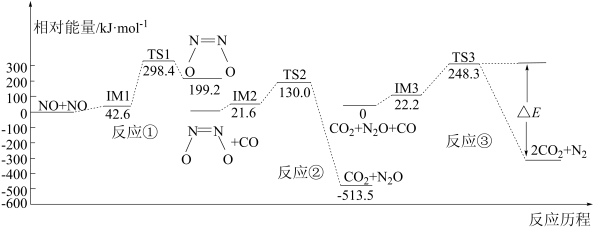
(2)硝化反应是最普遍和最早发现的有机反应之一,以 为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用
为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用 臭氧化法制备
臭氧化法制备 ,其反应为
,其反应为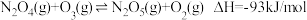 ,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)
,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)
(3)在密闭容器中充入 和
和 ,发生反应
,发生反应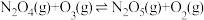 ,平衡时
,平衡时 在容器内的体积分数
在容器内的体积分数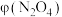 随温度变化的曲线如图甲所示【要考虑反应
随温度变化的曲线如图甲所示【要考虑反应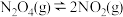 】
】
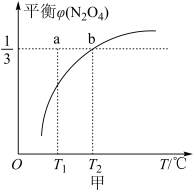
①a点的
_______  (填“>”“<”或“=”).
(填“>”“<”或“=”).
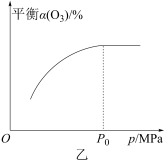
②对反应体系加压,得平衡时 的转化率
的转化率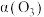 与压强的关系如图乙所示,请解释压强增大至
与压强的关系如图乙所示,请解释压强增大至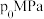 的过程中
的过程中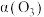 逐渐增大的原因:
逐渐增大的原因:_______
③图甲中,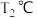 时,平衡后总压为
时,平衡后总压为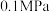 ,
, 和
和 的平衡分压相同,则反应
的平衡分压相同,则反应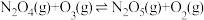 以压强表示的平衡常数
以压强表示的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)化工废水中常常含有以二甲胺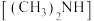 为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是①
为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是① 在阳极转化为
在阳极转化为 ;②
;② 在碱性溶液中歧化为
在碱性溶液中歧化为 ;③
;③ 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和
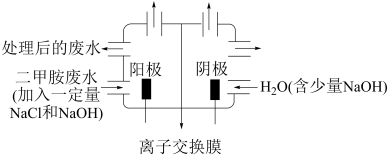
①写出电解池中阴极发生反应的化学方程式:_______
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是_______
③当阴极区收集到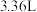 (标况下)气体时,阳极区收集到N2的体积(标况下)是
(标况下)气体时,阳极区收集到N2的体积(标况下)是_______ mL
(1)反应
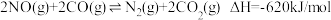 ,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应
,可有效降低汽车尾气污染物的排放.一定条件下该反应经历三个反应阶段,反应历程如图所示,三个反应中,属于吸热反应的是反应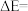


(2)硝化反应是最普遍和最早发现的有机反应之一,以
 为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用
为新型硝化剂的反应具有反应条件温和、反应速度快、选择性高、无副反应发生、过程无污染等优点,可利用 臭氧化法制备
臭氧化法制备 ,其反应为
,其反应为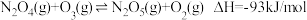 ,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)
,在恒温恒压条件下,下列说法能够说明该反应已经达到平衡的是_______(填序号)(不考虑其他反应干扰)| A.混合气体密度不再改变 |
B.消耗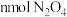 的同时,消耗了 的同时,消耗了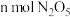 |
C. 浓度不再改变 浓度不再改变 |
| D.混合气体的平均相对分子质量不再改变 |
 和
和 ,发生反应
,发生反应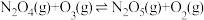 ,平衡时
,平衡时 在容器内的体积分数
在容器内的体积分数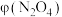 随温度变化的曲线如图甲所示【要考虑反应
随温度变化的曲线如图甲所示【要考虑反应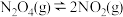 】
】
①a点的

 (填“>”“<”或“=”).
(填“>”“<”或“=”).②对反应体系加压,得平衡时
 的转化率
的转化率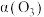 与压强的关系如图乙所示,请解释压强增大至
与压强的关系如图乙所示,请解释压强增大至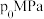 的过程中
的过程中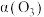 逐渐增大的原因:
逐渐增大的原因:
③图甲中,
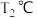 时,平衡后总压为
时,平衡后总压为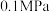 ,
, 和
和 的平衡分压相同,则反应
的平衡分压相同,则反应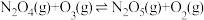 以压强表示的平衡常数
以压强表示的平衡常数
(4)化工废水中常常含有以二甲胺
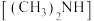 为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是①
为代表的含氮有机物,用电解法将二甲胺转化为无毒无害的气体排放,装置如图所示,反应原理是① 在阳极转化为
在阳极转化为 ;②
;② 在碱性溶液中歧化为
在碱性溶液中歧化为 ;③
;③ 将二甲胺氧化为
将二甲胺氧化为 ,
, 和
和

①写出电解池中阴极发生反应的化学方程式:
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是
③当阴极区收集到
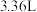 (标况下)气体时,阳极区收集到N2的体积(标况下)是
(标况下)气体时,阳极区收集到N2的体积(标况下)是
您最近一年使用:0次
名校
解题方法
8 . 随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 为原料合成尿素:
为原料合成尿素: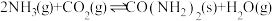

(1)下列有利于提高 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如图所示:
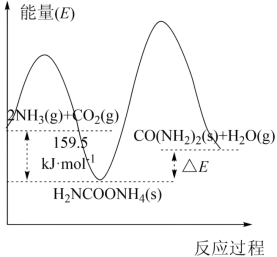
第一步:2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1
第二步:NH2COONH4(g)⇌CO(NH2)2(s)+H2O(g)△H2
①图中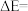
___________  。
。
②反应的决速步是___________ 反应(填“第一步”或“第二步”)。
II.以和催化重整制备合成气: 。
。
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应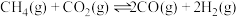 ,
, 的平衡转化率随温度、压强的变化关系如上图所示。
的平衡转化率随温度、压强的变化关系如上图所示。
①反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是___________ (填序号)。
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.容器中气体的平均相对分子质量不变
D.同时断裂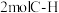 键和
键和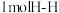 键
键
②由图可知,压强
___________  (填“>”、“<”或“=”,);
(填“>”、“<”或“=”,);
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则X点对应温度下的
,则X点对应温度下的
___________ (用含p2的代数式表示)。
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示
(4)阴极电极反应式为___________ ,该装置中使用的是___________ (填“阴”或“阳”)离子交换膜。
I.以
 和
和 为原料合成尿素:
为原料合成尿素: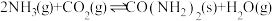

(1)下列有利于提高
 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |

第一步:2NH3(g)+CO2(g)⇌NH2COONH4(s)△H1
第二步:NH2COONH4(g)⇌CO(NH2)2(s)+H2O(g)△H2
①图中
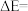
 。
。②反应的决速步是
II.以和催化重整制备合成气:
 。
。(3)在密闭容器中通入物质的量均为
 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应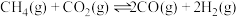 ,
, 的平衡转化率随温度、压强的变化关系如上图所示。
的平衡转化率随温度、压强的变化关系如上图所示。
①反应在恒温、恒容密闭容器中进行,下列叙述能说明反应到达平衡状态的是
A.容器中混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.容器中气体的平均相对分子质量不变
D.同时断裂
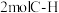 键和
键和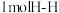 键
键②由图可知,压强

 (填“>”、“<”或“=”,);
(填“>”、“<”或“=”,);③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则X点对应温度下的
,则X点对应温度下的
III.电化学法还原二氧化碳制乙烯在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示

(4)阴极电极反应式为
您最近一年使用:0次
名校
9 . Cu2O是一种重要的工业原料,广泛用作化工催化剂。
I.制备Cu2O采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。

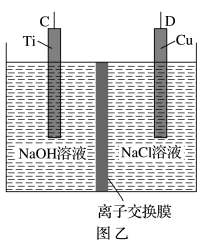
(1)上述装置中D电极应连接肼燃料电池的_______ 极(填“A”或“B”),该电解池中离子交换膜为_______ (填“阴”或“阳”)离子交换膜。
(2)该电解池的阴极反应式为_______ ,肼燃料电池中A极发生的电极反应式为_______ 。
(3)当反应生成14.4gCu2O时,至少需要肼_______ mol。
II.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH=-90.8kJ·mol-1,回答下列问题:
(4)能说明反应CO(g)+2H2(g) CH3OH(g),已达平衡状态的是_______(填字母)。
CH3OH(g),已达平衡状态的是_______(填字母)。
(5)t°C时,在体积为2L的固定体积的密闭容器中加入2.00molH2(g)和1.00mol的CO(g),CO(g)的物质的量随时间的变化如下表:
根据表中数据回答:
①10S内CH3OH(g)的反应速率_______ 。
②氢气平衡转化率为:_______ ;
③t°C时该反应的平衡常数为:_______ 。
④保持其它条件不变,再向平衡体系中再充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正_______ v逆(填“>”“<”或“=”)。
(6)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:_______ 。

I.制备Cu2O采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O,其装置如图甲、乙。


(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阴极反应式为
(3)当反应生成14.4gCu2O时,至少需要肼
II.纳米级Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH=-90.8kJ·mol-1,回答下列问题:
(4)能说明反应CO(g)+2H2(g)
 CH3OH(g),已达平衡状态的是_______(填字母)。
CH3OH(g),已达平衡状态的是_______(填字母)。| A.CO的消耗速率等于CH3OH的生成速率 |
| B.一定条件,CO的转化率不再变化 |
| C.在绝热恒容的容器中,反应的平衡常数不再变化 |
| D.n(CO):n(H2):n(CH3OH)=1:2:1 |
| 时间(s) | 0 | 2 | 5 | 10 | 20 | 40 | 80 |
| 物质的量(mol) | 1.00 | 0.50 | 0.375 | 0.25 | 0.20 | 0.20 | 0.20 |
①10S内CH3OH(g)的反应速率
②氢气平衡转化率为:
③t°C时该反应的平衡常数为:
④保持其它条件不变,再向平衡体系中再充入1molCO(g)、2molH2(g)、1molCH3OH(g);此时v正
(6)工业实际合成CH3OH生产中,采用如图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:

您最近一年使用:0次
名校
解题方法
10 . 醇类的制取是近年来研究的热点。通过CH3COOCH3为原料在催化剂作用下加氢可同时制取乙醇和甲醇,包括以下主要反应:
反应I:CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g) △H1=-71kJ·mol-1
反应II:CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g) △H2
(1)查阅资料知:标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成lmol纯化合物时的焓变,符号为 。已知以下物质的标准摩尔生成焓如下表所示:
。已知以下物质的标准摩尔生成焓如下表所示:
则C2H5OH(g)的标准摩尔生成焓 =
=_______ kJ∙mol-1。
(2)将一定量的CH3OH与CH3CHO混合气体置于绝热恒容密闭容器中,只发生反应II,逆反应速率随时间变化的趋势如图所示(不考虑催化剂的影响),则反应II的△H2_______ 0(填“>”“<”或“=”);下列选项中一定能说明反应II达到平衡状态的是_______ (填序号)。
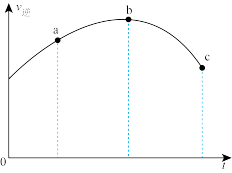
A.密闭体系的压强保持不变 B.甲醇与乙醛的分压之比不变
C.乙酸甲酯的体积分数保持不变 D.气体的平均摩尔质量保持不变
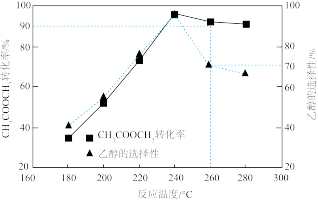
(3)一定条件下在1L密闭容器内通入一定量的CH3COOCH3和H2发生反应I和II,测得不同温度下达平衡时CH3COOCH3转化率和乙醇的选择性如图所示。温度高于240℃时,随温度升高乙醇的选择性降低的原因是_______ 。
(4)将物质的量均为amol的CH3COOCH3(g)和H2(g)分别加入恒温恒压的两个密闭容器甲(25℃、p1)、乙(25℃、p2)中,若只发生反应II,其正反应速率v正=k正·p(CH3COOCH3)·p(H2),p为物质分压,若容器甲与乙中平衡时正反应速率之比v甲:v乙=16:25,则甲、乙容器的体积之比为_______ 。
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示:
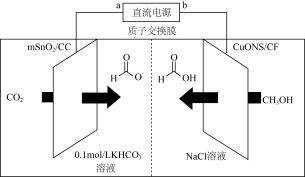
①若以Fe-Cu-浓硝酸构成的原电池为直流电源,则电极a应为_______ (填“Fe”或“Cu”)。电解过程中阳极上发生反应的电极反应式为_______ 。
②若有lmolH+通过质子交换膜时,则该装置生成HCOO-和HCOOH共计_______ mol。
反应I:CH3COOCH3(g)+2H2(g)⇌C2H5OH(g)+CH3OH(g) △H1=-71kJ·mol-1
反应II:CH3COOCH3(g)+H2(g)⇌CH3CHO(g)+CH3OH(g) △H2
(1)查阅资料知:标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成lmol纯化合物时的焓变,符号为
 。已知以下物质的标准摩尔生成焓如下表所示:
。已知以下物质的标准摩尔生成焓如下表所示:| 物质 | CH3COOCH3(g) | CH3CHO(g) |
 /kJ·mol-1 /kJ·mol-1 | -413 | -201 |
 =
=(2)将一定量的CH3OH与CH3CHO混合气体置于绝热恒容密闭容器中,只发生反应II,逆反应速率随时间变化的趋势如图所示(不考虑催化剂的影响),则反应II的△H2

A.密闭体系的压强保持不变 B.甲醇与乙醛的分压之比不变
C.乙酸甲酯的体积分数保持不变 D.气体的平均摩尔质量保持不变
(3)一定条件下在1L密闭容器内通入一定量的CH3COOCH3和H2发生反应I和II,测得不同温度下达平衡时CH3COOCH3转化率和乙醇的选择性如图所示。温度高于240℃时,随温度升高乙醇的选择性降低的原因是

(4)将物质的量均为amol的CH3COOCH3(g)和H2(g)分别加入恒温恒压的两个密闭容器甲(25℃、p1)、乙(25℃、p2)中,若只发生反应II,其正反应速率v正=k正·p(CH3COOCH3)·p(H2),p为物质分压,若容器甲与乙中平衡时正反应速率之比v甲:v乙=16:25,则甲、乙容器的体积之比为
(5)一种以甲醇为原料,利用SnO2(mSnO2/CC)和CuO纳米片(CuONS/CF)作催化电极,制备甲酸(甲酸盐)的电化学装置的工作原理如图所示:

①若以Fe-Cu-浓硝酸构成的原电池为直流电源,则电极a应为
②若有lmolH+通过质子交换膜时,则该装置生成HCOO-和HCOOH共计
您最近一年使用:0次